上海市奉贤区2023-2024学年九年级上学期11月期中考试化学试题
试卷更新日期:2023-11-23 类型:期中考试
一、选择题(共20分)
-
1. 属于物理变化的是( )A、砂纸打磨镁带 B、点燃烟花爆竹 C、植物光合作用 D、牛奶变质2. 下列物质含有游离态氢元素的是( )A、H2 B、H2O C、HCl D、空气3. 下列物质中属于纯净物的是( )A、河水 B、稀盐酸 C、蒸馏水 D、食醋4. 下列物质的用途体现其物理性质的是( )A、氮气作保护气 B、稀有气体填充霓虹灯 C、氧气供给呼吸 D、天然气作燃料5. 硫代硫酸钠,又名大苏打、海波,可用于照相业作定影剂。硫代硫酸钠(Na2S2O3)中硫元素的化合价为( )A、-2 B、+2 C、+4 D、+66. 下列化学方程式书写正确且属于化合反应的是( )A、 B、 C、 D、7. 有关实验现象的描述中,说法正确的是( )A、红磷在空气中燃烧,生成大量白色烟雾 B、铁丝在空气中剧烈燃烧,火星四射,生成黑色固体 C、镁条在空气中燃烧,发出耀眼白光,生成白色粉末 D、木炭在氧气中剧烈燃烧,发出白光,生成二氧化碳8. 下列各图中“
 ”“
”“ ”分别表示不同元素的原子,其中可表示化合物的是( ) A、
”分别表示不同元素的原子,其中可表示化合物的是( ) A、 B、
B、 C、
C、 D、
D、 9. 下列有关空气的说法错误的是( )A、按质量计算,空气 中含有氮气约78%,氧气约21% B、空气中各种成分的含量是相对稳定的 C、空气是一种十分重要的天然资源 D、PM2.5是造成空气污染的主要污染物之一10. 如图所示,检查装置气密性时观察到导管口有气泡冒出,对此现象的微观解释正确的是( )
9. 下列有关空气的说法错误的是( )A、按质量计算,空气 中含有氮气约78%,氧气约21% B、空气中各种成分的含量是相对稳定的 C、空气是一种十分重要的天然资源 D、PM2.5是造成空气污染的主要污染物之一10. 如图所示,检查装置气密性时观察到导管口有气泡冒出,对此现象的微观解释正确的是( ) A、装置内气体分子的数目增多 B、装置内气体分子的间隔变大 C、装置内气体分子的种类发生变化 D、装置内气体分子的大小发生变化11. “物质的量”是国际单位制中的一个基本物理量,有关说法正确的是( )A、28gN2含1mol氮 B、1molO2约含6.02×1023个氧原子 C、1molCO2含有3mol原子 D、H2O的摩尔质量是1812. 下列物质不能用颜色来区别的是( )A、稀盐酸、双氧水 B、木炭、硫粉 C、四氧化三铁、氧化镁 D、硫酸铜溶液、氢氧化钠溶液13. 如图是某化学反应前后的微观示意图,下列说法错误的是( )
A、装置内气体分子的数目增多 B、装置内气体分子的间隔变大 C、装置内气体分子的种类发生变化 D、装置内气体分子的大小发生变化11. “物质的量”是国际单位制中的一个基本物理量,有关说法正确的是( )A、28gN2含1mol氮 B、1molO2约含6.02×1023个氧原子 C、1molCO2含有3mol原子 D、H2O的摩尔质量是1812. 下列物质不能用颜色来区别的是( )A、稀盐酸、双氧水 B、木炭、硫粉 C、四氧化三铁、氧化镁 D、硫酸铜溶液、氢氧化钠溶液13. 如图是某化学反应前后的微观示意图,下列说法错误的是( ) A、该反应属于分解反应 B、生成的甲、乙分子个数比是1∶4 C、该反应前后原子个数不变 D、反应物的1个分子中含有4个原子14. 密闭容器中,碳粉与氧气的反应方程式为 , 有关说法正确的是( )A、有1g碳粉参加反应,气体总质量增加1g B、随着反应进行,CO2的摩尔质量不断变大 C、随着反应进行,混合气体中碳元素的质量分数不变 D、反应前后,容器中气体中所含的氧原子数变大15. “粗盐提纯”的实验内容和步骤如下,说法正确的是( )
A、该反应属于分解反应 B、生成的甲、乙分子个数比是1∶4 C、该反应前后原子个数不变 D、反应物的1个分子中含有4个原子14. 密闭容器中,碳粉与氧气的反应方程式为 , 有关说法正确的是( )A、有1g碳粉参加反应,气体总质量增加1g B、随着反应进行,CO2的摩尔质量不断变大 C、随着反应进行,混合气体中碳元素的质量分数不变 D、反应前后,容器中气体中所含的氧原子数变大15. “粗盐提纯”的实验内容和步骤如下,说法正确的是( ) A、操作I称量粗盐可放在烧杯中称量 B、操作Ⅲ中应尽量多加些水,防止食盐不能完全溶解 C、操作IV中得到的滤渣是粗盐中的难溶性杂质 D、操作V中需加热至液体蒸干为止16.
A、操作I称量粗盐可放在烧杯中称量 B、操作Ⅲ中应尽量多加些水,防止食盐不能完全溶解 C、操作IV中得到的滤渣是粗盐中的难溶性杂质 D、操作V中需加热至液体蒸干为止16.化学概念间有包含、并列、交叉等不同关系.下列选项符合如图所示关系的是( )
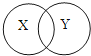
A
B
C
D
X
化合反应
纯净物
物理变化
化学反应
Y
氧化反应
混合物
化学变化
化合反应
A、A B、B C、C D、D17. 关于化合物的说法一定正确的是( )A、组成中含有原子团 B、各元素的原子个数比等于组成元素的质量比 C、若组成中含有氧元素,则是氧化物 D、化合价正价总数和负价总数的代数和等于零二、简答题 (共30分)
-
18. 生活中处处有化学,规范书写化学用语是学习化学的基础。化学用语可准确、简洁地记录,表达和交流化学信息。以下用化学语言回答:
①常代替氢气充气球的气体;
②人体中含量最多的金属元素是;
③形成酸雨的主要气体是;
④用于区别石灰水和蒸馏水的气体是 , 其反应的化学方程式为。
19. 第19届杭州亚运会,零碳甲醇首次点燃亚运会主火炬。甲醇(CH3OH)由种元素组成,其分子中C、H、O原子物质的量之比为 , 2mol甲醇中约含个氧原子。20. 实验室制取氧气是初中重要化学实验之一,请回答下列问题。 (1)、实验室过氧化氢溶液和二氧化锰混合制取较干燥的氧气,应选择装置组合是(从装置A-F中选择);若要制取1.6克氧气,需要过氧化氢克。(2)、某同学用加热氯酸钾和二氧化锰混合物的方法制取并收集2瓶较纯净的氧气,但最终只收集到了1瓶氧气,可能的原因是(填序号)。
(1)、实验室过氧化氢溶液和二氧化锰混合制取较干燥的氧气,应选择装置组合是(从装置A-F中选择);若要制取1.6克氧气,需要过氧化氢克。(2)、某同学用加热氯酸钾和二氧化锰混合物的方法制取并收集2瓶较纯净的氧气,但最终只收集到了1瓶氧气,可能的原因是(填序号)。I.装置气密性不好
II.氯酸钾的量不足III.二氧化锰的量不足
IV.温度不够③若用环保空塑料输液袋G装置收集氧气,验满时,将带火星的木条放在导管
21. 利用V型管进行空气中氧气含量的测定实验。V型管内装有足量的白磷,白磷燃烧所需最低温度为40℃,因此反应很容易发生。试回答以下问题:
 (1)、白磷燃烧的化学方程式为。(2)、如果装置气密性不好,则测出的氧气的体积分数(填“偏大”“偏小”或“不变”)。(3)、此装置与教材上的装置相比,其优点是(写一点即可)。(4)、已知V型管的容积为120mL,量筒内有100mL水。待白磷熄灭,装置冷却至室温后打开弹簧夹,量筒中的水倒吸进入V型管内,理论上可观察到量筒内液面下降至mL处。22. 兴趣小组同学在老师的带领下,探究影响过氧化氢分解速率的因素。
(1)、白磷燃烧的化学方程式为。(2)、如果装置气密性不好,则测出的氧气的体积分数(填“偏大”“偏小”或“不变”)。(3)、此装置与教材上的装置相比,其优点是(写一点即可)。(4)、已知V型管的容积为120mL,量筒内有100mL水。待白磷熄灭,装置冷却至室温后打开弹簧夹,量筒中的水倒吸进入V型管内,理论上可观察到量筒内液面下降至mL处。22. 兴趣小组同学在老师的带领下,探究影响过氧化氢分解速率的因素。【提出问题】影响过氧化氢分解速率的因素有哪些?
【作出假设】猜想1:催化剂的种类 猜想2:过氧化氢溶液的浓度 猜想3:温度
【实验探究】学生利用如图1所示装置,以收集50mL的气体为标准,比较反应的快慢,实验方案如下表所示:
实验
温度/℃
过氧化氢溶液浓度
过氧化氢溶液体积/mL
1g催化剂
时间/s
1
20
5%
40
二氧化锰
37
2
20
10%
40
二氧化锰
14
3
20
5%
40
氧化铜
t
4
80
5%
40
二氧化锰
29
 (1)、对比实验1和2,得出的结论是。(2)、通过对比实验1和3,得出二氧化锰的催化效果比氧化铜强的实验依据是 , 通过实验和对比,证明猜想3成立(3)、实验过程中,学生触摸锥形瓶外壁,有发烫的感觉,说明过氧化氢分解的反应是放热反应。在实验3探究中,测出了实验过程中装置压强与时间的关系图(图2),BC段压强急剧上升原因是。23. 某兴趣小组探究实验前后质量的变化,用下图装置进行实验。
(1)、对比实验1和2,得出的结论是。(2)、通过对比实验1和3,得出二氧化锰的催化效果比氧化铜强的实验依据是 , 通过实验和对比,证明猜想3成立(3)、实验过程中,学生触摸锥形瓶外壁,有发烫的感觉,说明过氧化氢分解的反应是放热反应。在实验3探究中,测出了实验过程中装置压强与时间的关系图(图2),BC段压强急剧上升原因是。23. 某兴趣小组探究实验前后质量的变化,用下图装置进行实验。 (1)、实验1:一段时间后电子天平示数(填“变大”“变小”或“不变”),从微观角度解释原因。(2)、实验2:反应后电子天平示数变小的原因是。因此,有气体参加或生成的反应,验证质量守恒定律,需在装置中进行(填“密闭”或“敞口”)。(3)、实验3:引燃前电子天平示数为m1 , 用激光笔引燃铁粉,实验后冷却至室温,电子天平示数m1(填“>”“<”或“=”)。接着拧松锥形瓶上的橡皮塞 , 电子天平示数m1(填“>”“<”或“=”),请解释原因。锥形瓶的底部铺有一层细沙,其作用是。实验时若取用铁粉的量不足,对验证质量守恒定律实验的结果(填“有”或“没有”)影响。
(1)、实验1:一段时间后电子天平示数(填“变大”“变小”或“不变”),从微观角度解释原因。(2)、实验2:反应后电子天平示数变小的原因是。因此,有气体参加或生成的反应,验证质量守恒定律,需在装置中进行(填“密闭”或“敞口”)。(3)、实验3:引燃前电子天平示数为m1 , 用激光笔引燃铁粉,实验后冷却至室温,电子天平示数m1(填“>”“<”或“=”)。接着拧松锥形瓶上的橡皮塞 , 电子天平示数m1(填“>”“<”或“=”),请解释原因。锥形瓶的底部铺有一层细沙,其作用是。实验时若取用铁粉的量不足,对验证质量守恒定律实验的结果(填“有”或“没有”)影响。