广东省深圳市光明区高级名校2023-2024学年高一上学期10月月考化学试题
试卷更新日期:2023-11-23 类型:月考试卷
一、选择题:本题共16个小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 分类是化学研究与学习过程中一项重要思想,下列关于物质的类别说法不正确的是( )A、碱性氧化物一定是金属氧化物 B、胶体是一种能产生丁达尔效应的分散系 C、纯碱不属于碱,干冰属于酸性氧化物 D、能在水溶液或熔融状态下导电的物质就是电解质2. 已知NaCl在不同的溶剂中可以形成不同的分散系:100克NaCl溶解在水中形成无色透明的溶液(分散系①);100克NaCl溶解在乙醇中形成无色透明的胶体(分散系②)。下列说法正确的是( )A、分散系①中分散质的微粒直径介于1~100nm B、分散系②与云、雾为同一种类型的分散系 C、分散系②中,不能透过滤纸 D、两种分散系都有丁达尔效应3. 思考下列“五连环”中物质间发生的反应,没有涉及的基本反应类型是( )
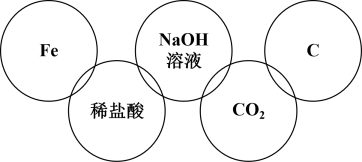 A、复分解反应 B、分解反应 C、化合反应 D、置换反应4. 下列说法正确的是( )A、NaCl晶体中含有Na+、Cl- , 所以NaCl晶体能导电 B、CO2溶于水能导电,所以CO2是电解质 C、BaSO4难溶于水, BaSO4是非电解质 D、Cl2的水溶液能够导电,但Cl2既不是电解质也不是非电解质5. 下列电离方程式中,正确的是( )A、硫酸钠溶液:Na2SO4 = Na+ + 2SO B、熔融状态的硫酸氢钠:NaHSO4 = Na+ + H+ + SO C、硫酸铝溶液:Al2(SO4)3=2Al3+ + 3SO D、碳酸氢钠溶液:NaHCO3 = Na+ + H+ + CO6. 下列属于电解质的是( )A、氯化钠 B、蔗糖 C、氯气 D、盐酸7. 下列关于物质分类的正确组合是( )
A、复分解反应 B、分解反应 C、化合反应 D、置换反应4. 下列说法正确的是( )A、NaCl晶体中含有Na+、Cl- , 所以NaCl晶体能导电 B、CO2溶于水能导电,所以CO2是电解质 C、BaSO4难溶于水, BaSO4是非电解质 D、Cl2的水溶液能够导电,但Cl2既不是电解质也不是非电解质5. 下列电离方程式中,正确的是( )A、硫酸钠溶液:Na2SO4 = Na+ + 2SO B、熔融状态的硫酸氢钠:NaHSO4 = Na+ + H+ + SO C、硫酸铝溶液:Al2(SO4)3=2Al3+ + 3SO D、碳酸氢钠溶液:NaHCO3 = Na+ + H+ + CO6. 下列属于电解质的是( )A、氯化钠 B、蔗糖 C、氯气 D、盐酸7. 下列关于物质分类的正确组合是( )一元碱
一元酸
正盐
碱性氧化物
酸性氧化物
A
B
NaOH
HCl
NaCl
CO
C
D
KOH
CaO
A、A B、B C、C D、D8. 需加入适当的氧化剂才能实现的反应是( )A、 B、 C、 D、浓盐酸9. 关于反应KClO3 + 6HCl(浓) = KCl + 3Cl2↑+ 3H2O,下列说法正确的是( )A、被氧化的氯原子与被还原的氯原子的个数之比为6:1 B、在反应中HCl只表现出还原性 C、氧化性:KClO3>Cl2 D、用双线桥法表示电子得失情况: 10. 图 a~c 分别为氯化钠在不同状态下的导电实验(X、Y 均表示石墨电极,X 与电源正极相
10. 图 a~c 分别为氯化钠在不同状态下的导电实验(X、Y 均表示石墨电极,X 与电源正极相连, Y 与电源负极相连)微观示意图。下列说法正确的是( )
 A、图示中
A、图示中 代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图 b 表示熔融状态下氯化钠的导电过程
D、氯化钠在不同状态下均能导电
11. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、澄清透明的溶液中:Fe3+、Ba2+、NO、Cl- B、使酚酞变红色的溶液中:Na+、NH4+、Cl-、SO C、可以与铁反应产生氢气的溶液中:K+、Cl-、SO、NO3- D、可以使紫色石蕊试液变红的溶液中:K+、Na+、HCO、NO12. 下列离子方程式中,正确的是( )A、稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2O B、氧化镁与稀盐酸混合:MgO + 2H+ = Mg2+ + H2O C、铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag D、稀硫酸与氢氧化钡反应:H+ + SO+ Ba2+ + OH- = BaSO4 ↓+ H2O13. Na2SO3与K2Cr2O7按照3:1恰好完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4 , 则Cr在还原产物中的化合价为( )A、+2 B、+3 C、+4 D、+514. 下列有关氧化还原反应的说法正确的是( )A、3SiO2 + 6C + 2N2Si3N4 + 6CO该反应中氧化剂和还原剂个数比为3∶1 B、在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 C、5H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5O2↑反应中,转移的电子数为5e− D、CaH2 + 2H2O = Ca(OH)2 + 2H2↑反应中,Ca(OH)2既不是氧化产物也不是还原产物15. 下列化学反应中电子转移的表示方法正确的是( )A、
代表的是水合钠离子
B、氯化钠只有在通电条件下才能电离
C、图 b 表示熔融状态下氯化钠的导电过程
D、氯化钠在不同状态下均能导电
11. 常温下,下列各组离子在指定溶液中一定能大量共存的是( )A、澄清透明的溶液中:Fe3+、Ba2+、NO、Cl- B、使酚酞变红色的溶液中:Na+、NH4+、Cl-、SO C、可以与铁反应产生氢气的溶液中:K+、Cl-、SO、NO3- D、可以使紫色石蕊试液变红的溶液中:K+、Na+、HCO、NO12. 下列离子方程式中,正确的是( )A、稀硫酸滴在铜片上:Cu + 2H+ = Cu2+ + H2O B、氧化镁与稀盐酸混合:MgO + 2H+ = Mg2+ + H2O C、铜片插入硝酸银溶液中:Cu + Ag+ = Cu2+ + Ag D、稀硫酸与氢氧化钡反应:H+ + SO+ Ba2+ + OH- = BaSO4 ↓+ H2O13. Na2SO3与K2Cr2O7按照3:1恰好完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4 , 则Cr在还原产物中的化合价为( )A、+2 B、+3 C、+4 D、+514. 下列有关氧化还原反应的说法正确的是( )A、3SiO2 + 6C + 2N2Si3N4 + 6CO该反应中氧化剂和还原剂个数比为3∶1 B、在氧化还原反应中,氧化剂与还原剂不可能是同一种物质 C、5H2O2 + 2KMnO4 + 3H2SO4 = K2SO4 + 2MnSO4 + 8H2O + 5O2↑反应中,转移的电子数为5e− D、CaH2 + 2H2O = Ca(OH)2 + 2H2↑反应中,Ca(OH)2既不是氧化产物也不是还原产物15. 下列化学反应中电子转移的表示方法正确的是( )A、 B、
B、 C、
C、 D、
D、 16. 现有下列几个反应:
16. 现有下列几个反应:①Cl2+2Br-=Br2+2Cl-
②Cr2O+14H++6Cl-=2Cr3++3Cl2↑+7H2O
③2Fe2++Br2=2Fe3++2Br-
④2Fe3++SO2+2H2O=2Fe2++SO+4H
下列有关性质的比较正确的是( )
A、氧化性:Cr2O>Cl2>Fe3+ B、氧化性:Cl2>Br2>Cr2O C、还原性:SO2<Fe2+<Br- D、还原性:Cl->Cr3+>Fe2+二、非选择题:本题共5个小题,共56分。
-
17. 现有下列10种物质:①钠 ②纯醋酸 ③氨气 ④浓盐酸 ⑤NaOH溶液 ⑥KClO3固体 ⑦熔融的NaCl ⑧NaHSO4固体 ⑨高锰酸钾粉末 ⑩氢氧化铁胶体。回答下列问题:(1)、上述物质中能导电的有 (填序号,下同);属于电解质的有。(2)、⑧属于 (填“酸”、“碱”或“盐”),⑧与⑤在溶液中反应的离子方程式为。(3)、④和⑨混合发生反应(未配平)KMnO4 + HCl(浓) → MnCl2 + Cl2↑ + KCl + H2O,其中被氧化的离子为被还原的离子为。(4)、写出制备⑩的化学方程式。18. 铁是人体含量最多的微量元素,这些铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,所以给贫血者补充铁时,应该给予含亚铁离子的亚铁盐,如硫酸亚铁。(1)、以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是____。A、Fe B、Fe2+ C、Fe3+(2)、工业盐的主要成分是NaNO2 , 以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有性。下列能实现这种转化的物质是(填字母)。
A.Cl2 B.H2 C.Fe D.CO
(3)、工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有性。(4)、在Fe + 4HNO3 = Fe(NO3)3 + NO↑ + 2H2O的反应中,HNO3表现出了性,每有1个Fe参加反应,被还原的HNO3为个,转移电子数个。19. 材料一:现有一包白色固体粉末,由Na2SO4、CaCO3、NaCl、BaCl2、CuSO4中的几种物质组成,为确定其成分,进行如下实验:Ⅰ.取少量白色粉末,加入足量水,充分搅拌后过滤,得到白色沉淀和无色滤液;
Ⅱ.向Ⅰ滤出沉淀中加入足量稀盐酸,沉淀部分溶解,并产生无色气体。
据此回答下列问题:
(1)、原白色固体粉末中一定含有 , 可能含有 , 一定不含有(填化学式)。(2)、实验Ⅰ中发生反应的离子方程式为 , 实验Ⅱ中发生反应的离子方程式为。(3)、不做任何实验就可以肯定原溶液中不存在的离子是。取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是。材料二:无色透明溶液中可能大量存在Ag+、Ca2+、Cu2+、Fe3+、Na+中的几种。请填写下列空白:20. 下面三个方法都可以用来制氯气:①4HCl(浓) + MnO2MnCl2 + Cl2↑ + 2H2O
②KClO3 + 6HCl(浓)=3Cl2↑ + KCl + 3H2O
③KMnO4 + HCl(浓)——KCl + MnCl2 + Cl2↑ + H2O(未配平)
根据以上三个反应,回答下列有关问题:
(1)、反应②中,氧化产物与还原产物的质量比为。(2)、若要制得相同质量的氯气,①②③反应中电子转移的数目之比为。(3)、请将反应③配平:KMnO4+HCl(浓)=KCl+MnCl2+Cl2↑+H2O
(4)、工业废水中的Cr2O有毒,常在酸性条件下用Fe2+做处理剂,将Cr2O转化为Cr3+ , 其中Fe2+会被转化为Fe3+ , 反应的离子方程式。