【备考2024年】高考化学全国乙卷真题变式分层精准练第9题
试卷更新日期:2023-11-18 类型:二轮复习
一、原题
-
1. LiMn2O4作为一种新型锂电池正极材料受到广泛关注。由菱锰矿(MnCO3 , 含有少量Si、Fe、Ni、Al等元素)制备LiMn2O4的流程如下:
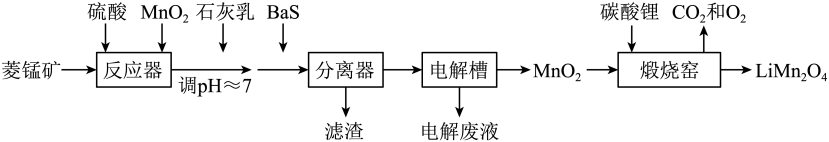
已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:
(1)、硫酸溶矿主要反应的化学方程式为。为提高溶矿速率,可采取的措施(举1例)。(2)、加入少量MnO2的作用是。不宜使用H2O2替代MnO2 , 原因是。(3)、溶矿反应完成后,反应器中溶液pH=4,此时c(Fe3+)=mol·L-1;用石灰乳调节至pH≈7,除去的金属离子是。(4)、加入少量BaS溶液除去Ni2+ , 生成的沉淀有。(5)、在电解槽中,发生电解反应的离子方程式为。随着电解反应进行,为保持电解液成分稳定,应不断。电解废液可在反应器中循环利用。(6)、缎烧窑中,生成LiMn2O4反应的化学方程式是。二、基础
-
2. 关于化工生产,下列说法错误的是( )A、工业常用电解饱和食盐水的方法来制取氯气 B、硫酸工业在常压下用SO2与O2反应制取SO3 C、联合制碱法、氨碱法所需的CO2都来自石灰石的分解 D、通常以海带、紫菜等为原料提取碘3. 部分常见含氯物质的分类与相应化合价关系如图所示。下列推断不合理的是 ( )
 A、既可被氧化,也可被还原 B、的浓溶液可与的固体反应生成与 C、实验室可通过加热与的浓溶液制得 D、可存在的循环转化关系4. 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一,氰酸盐进一步被氧化为无毒物质。(1)、某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O。投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式:KOCN+KOH+Cl2—CO2+N2+KCl+H2O,。(2)、若处理上述废水100L,使KCN完全转化为无毒物质,至少需要投放液氯多少克?(3)、氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:
A、既可被氧化,也可被还原 B、的浓溶液可与的固体反应生成与 C、实验室可通过加热与的浓溶液制得 D、可存在的循环转化关系4. 在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一,氰酸盐进一步被氧化为无毒物质。(1)、某厂废水中含KCN,其浓度为650mg/L。现用氯氧化法处理,发生如下反应:KCN+2KOH+Cl2=KOCN+2KCl+H2O。投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式:KOCN+KOH+Cl2—CO2+N2+KCl+H2O,。(2)、若处理上述废水100L,使KCN完全转化为无毒物质,至少需要投放液氯多少克?(3)、氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出:①(CN)2与KOH溶液反应的化学方程式:。
②在NaBr和KSCN的混合溶液中滴加少量(CN)2 , 反应的离子方程。
5. 铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。(1)、铁元素有三种常见的氧化物,分别是 FeO、Fe2O3、Fe3O4.其中具有磁性的是 , 可作为红色颜料的是。(2)、某补铁口服液中含有 Fe2+ , 为检验其是否被氧化变质,可取少量该口服液,向其中滴加 KSCN 溶液,若溶液变为色,则说明其已变质。向该口服液中加入维生素 C 可防止其被氧化变质,此过程中利用了维生素 C 的性。(3)、FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2 , 该反应的化学方程式为。6. 根据所学知识回答下列有关问题。(1)、信息技术离不开芯片,现代芯片离不开高纯度的硅,工业上生产高纯硅的工艺流程如下:
①硅除用于制造芯片外,在能量转化方面也有极为重要的用途,该用途是(填一种),写出制备粗硅反应的化学方程式:。
②过程②是置换反应,则该反应中得到的单质为(填化学式)。
(2)、碳纳米材料是一种具有重要用途的新型无机非金属材料,其中的化学性质与金刚石(填“相似”或“不同”),完全燃烧时需要消耗 , 该反应会(填“吸收”或“释放”)能量。7.(1)、Ⅰ.我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时发生的反应为:S+2KNO3+3C=K2S+N2↑+3X↑请回答:X的化学式是 , 按照物质的组成和性质分类,属于(填字母)。
A.单质 B.酸性氧化物 C.化合物 D.盐
(2)、在上述反应中,氧化剂是(填化学式)。(3)、写出在NaOH溶液中通入过量的X气体发生反应的化学方程式。(4)、若反应过程消耗了2.4g木炭粉,此时转移的电子数为。(5)、高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,主要用于饮用水处理。工业制备高铁酸钠有多种方法。其中一种方法的化学原理可用离子方程式表示为:3ClO-+2Fe3++10OH-=2FeO+3Cl-+5H2O。用单线桥标出上述方程式的电子转移方向和数目。三、提高
-
8. 海洋资源的利用具有非常广阔的前景。回答下列问题:
Ⅰ.海水提溴
 (1)、溴元素在元素周期表中的位置为(2)、吸收塔用二氧化硫和水吸收的离子方程式为:(3)、蒸馏塔的蒸馏温度应控制在最有利于生产,原因可能为:温度过高,;温度过低,(4)、两次通入的离子反应相同,其离子方程式为 , 通反应后使用了空气吹出法,该方法利用了溴单质的性质。(5)、Ⅱ.海水提镁
(1)、溴元素在元素周期表中的位置为(2)、吸收塔用二氧化硫和水吸收的离子方程式为:(3)、蒸馏塔的蒸馏温度应控制在最有利于生产,原因可能为:温度过高,;温度过低,(4)、两次通入的离子反应相同,其离子方程式为 , 通反应后使用了空气吹出法,该方法利用了溴单质的性质。(5)、Ⅱ.海水提镁
工业上常用于沉淀的廉价试剂①的俗名是。操作Ⅰ的名称是。
(6)、步骤A的化学方程式为(7)、Ⅲ.海带提碘
步骤B需搅拌、加热煮沸的目的是。步骤C中反应的离子方程式为
9. 我国化学家侯德榜发明了联合制碱法,对世界制碱工业做出了巨大贡献。联合制碱法的主要过程如下(部分物质已略去)。
已知:氨气极易溶于水,无水氯化钙可与反应生成固体。
(1)、写出过程①的化学方程式。原料有两种气体,应先通入(填“”或“”),原因是。(2)、某同学用如图装置模拟工业过程①。实验时,须从管通入(填“a”或“b”),装置c的作用是。 (3)、若在实验室进行过裎③,实验操作的名称是。(4)、侯氏制碱法工业生产过程中,可循环利用的物质是、。10. 氯碱工业是高能耗产业,节能技术的研发是当前的重要课题。(1)、一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。
(3)、若在实验室进行过裎③,实验操作的名称是。(4)、侯氏制碱法工业生产过程中,可循环利用的物质是、。10. 氯碱工业是高能耗产业,节能技术的研发是当前的重要课题。(1)、一种节能技术是将电解池与燃料电池相组合,相关物料传输与转化关系如下图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过。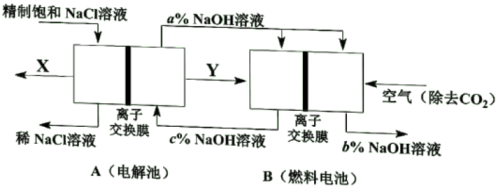
①当产生0.5molX时,A中通过离子交换膜的Na+有mol。
②写出燃料电池B中负极上的电极反应式。
③比较图中NaOH质量分数a%、b%、c%由大到小的顺序。
(2)、降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2 , 避免水电离的H+直接得电子生成H2 , 降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应式为。11. 海水中溴元素主要以Br— 形式存在,工业上从海水中提取溴的流程如下: (1)、将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:(2)、吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是:
(1)、将吹出后的含Br2的空气按一定速率通入吸收塔,用SO2和水进行吸收,写出吸收反应的化学方程式:(2)、吸收后的空气进行循环利用。吹出时,Br2 吹出率与吸收塔中SO2流量的关系如图所示。SO2 流量过大,Br2 吹出率反而下降的原因是: (3)、工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2 , 完成下列化学方程式:Br2+ Na2CO3NaBrO3+ CO2+
(3)、工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2 , 完成下列化学方程式:Br2+ Na2CO3NaBrO3+ CO2+当有3molBr2参加反应,发生转移的电子的物质的量为。
(4)、用于吸收Br2的SO2是工业制硫酸的重要物质,其中主反应是催化氧化SO2.现将SO2与足量O2置于密闭容器中,在催化剂、500℃条件下发生反应。SO2与SO3的物质的量浓度随时间的变化如图所示,请回答下列问题。
i.反应开始至2min末,以SO2 的浓度变化表示该反应的平均速率是;2min时,反应是否达到化学平衡状态(填“是”或“否”)。
ii.关于该反应下列说法不正确的是。
a.催化剂可以增大化学反应速率
b.改变温度或压强,可以实现SO2的完全转化
c.若仅增大容器容积,则该化学反应速率增大
四、培优
-
12. 以银锰精矿主要含、、和氧化锰矿主要含为原料联合提取银和锰的一种流程示意图如下。
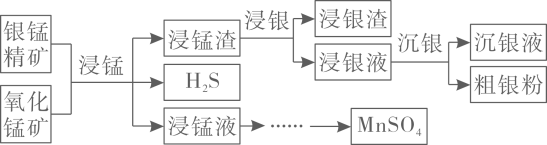
已知:酸性条件下,的氧化性强于。
(1)、“浸锰”过程是在溶液中使矿石中的锰元素浸出,同时去除 , 有利于后续银的浸出;矿石中的银以的形式残留于浸锰渣中。“浸锰”过程中,发生反应 , 则可推断:填“”或“”。
在溶液中,银锰精矿中的和氧化锰矿中的发生反应,则浸锰液中主要的金属阳离子有。
(2)、“浸银”时,使用过量和的混合液作为浸出剂,将中的银以形式浸出。将“浸银”反应的离子方程式补充完整:
结合平衡移动原理,解释浸出剂中的作用:。
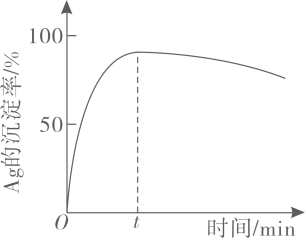
(3)、“沉银”过程中需要过量的铁粉作为还原剂。该步反应的离子方程式有。
一定温度下,的沉淀率随反应时间的变化如图所示。解释分钟后的沉淀率逐渐减小的原因:。
 (4)、结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:。13. 三氯化铬()为紫色单斜晶体,熔点为83℃,易潮解,易升华,溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。(1)、某化学小组用和在高温下制备无水三氯化铬,部分实验装置如图所示,其中三颈烧瓶内装有 , 其沸点为76.8℃。
(4)、结合“浸锰”过程,从两种矿石中各物质利用的角度,分析联合提取银和锰的优势:。13. 三氯化铬()为紫色单斜晶体,熔点为83℃,易潮解,易升华,溶于水但不易水解,高温下能被氧气氧化,工业上主要用作媒染剂和催化剂。(1)、某化学小组用和在高温下制备无水三氯化铬,部分实验装置如图所示,其中三颈烧瓶内装有 , 其沸点为76.8℃。
①Cr原子的价电子排布式为。
②实验前先往装置A中通入 , 其目的是排尽装置中的空气,在实验过程中还需要持续通入 , 其作用是。
③装置C的水槽中应盛有(填“冰水”或“沸水”)。
④装置B中还会生成光气(),B中反应的化学方程式为。
(2)、的工业制法:先用40%的NaOH将红矾钠()转化为铬酸钠(),加入过量 , 再加入10%HCl溶液,可以看到有气泡产生。写出用将铬酸钠()还原为的离子方程式。(3)、为进一步探究的性质,某同学取试管若干支,分别加入10滴溶液,并用4滴酸化,再分别加入不同滴数的0.1mol/L溶液,并在不同的温度下进行实验,反应现象记录于表中。的用量(滴数)
在不同温度下的反应现象
25℃
90-100℃
1
紫红色
蓝绿色溶液
2~9
紫红色
黄绿色溶液,且随滴数增加,黄色成分增多
10
紫红色
澄清的橙黄色溶液
11~23
紫红色
橙黄色溶液,有棕褐色沉淀,且随滴数增加,沉淀增多
24~25
紫红色
紫红色溶液,有较多的棕褐色沉淀
①温度对反应的影响。
与在常温下反应,观察不到离子的橙色,甲同学认为其中一个原因是离子的橙色被离子的紫红色掩盖,另一种可能的原因是 , 所以必须将反应液加热至沸腾4~5min后,才能观察到反应液由紫红色逐渐变为橙黄色的实验现象。
②与的用量对反应的影响。
对表中数据进行分析,在上述反应条件下,欲将氧化为 , 与最佳用量比为。这与由反应所推断得到的用量比不符,你推测的原因是。
14. 某工厂采用如下工艺处理镍钴矿硫酸浸取液含(和)。实现镍、钴、镁元素的回收。
已知:
物质
回答下列问题:
(1)、用硫酸浸取镍钴矿时,提高浸取速率的方法为(答出一条即可)。(2)、“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 , 中过氧键的数目为。(3)、“氧化”中,用石灰乳调节 , 被氧化为 , 该反应的离子方程式为(的电离第一步完全,第二步微弱);滤渣的成分为、(填化学式)。(4)、“氧化”中保持空气通入速率不变,(Ⅱ)氧化率与时间的关系如下。体积分数为时,(Ⅱ)氧化速率最大;继续增大体积分数时,(Ⅱ)氧化速率减小的原因是。 (5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。15. 工业上常用电解熔融氧化铝的方法来生产铝锭,其电解的氧化铝纯度不得低于 98.2%,而天然铝土矿中的氧化铝含量为 50%~70%,杂质主要为 SiO2、Fe2O3、MgO 等。工业生产铝锭的工艺流程如下图:
(5)、“沉钴镍”中得到的(Ⅱ)在空气中可被氧化成 , 该反应的化学方程式为。(6)、“沉镁”中为使沉淀完全 , 需控制不低于(精确至0.1)。15. 工业上常用电解熔融氧化铝的方法来生产铝锭,其电解的氧化铝纯度不得低于 98.2%,而天然铝土矿中的氧化铝含量为 50%~70%,杂质主要为 SiO2、Fe2O3、MgO 等。工业生产铝锭的工艺流程如下图: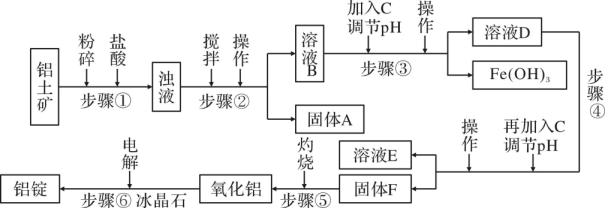
一些难溶物开始沉淀和完全沉淀的 pH 如表所示:
沉淀物
Al(OH)3
Fe(OH)3
Mg(OH)2
开始沉淀 pH(离子初始浓度为 0.01mol·L-1)
4
2.3
10.4
完全沉淀 pH(离子浓度<10-5mol·L-1)
5.2
3.2
12.4
请回答下列问题:
(1)、步骤①粉碎的目的;步骤②③④中操作均为;固体A的化学式为;(2)、物质 C 可以为(填序号)a.Fe b.氨 c.过量氢氧化钠稀溶液
(3)、步骤③中调节溶液 pH 的数值范围为;(4)、步骤④中溶液 E 主要含 Mg2+、Cl-等,故分离固体F时,必须对F进行洗涤。如何检验F是否洗涤干净;(5)、步骤⑥的化学方程式为。16. 三氯化六氨合钴是一种橙黄色、微溶于水的配合物,常用于合成其他含钴的配合物。利用含钴废料(含少量Fe、Al等杂质)制取的工艺流程如图所示:
已知:①浸出液中含有的金属离子主要有、、、。
②氧化性。
③、、、。溶液中金属离子物质的量浓度低于 mol/L时,可认为沉淀完全。
(1)、①的价层电子轨道表示式是;中心离子配位数为。②写出除杂过程中参与反应的化学方程式。
③调pH过程中加调节后会生成两种沉淀,同时得到的滤液中 mol/L,调节pH的范围为。
(2)、科学家发现一种由钴原子和氧原子构成的中性团簇分子的结构如图所示。顶角的原子是氧原子,棱心和体心的原子是钻原子,则它的化学式是 , 该分子中每个氧原子周围距离最近且相等的钴原子有个。 (3)、一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为(填序号),设阿伏加德罗常数的值为 , 晶胞参数为a nm,则该晶胞的密度为g•cm(用含a、的代数式表示)。
(3)、一种掺钴催化剂的晶胞如图所示,则该晶体沿z轴的投影图为(填序号),设阿伏加德罗常数的值为 , 晶胞参数为a nm,则该晶胞的密度为g•cm(用含a、的代数式表示)。 17. 乙醇俗称酒精,在生活中使用广泛。
17. 乙醇俗称酒精,在生活中使用广泛。资料1:乙醇分子有两个末端,一端是憎水(易溶于油)的—C2H5;一端是亲水(易溶于水)的—OH。
资料2:破坏蛋白质分子中形成蜷曲和螺旋的各种力,使长链舒展、松弛,可导致蛋白质变性。
资料3:水分子可以松弛蛋白质外部亲水基团之间的吸引力,而-OH不能;—C2H5可以破坏蛋白质内部憎水基团之间的吸引力。
(1)、乙醇的结构及性质①1mol乙醇分子中的极性共价键有mol。
②从结构角度解释乙醇的沸点比乙烷高的原因 。
(2)、乙醇的用途①医用酒精(75%)制备过程与制酒的过程类似,不能饮用,但可接触人体医用。

结合题中资料,下列说法正确的是(填字母)。
a.糖化、发酵的过程均含有化学变化
b.获得医用酒精常采用的分离提纯方法是蒸馏
c.浓度99%的酒精消毒杀菌效果一定大于75%的酒精
②乙醇是一种很好的溶剂,在油脂的皂化反应中,加入乙醇可加快反应速率,其原因是 。
(3)、乙醇的工业制取乙醇的工业制取方法很多,由碳的氧化物直接合成乙醇燃料已进入大规模生产。下图是由二氧化碳合成乙
醇的工艺流程。

该流程中能循环使用的物质是。
-