高中化学选择性必修1单元分层测试:第四章 化学反应与电能 A卷
试卷更新日期:2023-11-18 类型:单元试卷
一、选择题
-
1. 下列过程不需要通电就能够实现的是A、电离 B、电镀 C、电治金 D、电解饱和食盐水2. 湖北省博物馆的镇馆之宝——曾侯乙编钟由青铜所铸。下列说法错误的是( )A、青铜属于合金,硬度比纯铜大 B、青铜器露置于空气中会发生电化学腐蚀而“生锈” C、“青铜器时期”早于“铁器时期”的原因之一是铜比铁稳定 D、现代工艺采用电解精炼提纯铜,用纯铜作阳极、粗铜作阴极3. 陈述I和II均正确且具有因果关系的是( )
选项
陈述I
陈述II
A
金属钠在点燃产生
可在潜水艇中作为的来源
B
碳酸钠受热分解产生
用碳酸钠作膨松剂制作面包
C
浓硫酸与不反应
可用钢瓶运输浓硫酸
D
的金属性比强
船身焊接锌块可减缓船体腐蚀
A、A B、B C、C D、D4. 下列解释事实的方程式错误的是A、石墨比金刚石稳定:C(石墨,s)=C (金刚石,s) B、用溶液做导电实验,灯泡发光: C、配制溶液时要加盐酸: D、溶液显酸性:5. 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成下图装置,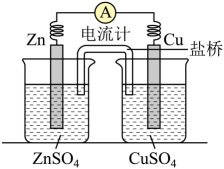
下列各项叙述中正确的是( )。
A、构成原电池,锌片作正极 B、锌片上有铜析出,铜片上没有 C、铜片附近Cu2+离子浓度减小 D、导线中电流的方向是由锌片流向铜片6. 在氯碱工业中,离子交换膜法电解饱和食盐水示意图如下,下列说法不正确的是( )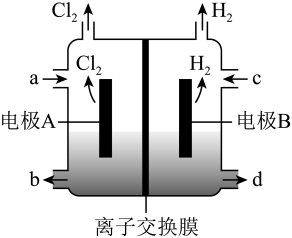 A、电极 A 为阳极,发生氧化反应 B、离子交换膜为阳离子交换膜 C、电解饱和食盐水的离子方程式为: D、NaOH 溶液从 d 处出7. 近期科技工作者开发了一套CO和甘油(C3H8O3)的共电解装置,如下图所示。下列说法正确的是( )
A、电极 A 为阳极,发生氧化反应 B、离子交换膜为阳离子交换膜 C、电解饱和食盐水的离子方程式为: D、NaOH 溶液从 d 处出7. 近期科技工作者开发了一套CO和甘油(C3H8O3)的共电解装置,如下图所示。下列说法正确的是( )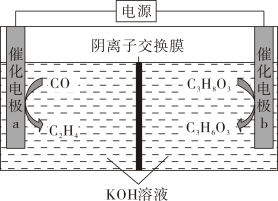 A、催化电极b连接电源的负极 B、电解过程中K+从阳极区移向阴极区 C、阴极区的电极反应为2CO+8e- +6H2O=C2H4+ 8OH- D、电解前后溶液的pH不变8. 我国科学家设计了一款高能量密度新型电池,装置如图所示。下列说法错误的是( )
A、催化电极b连接电源的负极 B、电解过程中K+从阳极区移向阴极区 C、阴极区的电极反应为2CO+8e- +6H2O=C2H4+ 8OH- D、电解前后溶液的pH不变8. 我国科学家设计了一款高能量密度新型电池,装置如图所示。下列说法错误的是( )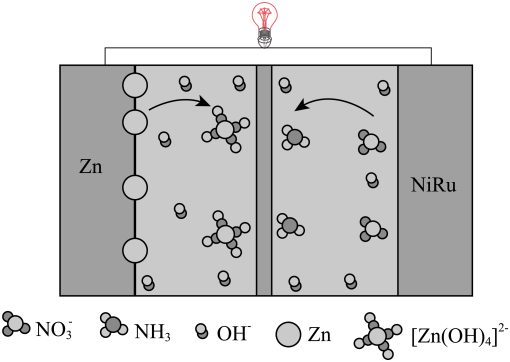 A、NiRu为正极 B、Zn电极的电极反应式为: C、工作时,电解质溶液中的OH-向Zn电极移动 D、理论上生成11.2L(标准状况)NH3时,外电路转移电子数目为8NA9. 中国科学院研究团队在碱性锌铁液流电池研究方面取得新进展,该电池的总反应为。下列叙述正确的是( )
A、NiRu为正极 B、Zn电极的电极反应式为: C、工作时,电解质溶液中的OH-向Zn电极移动 D、理论上生成11.2L(标准状况)NH3时,外电路转移电子数目为8NA9. 中国科学院研究团队在碱性锌铁液流电池研究方面取得新进展,该电池的总反应为。下列叙述正确的是( ) A、放电时,极电极反应式为 B、充电时,接电池负极,该电极发生氧化反应 C、充电时,右侧贮液器中溶液浓度减小 D、放电时,电路中转移电子时,负极区电解质溶液增重10. 我国科学家设计了一种利用废水中的将苯酚氧化为和的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基()的氧化性仅次于氟气。下列说法正确的是( )
A、放电时,极电极反应式为 B、充电时,接电池负极,该电极发生氧化反应 C、充电时,右侧贮液器中溶液浓度减小 D、放电时,电路中转移电子时,负极区电解质溶液增重10. 我国科学家设计了一种利用废水中的将苯酚氧化为和的原电池—电解池组合装置(如图),实现了发电、环保二位一体。已知:羟基自由基()的氧化性仅次于氟气。下列说法正确的是( )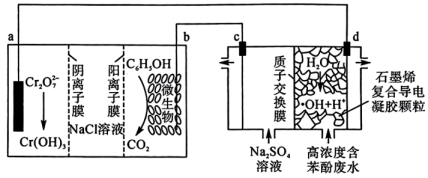 A、电子转移方向:c电极→导线→b电极 B、d电极的电极反应为 C、右侧装置中,c、d两电极产生气体的体积比(相同条件下)为 D、若a电极上有参与反应,理论上溶液中有通过阴离子膜进入a电极区溶液
A、电子转移方向:c电极→导线→b电极 B、d电极的电极反应为 C、右侧装置中,c、d两电极产生气体的体积比(相同条件下)为 D、若a电极上有参与反应,理论上溶液中有通过阴离子膜进入a电极区溶液二、多选题
-
11. 电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法正确的是 ( )
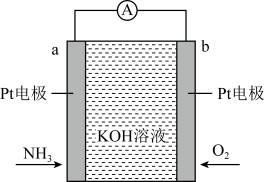 A、溶液中OH-向电极b移动 B、电极b上发生氧化反应 C、负极的电极反应为2NH3-6e -+6OH- =N2+6H2O D、理论上反应消耗的NH3与O2的物质的量之比为4:312. 利用热再生氨电池可实现电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是
A、溶液中OH-向电极b移动 B、电极b上发生氧化反应 C、负极的电极反应为2NH3-6e -+6OH- =N2+6H2O D、理论上反应消耗的NH3与O2的物质的量之比为4:312. 利用热再生氨电池可实现电镀废液的浓缩再生。电池装置如图所示,甲、乙两室均预加相同的电镀废液,向甲室加入足量氨水后电池开始工作。下列说法正确的是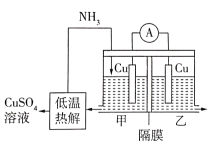 A、甲室电极为正极 B、隔膜为阳离子膜 C、电池总反应为: D、扩散到乙室将对电池电动势产生影响13. 电芬顿工艺被认为是一种很有应用前景的高级氧化技术,可用于降解去除废水中的持久性有机污染物,其工作原理如图a所示,工作时,、电极产生量与电流强度关系如图b所示:
A、甲室电极为正极 B、隔膜为阳离子膜 C、电池总反应为: D、扩散到乙室将对电池电动势产生影响13. 电芬顿工艺被认为是一种很有应用前景的高级氧化技术,可用于降解去除废水中的持久性有机污染物,其工作原理如图a所示,工作时,、电极产生量与电流强度关系如图b所示: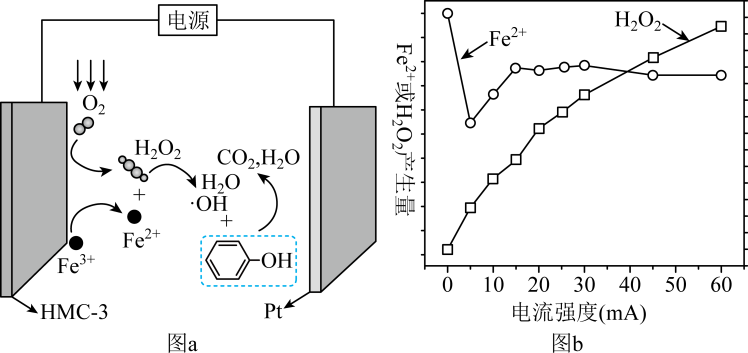
下列说法错误的是( )
A、电流流动方向:电极→电解质→电极 B、是该电芬顿工艺的催化剂 C、根据图b可判断合适的电流强度范围为55-60mA D、若处理苯酚,理论上消耗标准状况下三、非选择题
-
14. 电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
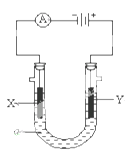 (1)、若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
(1)、若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则① Y电极上的电极反应式为
② 电解池中X极上的电极反应式为。在X 极附近观察到的现象是。
(2)、如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则① X电极的材料是 , 电极反应式是。
② Y电极的材料是 , 电极反应式是。(说明:杂质发生的电极反应不必写出)
15. 如图所示为原电池装置示意图。回答下列问题: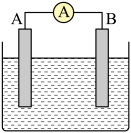 (1)、将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是____(填字母)。A、铝片、铜片 B、铜片、铝片 C、铝片、铝片 D、铜片、铜片(2)、若A为Pb,B为PbO2 , 电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出A电极反应式:;该电池在工作时,B电极的质量将(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1molH2SO4 , 则转移电子的数目为。(3)、若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2 , 该电池即为甲烷燃料电池,写出A电极反应式:;该电池在工作过程中,正极附近溶液的pH值(填“增大”、“减小”或“不变”)若该电池工作时转移了0.4mol电子,则生成水的质量为。16. 请按要求回答下列问题:(1)、甲烷的标准燃烧热为kJ⋅mol , 则表示甲烷燃烧热的热化学方程式:。(2)、 kJ/mol
(1)、将铝片和铜片用导线相连,一组插入浓硝酸中,一组插入烧碱溶液中,分别形成了原电池,在这两个原电池中,作负极的分别是____(填字母)。A、铝片、铜片 B、铜片、铝片 C、铝片、铝片 D、铜片、铜片(2)、若A为Pb,B为PbO2 , 电解质为H2SO4溶液,工作时的总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。写出A电极反应式:;该电池在工作时,B电极的质量将(填“增加”“减小”或“不变”)。若该电池反应消耗了0.1molH2SO4 , 则转移电子的数目为。(3)、若A、B均为铂片,电解质为H2SO4溶液,分别从A、B两极通入CH4和O2 , 该电池即为甲烷燃料电池,写出A电极反应式:;该电池在工作过程中,正极附近溶液的pH值(填“增大”、“减小”或“不变”)若该电池工作时转移了0.4mol电子,则生成水的质量为。16. 请按要求回答下列问题:(1)、甲烷的标准燃烧热为kJ⋅mol , 则表示甲烷燃烧热的热化学方程式:。(2)、 kJ/molkJ/mol
写出与反应生成和水蒸气的热化学反应方程式。
(3)、铁片镀铜实验中(装置如图所示),b接电源的极,铁片上发生的电极反应式为。电镀过程中(填“变大”、“变小”或“基本保持不变”)。 (4)、新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的极;该发生器阴极电极反应式为。(5)、如图装置利用与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图。(供选择的实验用品为:石墨棒、铜棒、溶液、溶液)
(4)、新冠疫情期间,某同学设计了一个电解装置如图,用于制备“84”消毒液的有效成分,则c为电源的极;该发生器阴极电极反应式为。(5)、如图装置利用与Cu发生的反应,设计一个可正常工作的电池,补全该电化学装置示意图。(供选择的实验用品为:石墨棒、铜棒、溶液、溶液) 17. 将裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,滴入少量酚酞,回答下列问题。
17. 将裹有锌片的铁钉放入溶有琼脂的饱和NaCl溶液中,滴入少量酚酞,回答下列问题。 (1)、一段时间后a处可能出现的现象是 , 请结合化学用语解释原因。(2)、某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是(填序号)。
(1)、一段时间后a处可能出现的现象是 , 请结合化学用语解释原因。(2)、某同学为验证选择的铁钉未被腐蚀,取少量溶液于试管,分别进行如表实验,能证明铁钉未被腐蚀的实验是(填序号)。序号
①
②
③
④
滴入试剂
AgNO3溶液
淀粉KI溶液
KSCN溶液
K3[Fe(CN)6]溶液
实验现象
产生沉淀
无蓝色出现
无红色出现
无蓝色沉淀
(3)、某同学欲将铁棒镀铜设计电镀铜实验,请依据提供实验用品完成如图所示电镀装置 , 并写出电池工作一段时间后的现象。供选择的实验用品:FeCl2溶液,CuSO4溶液,铜棒,锌棒,铁棒

实验现象:。
18. 铁及其化合物在生产和生活中具有广泛的用途。请回答下列问题。(1)、铁制品暴露在潮湿空气中容易发生腐蚀,通过图甲所示装置可验证铁钉是否发生电化学腐蚀,正极反应式是。 (2)、利用图乙装置可模拟工业生产高铁酸盐,阳极反应为 , 阴极区的溶液(填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为 , 充电时阳极反应为 , 放电时每转移电子,正极有被还原。19. 吸入氧气、排出二氧化碳,这看似再简单不过的新陈代谢,在遥远的太空中却并不容易,因为在航天服、航天器、空间站等密闭系统中,CO2浓度会高得多,而超过一定浓度会导致呼吸急促、头晕头痛、昏迷甚至死亡,因此必须通过一定方法将CO2清除。(1)、I.非再生式氢氧化锂(LiOH)除碳技术
(2)、利用图乙装置可模拟工业生产高铁酸盐,阳极反应为 , 阴极区的溶液(填“增大”“减小”或“不变”)。利用高铁酸盐可制作新型可充电电池,该电池的总反应为 , 充电时阳极反应为 , 放电时每转移电子,正极有被还原。19. 吸入氧气、排出二氧化碳,这看似再简单不过的新陈代谢,在遥远的太空中却并不容易,因为在航天服、航天器、空间站等密闭系统中,CO2浓度会高得多,而超过一定浓度会导致呼吸急促、头晕头痛、昏迷甚至死亡,因此必须通过一定方法将CO2清除。(1)、I.非再生式氢氧化锂(LiOH)除碳技术我国“飞天”舱外航天服采用非再生式氢氧化锂(LiOH)吸附CO2生成碳酸锂,该技术设备操作简单,功能可靠,适用于短期出舱任务。吸附发生的化学方程式为。
(2)、II.再生式快速循环胺技术以固态胺作为吸附剂,吸附CO2与水蒸气。当固态胺吸附饱和后,将其暴露于真空中,破坏碳酸氢盐的化学键,释放出CO2 , 从而完成吸附剂的再生。该技术大大提升了舱外航天服的续航时间。固态胺的吸附是变化(填“物理”或“化学”)
(3)、III.萨巴蒂尔(Sabatier)除碳生氧技术利用萨巴蒂尔(Sabatier)反应清除二氧化碳并再生氧气的大体流程如下图所示。
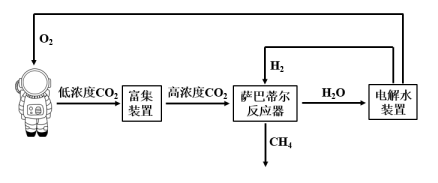
下列说法错误的是____。(双选)
A、CO2的最终产物为CH4和O2 B、电解水装置中,反应物的能量高于生成物的能量 C、萨巴蒂尔反应器中反应的氧化剂与还原剂物质的量之比为1∶4 D、物质转化中O、H原子的利用率均为100%(4)、CO2富集的原电池模拟装置如图: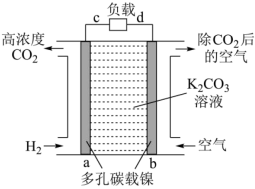
b极为极(填“正”或“负”,),a电极上发生的电极反应。
(5)、上述电极材料采用多孔碳载镍,“多孔”的优点是。(6)、该装置若消耗2 mol H2 , 则理论上在b极除去CO2的体积为L(标况下)。20. 铅酸蓄电池(如图)的电压稳定、使用方便、安全可靠、价格低廉而使用广泛。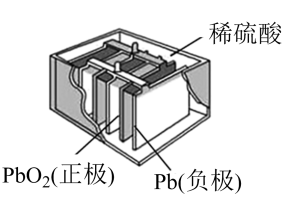 (1)、I.写出电池使用过程中的两个电极反应方程式:
(1)、I.写出电池使用过程中的两个电极反应方程式:负极;正极。
(2)、II.使用后的废旧铅酸蓄电池需要回收,废旧电池的铅膏中主要含有、、PbO和Pb,还有少量、以及Fe、Al的盐或氧化物等,通过如图流程回收铅。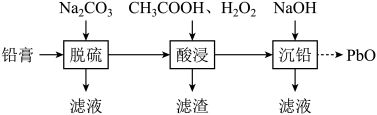
一些难溶电解质的溶度积常数如下表:
难溶电解质
一定条件下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物
开始沉淀的pH
2.3
6.8
3.5
7.2
完全沉淀的pH
3.2
8.3
4.6
9.1
回答下列问题:
在“脱硫”中转化反应的离子方程式为;饱和溶液中。
(3)、在“脱硫”中,加入不能使铅膏中完全转化,原因是。(4)、在“酸浸”中,除加入醋酸(),还要加入。①能被氧化的离子是;
②促进了金属Pb在醋酸中转化为 , 其化学方程式为。
③也能使转化为 , 的作用是。
(5)、“酸浸”后溶液的pH应控制在(填范围),滤渣的主要成分是(填化学式)。21. 氯碱工业是化工产业的重要基础,其装置示意图如图。生产过程中产生的氯酸盐副产物需要处理。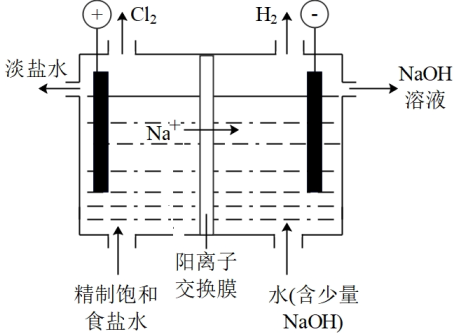
已知:pH升高时,易歧化为和。
(1)、电解饱和食盐水的离子方程式为。(2)、下列关于产生的说法中,合理的是(填序号)。a.主要在阴极室产生
b.在电极上放电,可能产生
c.阳离子交换膜破损导致向阳极室迁移,可能产生
(3)、测定副产物含量的方法如下图。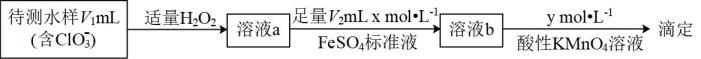
①加入的目的是消耗水样中残留的和。若测定中未加入 , 则测得的水样中的浓度将(填“偏大”“偏小”或“不受影响”)。
②滴定至终点时消耗酸性溶液,水样中的计算式为。
(4)、可用盐酸处理淡盐水中的并回收。①反应的离子方程式为。
②处理时,盐酸可能的作用是:
i.提高 , 使氧化性提高或还原性提高;
ii.提高 , 。
③用如图装置验证i,请补全操作和现象:闭合K,至指针读数稳定后,。
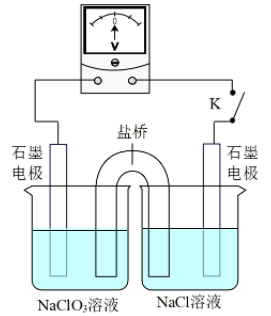 22. 铝的阳极氧化是一种重要的表面处理技术,其原理是用电化学方法处理铝件表面,优化氧化膜结构,增强铝件的抗腐蚀性,同时便于表面着色。取铝片模拟该实验,并测定氧化膜厚度,操作步骤如下:(1)、铝片预处理
22. 铝的阳极氧化是一种重要的表面处理技术,其原理是用电化学方法处理铝件表面,优化氧化膜结构,增强铝件的抗腐蚀性,同时便于表面着色。取铝片模拟该实验,并测定氧化膜厚度,操作步骤如下:(1)、铝片预处理铝片表面除去油垢后,用2mol/LNaOH溶液在60~70℃下洗涤,除去铝表面薄氧化膜,离子方程式为:;再用10%(质量分数)的HNO3溶液对铝片表面进行化学抛光。若取一定体积68%(质量分数)的浓硝酸配制该化学抛光液,需要用到的玻璃仪器有、、玻璃棒和胶头滴管。
(2)、电解氧化取预处理过的铝片和铅做电极,控制电流恒定为0.06A,用直流电源在5~6mol/L硫酸中电解。其中铝片接电源极,产生氧化膜的电极反应式为氧化膜的生长过程可大致分为A、B、C三个阶段(如图所示),C阶段多孔层产生孔隙的离子反应方程式为 , A阶段电压逐渐增大的原因是。
 (3)、氧化膜质量检验
(3)、氧化膜质量检验取出阳极氧化并封闭处理过的铝片,洗净、干燥,在铝片表面滴一滴氧化膜质量检查液(3gK2Cr2O7+75mL水+25mL浓硫酸),用秒表测定表面颜色变为绿色(产生Cr3+)所需时间,可判断氧化膜的耐腐蚀性。写出该变色反应的离子方程式:。
(4)、氧化膜厚度测定①取氧化完毕的铝片,测得表面积为4.0cm2 , 洗净吹干,称得质量为0.7654g;
②将铝片浸于60℃的溶膜液中煮沸10分钟进行溶膜处理;
③取出铝片,洗净吹干,称得除膜后铝片质量为0.7442g。
已知氧化膜的密度为2.7g/cm3 , 可以计算得出氧化膜厚度为μm(1μm=1×10-4cm)。