高中化学选择性必修1单元分层测试:第三章 水溶液中的离子反应与平衡 B卷
试卷更新日期:2023-11-18 类型:单元试卷
一、选择题
-
1. 常温时将的某酸与的某碱等体积混合后,溶液的。下列说法错误的是A、碱可以是强碱 B、两溶液恰好完全反应 C、盐的水溶液一定显碱性 D、的电离方程式:2. 下列实验或装置能达到实验目的的是
A
B
C
D
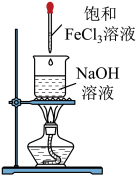
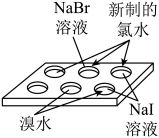

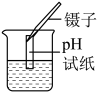
制备氢氧化铁胶体
比较卤素单质氧化性强弱
洗气除去SO2中的CO2
测浓硫酸的pH
A、A B、B C、C D、D3. 草酸钙是常见的难溶物.将过量草酸钙粉末置于水中达到溶解平衡:CaC2O4(s)Ca2+(ag)+(a)[已知Ksp(CaC2O4)=2.3×10-9 , Ka(H3COOH)=1.75×10-5 , H2C2O4的电离常数Ka1=5.6×10-2 , Ka2=1.5×10-4 , 下列有关说法不正确的是( )A、上层清液中含碳微粒最主要以形式存在 B、上层清液中存在:c(Ca2+)=c()+c()+c(H2C2O4) C、H2C2O4加入CaCl2溶液时, 加入适量醋酸钠粉末,有利于生成CaC2O4沉淀 D、向上层清液中通入HCl至pH=1,则 2c(Ca2+)-2c()-c()-c(OH-)=0.1 mol/L4. 某温度下, , 。现有体积均为 V0的 pH=a 的两种酸溶液,加水稀释至体积为 V,两种溶液的 pH 随 lg 的变化如图所示。下列叙述正确的是( )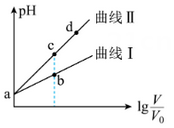 A、曲线Ⅱ代表HB B、水的电离程度:b>c C、由c点到d点,溶液中 增大(X 代表A或B) D、分别取b点、c点溶液与等浓度的NaOH溶液中和,恰好中和时消耗NaOH溶液的体积:b>c5. 常温下,向20 mL 0.1mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述错误的是( )
A、曲线Ⅱ代表HB B、水的电离程度:b>c C、由c点到d点,溶液中 增大(X 代表A或B) D、分别取b点、c点溶液与等浓度的NaOH溶液中和,恰好中和时消耗NaOH溶液的体积:b>c5. 常温下,向20 mL 0.1mol·L-1的盐酸中逐滴加入0.1 mol·L-1的氨水,溶液pH的变化与加入氨水的体积关系如图所示。下列叙述错误的是( )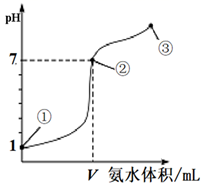 A、V>20 mL B、①、②、③点水的电离程度大小为:②>③>① C、在点②所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH ) D、在点②、③之间可能存在:c(NH )>c(Cl-)=c(OH-)>c(H+)6. 常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 HA溶液和HB溶液,所得滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是( )
A、V>20 mL B、①、②、③点水的电离程度大小为:②>③>① C、在点②所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH ) D、在点②、③之间可能存在:c(NH )>c(Cl-)=c(OH-)>c(H+)6. 常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL浓度均为0.10 mol·L-1 HA溶液和HB溶液,所得滴定曲线如图所示(其中HA的滴定曲线部分未画出)。下列说法错误的是( )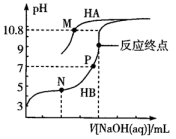
已知:M点溶液中c(A-)=c(HA)
A、=105.8 B、P点溶液中溶质为NaB和HB,由水电离出的c(H+)=1.0×10-7 mol·L-1 C、M点溶液中,2c(Na+)>c(HA)+c(A-) D、等体积等浓度的HB溶液和NaA溶液混合后的溶液中:c(OH-)<c(H+)7. 用0.1mol/L的NaOH溶液滴定20mL0.1mol/L的CH3COOH溶液时,溶液的温度(I)、pH(II)随NaOH体积的变化如下图(图中虚线为校正至25℃时的pH曲线),V1时溶液中 =1。
下列说法正确的是
A、x点溶液中,CH3COOH电离程度小于CH3COONa的水解程度 B、y点溶液中,c(CH3COO-)=c(Na+)>c(H+)= c(OH-) C、w点溶液的碱性强于z点溶液的碱性 D、25℃时,CH3COOH的电离常数Ka=1×10-a8. 难溶盐可溶于盐酸,常温下,用气体调节浊液的 , 测得体系中或与的关系如图所示.下列说法不正确的是( )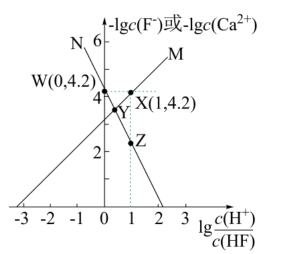 A、曲线代表随的变化趋势 B、点溶液中存在 C、难溶盐的溶度积常数 D、其他条件不变的情况下,无论增大浓度或减小浓度,的均不变9. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法不正确的是
A、曲线代表随的变化趋势 B、点溶液中存在 C、难溶盐的溶度积常数 D、其他条件不变的情况下,无论增大浓度或减小浓度,的均不变9. 常温下,向10mL0.10mol/LCuCl2溶液中滴加0.10mol/LNa2S溶液,滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法不正确的是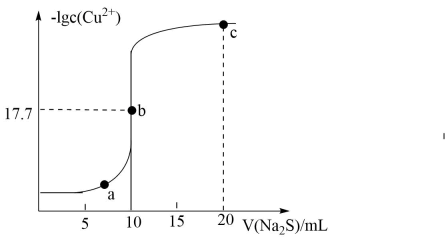 A、Ksp(CuS)=10-35.4 B、a点溶液中:c(S2-)•c(Cu2+)=Ksp(CuS) C、c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+) D、a、b、c三点溶液中,水的电离程度最大的是b点
A、Ksp(CuS)=10-35.4 B、a点溶液中:c(S2-)•c(Cu2+)=Ksp(CuS) C、c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+) D、a、b、c三点溶液中,水的电离程度最大的是b点二、多选题
-
10. 部分弱酸的电离平衡常数如表所示:
弱酸
电离常数/( )(25℃)
下列说法错误的是( )
A、 B、 C、中和等体积、等pH的 和 溶液,前者消耗 的量小于后者 D、等体积、等浓度的 和 溶液中,前者所含离子总数小于后者11. 25℃时,向1L某缓冲溶液(含0.1mol·L-1CH3COOH、0.08mol·L-1CH3COONa)和1L0.1mol·L-1CH3COOH溶液中加入NaOH(s)或通入HCl(g),两种溶液的pH变化如图所示(不考虑溶液体积变化)。已知缓冲溶液pH=pKa-lg , 下列说法正确的是( ) A、曲线①对应的溶液是缓冲溶液 B、25℃时醋酸的电离常数的数量级为10-5 C、a点溶液中离子浓度的大小关系为c(CH3COO-)=c(CH3COOH)>c(H+)>c(OH-) D、b点溶液存在:4c(CH3COOH)+9c(H+)=9c(Cl-)+9c(OH-)+5c(CH3COO-)12. 已知:常温下, 。某温度下,饱和溶液中 与 、 的关系如图所示。
A、曲线①对应的溶液是缓冲溶液 B、25℃时醋酸的电离常数的数量级为10-5 C、a点溶液中离子浓度的大小关系为c(CH3COO-)=c(CH3COOH)>c(H+)>c(OH-) D、b点溶液存在:4c(CH3COOH)+9c(H+)=9c(Cl-)+9c(OH-)+5c(CH3COO-)12. 已知:常温下, 。某温度下,饱和溶液中 与 、 的关系如图所示。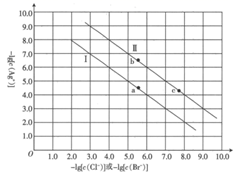
下列说法正确的是( )
A、曲线Ⅱ代表 的沉淀溶解平衡曲线 B、常温下, 的 C、常温下,当 时,饱和溶液中 D、加入 固体可使溶液由 点沿直线变为 点13. 常温下,用 盐酸滴定 某弱碱 溶液,所得溶液 、 和 的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述错误的是( ) A、曲线①代表 ,曲线②代表 B、b点溶液中存在 C、 的电离平衡常数为 D、a、b、c三点的溶液,水的电离程度14. 向一定体积的的草酸溶液中滴加的NaOH溶液,溶液中、、的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )
A、曲线①代表 ,曲线②代表 B、b点溶液中存在 C、 的电离平衡常数为 D、a、b、c三点的溶液,水的电离程度14. 向一定体积的的草酸溶液中滴加的NaOH溶液,溶液中、、的物质的量分数(δ)随pH变化的关系如图所示。下列说法错误的是( )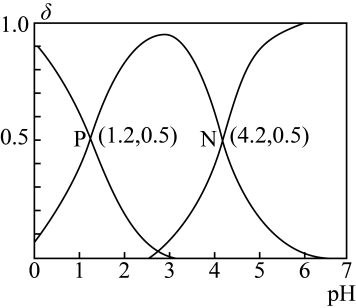 A、水的电离程度:N>M>P B、的水解平衡常数 C、N点: D、向的溶液中持续滴加NaOH溶液,水的电离程度持续变大
A、水的电离程度:N>M>P B、的水解平衡常数 C、N点: D、向的溶液中持续滴加NaOH溶液,水的电离程度持续变大三、非选择题
-
15. 硫酸的消耗量是衡量一个国家化学工业发展水平的标志。以黄铁矿(主要成分为)为原料生产和。
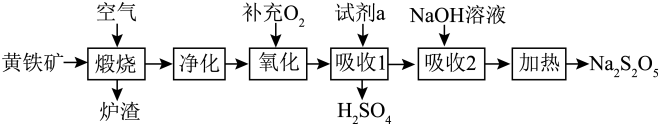
请回答下列问题:
(1)、中铁元素的化合价为;试剂a为。(2)、若要增大煅烧过程的反应速率,应采取的措施是(写两条即可)。(3)、煅烧时主要反应的化学方程式为。(4)、“氧化”时,反应的化学方程式为。(5)、可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中的含量。请配平其反应的化学方程式:若要检验是否变质生成了 , 所用的试剂是。
(6)、在测定某葡萄酒中的含量时,取葡萄酒样品,消耗碘标准液。样品中的含量为。16. 下列物质中:① ② ③ ④盐酸 ⑤ ⑥(1)、属于弱电解质的是(填序号,下同),属于强电解质且其水溶液呈碱性的是。(2)、在氨水中存在电离平衡:。将上述六种物质分别配成的溶液,向稀氨水中分别滴加少量六种溶液,能使氨水的电离平衡逆向移动且增大的是(填序号),此时(填“增大”“减小”或“不变”,下同),。(3)、等体积、pH相同的盐酸和醋酸分别与的溶液恰好完全反应,消耗体积较大的是(填“”或“”),反应后溶液pH较大的是(填“”或“”)。(4)、已知次氯酸的电离平衡常数为 , 向的溶液中滴加少量硫酸,再加水稀释至 , 此时测得 , 则溶液中。(5)、已知亚硫酸的电离平衡常数为;碳酸的电离平衡常数为 , , 足量的溶液和溶液发生反应的主要离子方程式为。17. 草酸(H2C2O4)是一种二元有机酸,广泛分布于植物、动物和真菌体中,并在生命体内发挥重要的功能。已知:常温下,部分酸的电离平衡常数如表所示。H2C2O4
H2CO3
HNO2
Ka1=5.6×10-2
Ka2=1.5×10-4
Ka1=4.5×10-7
Ka2=4.7×10-11
Ka=5.6×10-4
回答下列问题:
(1)、 H2C2O4的第一步电离方程式为。(2)、自选化学试剂,设计实验方案证明草酸的酸性比碳酸的强:。(3)、常温下,0.1 mol∙L-1 H2C2O4溶液的pH(填“>”、“<”或“=”,下同)0.1 mol∙L-1 HNO2溶液的,0.1 mol∙L-1 Na2C2O4溶液的pH0.1 mol∙L-1 Na2CO3溶液的。(4)、测定某H2C2O4溶液的浓度:取25.00 mL H2C2O4溶液于锥形瓶中,用0.1000 mol∙L-1酸性KMnO4 溶液滴定(滴定时发生的反应存在关系式:),重复上述操作3次后,得到如表所示的数据:滴定次数
滴定前酸性KMnO4溶液的读数/mL
滴定后酸性KMnO4溶液的读数/mL
1
0.10
20.30
2
0.50
20.80
3
0.00
22.00
4
1.10
21.20
①KMnO4溶液应盛装在(填“酸式”或“碱式”)滴定管中,原因为。
②达到滴定终点时的标志为。
③c(H2C2O4)= mol∙L-1。
18. 元素铬在溶液中主要以(蓝紫色)、(绿色)、(橙红色)、(黄色)等形式存在,为难溶于水的灰蓝色固体,回答下列问题:(1)、在溶液中加入过量溶液,溶液由蓝紫色变为绿色,写出相应的离子方程式:。(2)、和在溶液中可相互转化:(反应A)。室温下,初始浓度为的溶液中随的变化如图所示(整个过程中溶液体积保持不变)。
①由图可知,溶液减小,的平衡转化率(填“增大”“减小”或“不变”)。根据A点数据,计算出反应A的平衡常数为。
②升高温度,溶液中的平衡转化率减小;则反应A的(填“>”或“<”)0。
③向酸性溶液中加水,有同学认为溶液中所有离子的浓度都减小,你是否同意并说明理由。
④向酸性溶液(橙色)中加入少量氢氧化钠固体(忽略溶液体积的变化),振荡后立即观察到溶液变为黄色,该结果不足以证明浓度的减小使得反应A的平衡逆向移动,理由是:。
(3)、在化学分析中采用为指示剂,以标准溶液滴定溶液中的 , 利用与生成砖红色沉淀,指示到达滴定终点。当溶液中恰好沉淀完全(浓度等于)时,溶液中为。(已知的分别为和)(4)、向酸性溶液中加入乙醇(乙醇被氧化为乙酸),溶液变为蓝紫色,反应的离子方程式为。19. 从废钼催化剂(主要成分为MoS2 , 含少量SiO2、CuFeS2、As2O3)中回收钼酸铵晶体的工艺流程如图所示: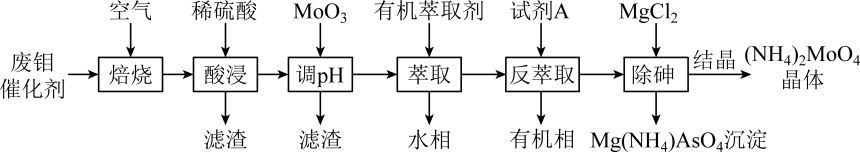
注:酸浸后钼元素以MoO形式存在。
回答下列问题:
(1)、高温焙烧时,废钼催化剂中的金属元素转化为金属氧化物,则“焙烧”过程中MoS2发生反应的化学方程式为。(2)、“调pH”中,加入MoO3调节溶液的pH略大于时,可除去目标杂质离子。已知:溶液中某离子浓度≤10-5mol•L-1时,认为沉淀完全;常温下Ksp[Fe(OH)3]=10-38.5 , Ksp[Cu(OH)2]=10-19.6。
(3)、若反萃取剂A是氨水,则反萃取过程中MoO发生的离子方程式为。(4)、已知“除砷”过程中,pH对As去除率的影响如图所示。当pH>10后,随着pH的增大,去除率呈下降趋势的原因可能是。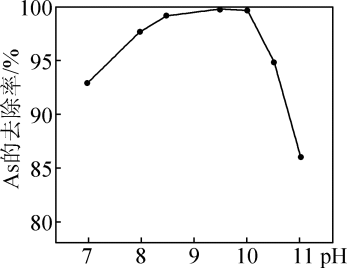 (5)、钼酸铵溶液可用于测定磷肥含磷量,步骤如下:准确称量磷肥2.84g,用硫酸和高氯酸在高温下使之分解,磷转化为磷酸。过滤、洗涤、弃去残渣。以硫酸—硝酸为介质,加入过量钼酸铵溶液生成钼磷酸铵沉淀(NH4)3H4PMo12O42•H2O,将过滤、洗涤后的沉淀溶于50.00mL6.00mol•L-1NaOH溶液后,定容至250mL。取25mL溶液,以酚酞为指示剂,用0.40mol•L-1盐酸溶液滴定其中过量的NaOH,消耗盐酸23.00mL。计算磷肥中磷的百分含量(以P2O5计)(写出计算过程)。
(5)、钼酸铵溶液可用于测定磷肥含磷量,步骤如下:准确称量磷肥2.84g,用硫酸和高氯酸在高温下使之分解,磷转化为磷酸。过滤、洗涤、弃去残渣。以硫酸—硝酸为介质,加入过量钼酸铵溶液生成钼磷酸铵沉淀(NH4)3H4PMo12O42•H2O,将过滤、洗涤后的沉淀溶于50.00mL6.00mol•L-1NaOH溶液后,定容至250mL。取25mL溶液,以酚酞为指示剂,用0.40mol•L-1盐酸溶液滴定其中过量的NaOH,消耗盐酸23.00mL。计算磷肥中磷的百分含量(以P2O5计)(写出计算过程)。已知:(NH4)3H4PMo12O42•H2O+26NaOH=12Na2MoO4+Na2HPO4+3NH3↑+17H2O。
20. 铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:Zn2++2Fe2++3C2O+6H2OZnFe2(C2O4)3·6H2O↓
ZnFe2(C2O4)3·6H2O……
某兴趣小组按下列流程制备ZnFe2O4。
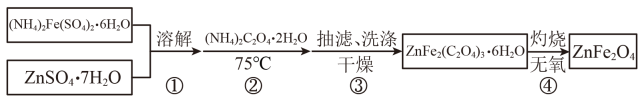
请回答:
(1)、下列说法正确的是____。A、步骤①,将2种药品加入反应器中加水充分溶解混合,并用75℃水浴预热 B、步骤②,将稍过量草酸铵晶体快速加入并不断搅拌 C、步骤③,母液中的溶质主要是(NH4)2SO4和H2SO4 D、应严格控制硫酸锌与摩尔盐的物质的量之比为1:2以提高产品纯度(2)、实现步骤④必须用到的两种仪器是。a.烧杯 b.坩埚 c.蒸发皿 d.马弗炉 e.表面皿
完成灼烧得到产品的化学方程式是。
(3)、下列操作或描述不正确的是____。A、为了防止酸性溶液腐蚀滤纸,抽滤时需用玻璃砂漏斗代替布氏漏斗 B、抽滤将完毕时用平底的玻璃塞将沉淀向下挤压,可加快得到干燥产品 C、让生成的沉淀与母液一起放置一段时间可以获得颗粒相对均一且较纯的晶体 D、ZnFe2(C2O4)3·6H2O已洗涤干净的依据是取最后一次洗涤滤液呈无色(4)、某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息利用实验可提供的试剂制取纯净的ZnSO4·7H2O。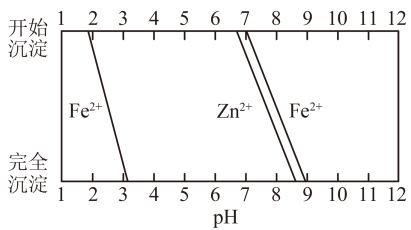
从以下选择合适步骤并填空;d→→→→i→→→e;
a.加入新制氯水;
b.锌皮完全溶于稍过量的3 mol·L-1稀硫酸;
c.加入30%H2O2;
d.锌皮用热碱洗涤干净;
e.过滤、洗涤、干燥;
f.过滤得ZnSO4溶液;
g.加入纯ZnO粉末;
h.蒸发浓缩,冷却结晶;
i.加热到60℃左右,并不断搅拌;
其中步骤i中加热的主要目的是:。
(5)、测定ZnFe2O4产品的纯度:称取0.2500 g样品,加入稀盐酸并加热溶解,冷却后以铬黑T为指示剂,用0.0500 mol·L-1乙二胺四醋酸钠溶液滴定,终点时溶液由紫红色转变为纯蓝色,消耗乙二胺四醋酸钠溶液25.00 mL。(每1 mL0.0500 mol·L-1乙二胺四醋酸钠溶液相当于9.64 mg的ZnFe2O4),则该产品的纯度。