高中化学选择性必修1单元分层测试:第二章 化学反应速率与化学平衡 A卷
试卷更新日期:2023-11-17 类型:单元试卷
一、选择题
-
1. 反应A(s)+B(g) 2C(g)+3D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.6 mol,则反应的速率可表示为( )。A、v(A)=0.04 mol·L-1·s-1 B、v(B)=2.4 mol·L-1·min-1 C、v(C)=0.02 mol·L-1·s-1 D、v(D)=0.12 mol·L-1·min-12. 下列不属于自发进行的变化是( )A、红墨水加到清水中使整杯水变红 B、冰在室温下融化成水 C、向氢氧化钠溶液中滴加盐酸 D、常温常压下,石墨转化为金刚石3. 工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:①;②。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是( )A、过量 B、与铁矿石接触不充分 C、炼铁高炉的高度不够 D、上述反应有一定的限度4. 关于有效碰撞理论,下列说法不正确的是( )。A、相同条件下活化分子百分数越多,有效碰撞次数越多,反应速率越快 B、一般情况下,正、逆反应的活化能越小反应速率越快 C、增大压强提高活化分子百分数,反应速率增大 D、催化剂降低反应所需活化能,提高活化分子百分数反应速率增大5. 在只有气体参加的反应中,改变下列条件,能使反应物中单位体积内活化分子数和活化分子百分数同时增大的是( )A、增大反应物的浓度 B、增大压强 C、升高温度 D、移去生成物6. 已知可逆反应A2(g)+B2(g) 2AB(g)的能量变化如图所示,则下列叙述中不正确的是( )。
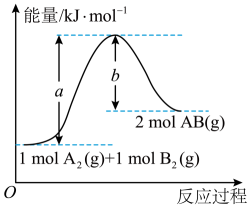 A、该反应的活化能为a kJ·mol-1 B、该反应的逆反应的活化能为b kJ·mol-1 C、该反应的ΔH=+(a-b) kJ·mol-1 D、使用催化剂,a的数值减小,ΔH也减小7. 在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)=2HI(g)已经达到平衡的标志是( )。A、HI的生成速率与HI的分解速率相等 B、HI的生成速率与H2的生成速率之比是2∶1 C、单位时间内一个H−H键断裂的同时有两个H−I键断裂 D、单位时间里断裂2n mol HI的同时生成nmol I28. 以Fe3O4为原料炼铁,主要发生如下反应:
A、该反应的活化能为a kJ·mol-1 B、该反应的逆反应的活化能为b kJ·mol-1 C、该反应的ΔH=+(a-b) kJ·mol-1 D、使用催化剂,a的数值减小,ΔH也减小7. 在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)=2HI(g)已经达到平衡的标志是( )。A、HI的生成速率与HI的分解速率相等 B、HI的生成速率与H2的生成速率之比是2∶1 C、单位时间内一个H−H键断裂的同时有两个H−I键断裂 D、单位时间里断裂2n mol HI的同时生成nmol I28. 以Fe3O4为原料炼铁,主要发生如下反应:反应Ⅰ:Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) ΔH1>0
反应Ⅱ:Fe3O4(s)+4CO(g) = 3Fe(s)+4CO2(g) ΔH2
将一定体积CO通入装有Fe3O4粉末的反应器,其它条件不变,反应达平衡,测得CO
的体积分数随温度的变化关系如图所示。下列说法正确的是
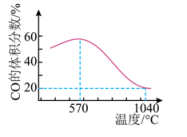 ( )A、ΔH2>0 B、反应温度较低时,Fe3O4主要还原产物为Fe C、1040℃时,反应I的化学平衡常数K=0.25 D、在恒温、恒容条件下,当容器压强保持不变,反应Ⅰ、Ⅱ均达到平衡状态9. 在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应: , 保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:
( )A、ΔH2>0 B、反应温度较低时,Fe3O4主要还原产物为Fe C、1040℃时,反应I的化学平衡常数K=0.25 D、在恒温、恒容条件下,当容器压强保持不变,反应Ⅰ、Ⅱ均达到平衡状态9. 在某容积可变的密闭容器中加入等量的A、B混合气体共4mol,发生反应: , 保持一定温度,改变压强分别达到平衡时,测得不同压强下气体A的物质的量浓度如表:压强p/Pa
0.08
0.20
0.40
0.80
下列说法一定正确的是
A、保持一定温度,增大压强,平衡一定正向移动 B、当压强为时,此反应的平衡常数表达式: C、反应平衡后若增大压强,v(正)、v(逆)速率一定增大 D、若再向体系中加入一定量的B,当重新达到平衡时,体系中A、B、C总物质的量不变二、多选题
-
10. 某小组利用硫代硫酸钠溶液与稀硫酸反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,探究反应条件对速率的影响,下列有关说法正确的是( )
选项
反应温度/℃
Na2S2O3溶液
稀H2SO4
H2O
V/mL
c/(mol/L)
V/mL
c/(mol/L)
V/mL
①
25
10
0.1
10
0.1
0
②
25
5
0.1
10
0.1
X
③
50
10
0.1
5
0.2
5
A、可通过产生浑浊的时间判断反应的快慢 B、①③两组实验可探究硫酸浓度对反应速率的影响 C、①②两组实验可探究Na2S2O3浓度对反应速率的影响,则x=5 D、实验结束后,有少量S附着在试管上,可以用水冲洗干净11. 向绝热恒容密闭容器中通入SO2和NO2 , 一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,在此过程中正反应速率随时间变化的曲线如图所示。由图得出的结论正确的是 A、若△t1=△t2 , 则 SO2的消耗量a-b段大于b-c段 B、SO2的浓度: a点小于b点 C、反应物的总能量高于生成物的总能量 D、当容器内压强保持不变时,无法判断该反应达到平衡状态12. 合成氨反应为:。图1表示在2L的密闭容器中反应时的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始时氢气的物质的量对此反应平衡的影响。下列说法正确的是( )
A、若△t1=△t2 , 则 SO2的消耗量a-b段大于b-c段 B、SO2的浓度: a点小于b点 C、反应物的总能量高于生成物的总能量 D、当容器内压强保持不变时,无法判断该反应达到平衡状态12. 合成氨反应为:。图1表示在2L的密闭容器中反应时的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始时氢气的物质的量对此反应平衡的影响。下列说法正确的是( )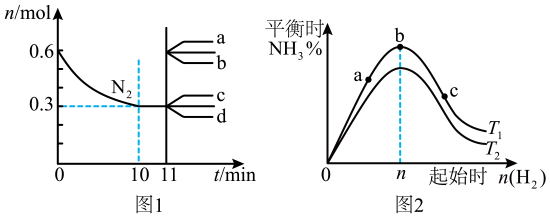 A、图1中,0-10min内该反应的平均速率 B、图1中,从11min起,其他条件不变,压缩容器体积为1L,的变化曲线为d C、图2中,a、b、c三点所处的平衡状态中,反应物的转化率最高的是b点 D、图2中,和表示温度,对应温度下的平衡常数为和 , 则: ,13. 将电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用催化剂电催化还原制甲酸的机理如图1所示,反应历程如图2所示,其中吸附在催化剂表面的物种用标注。下列说法错误的是( )
A、图1中,0-10min内该反应的平均速率 B、图1中,从11min起,其他条件不变,压缩容器体积为1L,的变化曲线为d C、图2中,a、b、c三点所处的平衡状态中,反应物的转化率最高的是b点 D、图2中,和表示温度,对应温度下的平衡常数为和 , 则: ,13. 将电催化转化成燃料和化学品具有重要意义。甲酸可以作为氢载体直接用于甲酸燃料电池。某科学家在常温下用催化剂电催化还原制甲酸的机理如图1所示,反应历程如图2所示,其中吸附在催化剂表面的物种用标注。下列说法错误的是( )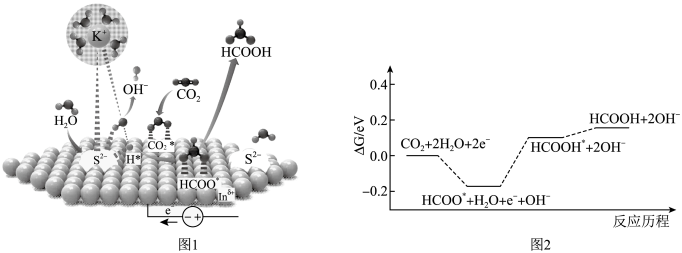 A、使用催化剂能够降低反应的活化能 B、催化剂活性位点在催化过程中的作用是活化水分子 C、制甲酸过程的决速步骤为 D、电催化还原 , 制甲酸总反应的
A、使用催化剂能够降低反应的活化能 B、催化剂活性位点在催化过程中的作用是活化水分子 C、制甲酸过程的决速步骤为 D、电催化还原 , 制甲酸总反应的三、非选择题
-
14. 利用催化技术可将汽车尾气中的和转化为和 , 化学方程式是:(1)、某温度下,在容积不变的密闭容器中通入和 , 测得不同时间的浓度如下表:
时间
0
1
2
3
……
3.60
3.05
2.85
2.76
……
用的浓度变化表示的平均反应速率为。
(2)、反应物初始浓度相同时,实验温度为和 , 进行以下实验:实验编号
实验目的
同种催化剂的比表面积
一段时间内的平均速率/
Ⅰ
对照实验
280
80
Ⅱ
研究催化剂比表面积对尾气转化速率的影响
a
120
Ⅲ
b
c
d
【实验分析与结论】
①补全表格a. , b. , c. , d.。
②测得 , 对比实验Ⅰ、Ⅱ,可得结论:。
③通过实验可得到“催化剂的比表面积相同时,温度升高,可增大尾气的转化速率”的结论,证据是。
15. KMnO4在生产和生活中有着广泛用途,某化学小组在实验室制备KMnO4并探究其性质。(1)、(一) KMnO4的制备,分步骤Ⅰ、Ⅱ两步进行。
步聚Ⅰ.先利用如图所示装置制备K2MnO4。称取7.0gKOH(s)和5.0gKClO3(s)放入容器A中,加热,待混合物熔融后,加入5.0gMnO2(s),待反应物干涸后,加大火焰强热4~8min,得墨绿色的锰酸钾。
A可选用(填标号)。①石英坩埚 ②瓷坩埚 ③铁坩埚
(2)、实验中发生反应生成K2MnO4的化学方程式为。(3)、Ⅱ.由K2MnO4制备KMnO4。已知:K2MnO4易溶于水,水溶液呈墨绿色。主要过程如下:①待A处物料冷却后,用20mL4%KOH溶液重复浸取,合并浸取液便得墨绿色的锰酸钾溶液。
②向滤液中通入足量CO2 , 使K2MnO4歧化为KMnO4和MnO2 , 过滤出生成的MnO2。
③再将滤液进行一系列处理,得KMnO4晶体。
过程②向滤液中通入足量CO2 , 可观察到的现象为;检验K2MnO4歧化完全的实验方法是。
(4)、(二) KMnO4的性质。已知:KMnO4具有强氧化性,可与草酸(H2C2O4)反应:。某化学小组选用硫酸酸化的0.05mol/L高锰酸钾溶液与草酸溶液反应,探究外界条件对化学反应速率的影响,进行了如下三组实验:
[实验内容及记录的数据]编号 室温下,试管中所加试剂及其用量/mL 室温下溶液颜色褪至无色所需时间/min H2C2O4溶液 KMnO4溶液 3mol/L稀硫酸 1 3.0 1.0 4.0 2.0 4.0 2 2.0 2.0 4.0 2.0 5.2 3 1.0 3.0 4.0 2.0 6.4
配制250mL 0.05mol/L的高锰酸钾溶液肯定不需要的仪器是(填标号)。a.蒸发皿 b.容量瓶 c.玻璃棒 d.烧杯 e.坩埚 f.胶头滳管
(5)、为达到实验目的,H2C2O4溶液的物质的量浓度不低于。(6)、利用实验1中数据计算,0~4min内,用KMnO4的浓度变化表示的反应速率:。16. 完成下列问题(1)、 一定条件下,在一体积不变的密闭容器中发生反应: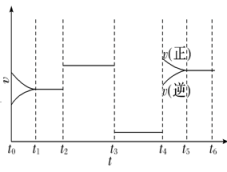
2A(g)+B(g)3C(g) ΔH=a kJ·mol-1。图为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
①t3时改变的条件为 , t4时改变的条件为。
②a(填“>”或“<”)0。
(2)、已知反应CO(g)+2H2(g)CH3OH(g),在恒容密闭容器中按加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=(kPa)-2(用平衡分压代替平衡浓度计算,p分=p总×物质的量分数),R、S两点平衡常数大小:Kp(R)(填“>”“=”或“<”)Kp(S)。
 (3)、CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是。17. 造成大气污染的NOx主要来自于汽车尾气的排放,对其如何处理是我们研究的重要课题。(1)、已知:
(3)、CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是。17. 造成大气污染的NOx主要来自于汽车尾气的排放,对其如何处理是我们研究的重要课题。(1)、已知:则用焦炭还原NO生成无污染气体的热化学方程式为。
(2)、在催化剂作用下发生反应: , 在一定温度下,向1L的恒容密闭容器中充入2.0molNO2和2.0molCO,测得相关数据如下:0min
5min
10min
15min
20min
2.00
1.70
1.56
1.50
1.50
0
0.15
0.22
0.25
0.25
①其他条件不变,若不使用催化剂,则0~5minNO2的转化率将(填“变大”、“变小”或“不变”)。
②以下表述能说明该反应已达到平衡状态的是。
A.气体的颜色不再变化 B.CO的反应速率为N2的4倍
C.混合气的压强不再变化 D.化学平衡常数K不再变化
③在20min时,保持温度不变,继续向容器中再加入1.0molNO2和1.0molN2 , 则化学平衡移动(填“正向”、“逆向”或“不”)。
(3)、有人利用反应对NO2进行吸附。在T℃下,向密闭容器中加入足量的C和一定量的NO2气体,在不同压强和相同时间下,NO2的转化率与压强的关系如图所示。
在T℃、1100KPa时,该反应的化学平衡常数(用平衡分压代替平衡浓度,气体分压=气体总压×体积分数;保留两位小数)。
18. 2021年度中国科学十大进展之一就是人工淀粉合成途径的研究,其关键步骤之一就是利用CO2合成出有机小分子。这将有利于我国实现碳达峰碳中和,有利于建设友好型社会。如CO2可与H2生成CH4:CO2(g)+4H2(g)CH4(g)+2H2O(g)。
(1)、我国科研人员提出了以Ni/Al2O3为催化剂,上述反应的历程如图所示:
下列说法错误的是____。(单选)
A、使用催化剂可有效提高反应物的平衡转化率 B、该历程中每生成1mol CH4 , 转移8NA个电子 C、在反应历程中,H-H键与C=O键断裂吸收能量 D、在反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能(2)、在恒温(T>100℃)恒容装置中进行该反应,能判断反应已达平衡状态的是____。(双选)A、混合气体密度不再改变 B、混合气体压强不再改变 C、混合气体平均摩尔质量不再改变 D、n (CO2): n(H2) =1:4(3)、将1mol CO2和4mol H2置于体积为2L的密闭容器中发生反应,测得H2O(g)的物质的量分数与温度的关系如右图所示,该反应的平衡常数K随温度升高而(填“增大”或“减小”)。判断依据是。 (4)、下列措施有利于提高反应中CO2的平衡转化率的是____。(单选)A、使用催化剂 B、加压 C、升高温度 D、增大初始投料比n(CO2)/n(H2)(5)、我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
(4)、下列措施有利于提高反应中CO2的平衡转化率的是____。(单选)A、使用催化剂 B、加压 C、升高温度 D、增大初始投料比n(CO2)/n(H2)(5)、我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。
①、②与过渡态三种物质中,最不稳定的是;①转化为②过程中(选填“吸收”或“放出”)能量。
(6)、25℃、100kPa下,CH4(g)、CH3COOH(l)的燃烧热分别﹣893kJ·mol-1、﹣870 kJ·mol-1 , 计算转化反应CO2(g) + CH4(g) = CH3COOH(l)的焓变ΔH= kJ·mol-1。二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。反应可表示为:CO2 (g) + 3H2(g)CH3OH(g) + H2O (g)
(7)、该反应平衡常数的表达式K=;(8)、上述反应体系在一定条件下建立平衡后,下列说法正确的有____。(双选)A、增大H2的浓度,平衡向右移动 B、移去部分CH3OH,正反应速率增大 C、降低反应温度,正、逆反应速率都减小 D、加入催化剂,可提高CO2的平衡转化率(9)、在5L密闭容器中充入1mol CO2和3mol H2 , 测得一定时间内混合气体中CH3OH的体积分数φ(CH3OH)与温度的关系如下图所示。
若温度为T时,反应10分钟,φ(CH3OH)=30%,则0~10分钟内,CH3OH的平均反应速率 ʋ =。
(10)、该反应是反应(选填“吸热”或“放热”);其它条件相同时,CH3OH在a点的正反应速率 CH3OH在b点的正反应速率(选填“>”、“<”或“=”);解释温度低于T时,φ(CH3OH)随温度升高而逐渐增加的原因。(11)、反应CO2 (g) + 3H2(g)CH3OH(g) + H2O (g)通过如下步骤来实现:①CO2 (g) +H2(g) CO(g) + H2O (g) ②CO(g) +2H2(g) CH3OH(g)
上述反应过程中能量变化可用如图表示,

其中反应为慢反应(填“①”或“②”)。对反应②自发性的判断正确的是(单选),判断依据是。
A.高温下自发 B.低温下自发 C.始终自发 D.始终不自发