高中化学选择性必修1单元分层测试:第一章 化学反应的热效应 B卷
试卷更新日期:2023-11-17 类型:单元试卷
一、选择题
-
1. 已知4g氢气完全燃烧生成水蒸气时放出能量484 kJ,拆开1mol氧气中的化学键需要消耗496 kJ能量,水蒸气中1 mol H−O键形成时放出能量463 kJ,则氢气中1 mol H−H键断裂时吸收的能量为( )A、436 kJ B、557 kJ C、920 kJ D、188 kJ2. 已知反应:①101kPa时,C(s) + 1/2O2(g)=CO(g);△H1=-110.5kJ/mol
②稀溶液中,H+(aq) + OH-(aq)=H2O(1);△H2=-57.3kJ/mol
下列结论正确的是A、浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量 B、若碳的燃烧热用△H3来表示,则△H3<△H1 C、若碳的燃烧热用△H3来表示,则△H3>△H1 D、稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量3. 向溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )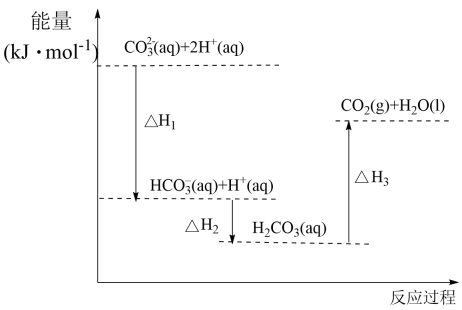 A、反应(1)为放热反应 B、 C、 D、(1),若使用催化剂,则变小4. 由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法错误的是( )
A、反应(1)为放热反应 B、 C、 D、(1),若使用催化剂,则变小4. 由N2O和NO反应生成N2和NO2的能量变化如图所示。下列说法错误的是( ) A、反应生成1 mol N2时转移4 mol e- B、反应物能量之和大于生成物能量之和 C、N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1 D、断键吸收能量之和小于成键释放能量之和5. 下列实验现象能充分说明对应的化学反应是放热反应的是( )
A、反应生成1 mol N2时转移4 mol e- B、反应物能量之和大于生成物能量之和 C、N2O(g)+NO(g)=N2(g)+NO2(g) ΔH=-139 kJ·mol-1 D、断键吸收能量之和小于成键释放能量之和5. 下列实验现象能充分说明对应的化学反应是放热反应的是( )选项
A
B
C
D
反应装置


实验现象
反应开始后,针筒活塞向右移动
稀释时烧杯壁温度明显升高
U形管的液面左高右低
温度计的水银柱不断上升
A、A B、B C、C D、D6. 下图是计算机模拟的在催化剂表面上水煤气变化的反应历程。吸附在催化剂表面的物种用“*”标注。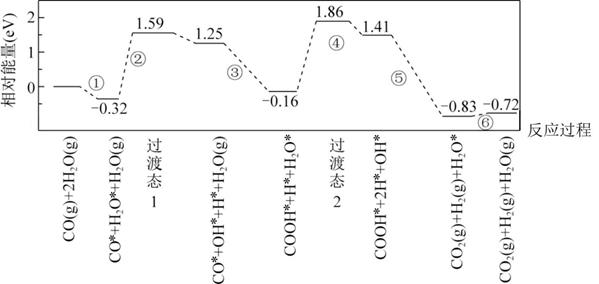
下列说法正确的是( )
A、①表示CO和H2O从催化剂表面脱离的过程 B、②和④中化学键变化相同,因此吸收的能量相同 C、由图可知CO(g)+H2O(g)=CO2(g)+H2(g)为吸热反应 D、本历程中的催化剂通过改变水煤气变化反应的焓变,来实现改变其反应速率二、多选题
-
7. 研究表明,在一定条件下,气态HCN(a)与HNC(b)两种分子的互变反应过程能量变化如图所示。下列说法错误的是
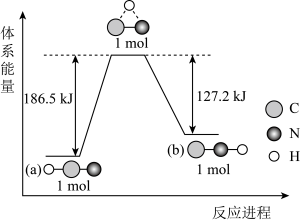 A、HCN比HNC更稳定 B、HCN(g)→HNC(g)为吸热反应且反应条件一定要加热 C、1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量 D、1 mol HCN(g)转化为1mol HNC(g)需要吸收59.3 kJ的热量8. 探究小组在25℃和101kPa下进行中和热测定,取用的盐酸和的NaOH溶液(密度均为)。实验数据如下:
A、HCN比HNC更稳定 B、HCN(g)→HNC(g)为吸热反应且反应条件一定要加热 C、1 mol HCN(g)中的所有化学键全部断开需要吸收186.5 kJ的热量 D、1 mol HCN(g)转化为1mol HNC(g)需要吸收59.3 kJ的热量8. 探究小组在25℃和101kPa下进行中和热测定,取用的盐酸和的NaOH溶液(密度均为)。实验数据如下:实验序号
起始温度
终止温度
温度差
HCl
NaOH
平均值
1
25.4
25.0
25.2
28.5
3.3
2
24.5
24.5
24.5
27.5
3.00
3
25.0
24.5
24.75
26.5
1.75
已知:中和后生成的溶液的比热容为 , 该实验条件下,中和热的理论值为。下列说法正确的是( )
A、该实验计算出中和热的平均值低于理论值 B、造成实验误差的原因可能是溶液混合后未及时盖好量热计杯盖 C、实验时,可用的醋酸代替盐酸 D、实验中,NaOH溶液用量越大,所测中和热数值越大三、非选择题
-
9. 在标准状况下,仅由C、H两种元素组成的气体M的质量为。在、下完全燃烧生成和 , 放出的热量,回答下列问题:(1)、的物质的量为 , 分子式为。(2)、表示M燃烧热的热化学方程式为 , 每生成 , 转移的电子数为。(3)、已知:。在上述条件下,由和一定量M组成的混合气体完全燃烧生成和 , 同时放出的热量。
①混合气体中的物质的量为。
②将完全燃烧后所得的通入溶液中,完全反应后所得溶液中的溶质为(填化学式,不考虑气体逸出)。
③已知:。则M完全燃烧生成和所放出的热量为。
10. 按要求回答下列问题:(1)、已知12g石墨变为12g金刚石需吸收能量。①上述变化属于(填“物理”或“化学”)变化。
②常温常压下,石墨与金刚石更稳定的是。
(2)、如图所示是反应过程中的能量变化图。由图可知,反应物的总键能(填“>”、“<”或“=”)生成物的总键能。 (3)、为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
(3)、为了探究化学能与热能的转化,某实验小组设计了如下三套实验装置:
①上述三套装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是。
②某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钡溶液与稀硫酸,U形管中可观察到的现象是 , 说明该反应属于(填“吸热”或“放热”)反应。
11. 稀强酸、稀强碱反应生成1mol水时放出57.3 kJ的热。(1)、实验室中可用稀盐酸和氢氧化钠稀溶液反应来测定中和热。请写出能表示该反应中和热的热化学方程式;(2)、分别取40 mL 0.50 mol/L盐酸与40 mL 0.55 mol/L NaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。假设盐酸和氢氧化钠溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c = 4.18 J/(g·℃)。实验时,测得反应前盐酸与NaOH溶液的平均温度为21.5℃,反应后混合溶液的温度为24.9℃。则实验测得的中和热△H=(保留1位小数)(3)、如果用含1 mol CH3COOH的稀醋酸与足量稀氢氧化钠溶液反应,反应放出的热57.3 kJ(填“大于”、“小于”或“等于”); 理由是。(4)、25℃时,用50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液反应测定中和热,下列说法正确的是。(填字母序号)
a.可用如图所示装置测定中和热
b.若将环形玻璃搅拌棒换成铜丝,测定的△H偏低
c.若2种溶液的体积均改为60mL,测定的△H偏高
d.若将盐酸改为醋酸,测定的△H偏高
12. 按要求回答下列问题:(1)、某同学做如下实验,以检验反应中的能量变化。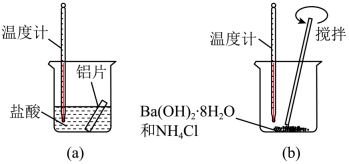
①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是热反应,(b)中温度降低,由此可以判断(b)中反应是热反应。
②写出铝与盐酸反应的离子方程式:。
③根据能量守恒定律,(b)中反应物的总能量应该(填“高于”或“低于”)其生成物的总能量。
(2)、如图表示1mol与1mol反应生成2molHCl的能量变化的理论分析示意图。
①化学键断裂需要(填“释放”或“吸收”)能量。
②图中共释放的能量为kJ。
③该反应的反应物的总能量(填“大于”、“等于”或“小于”)生成物的总能量,所以该反应是反应。
13. 回答下列问题:(1)、实验测得10g液态甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出227kJ的热量。试写出甲醇燃烧的热化学方程式:。(2)、现已知A2(g)和B2(g)反应生成1 molAB3(g)过程中能量变化示意如下图。根据下列已知键能数据计算A-B键键能为kJ/mol 。
化学键
A≡A
B-B
键能(kJ/mol)
946
436
(3)、在如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
①从实验装置上看,图中缺少的一种玻璃仪器是。烧杯间填满碎纸条的作用是。若大烧杯上不盖硬纸板,求得的中和热ΔH (填“偏大”“偏小”或“无影响”)。
②甲同学用50 mL 0.50 mol·L-1盐酸与 50 mL 0.55 mol·L-1 NaOH溶液进行中和反应,通过计算得到ΔH=-54.8kJ/mol,该结果与ΔH=-57.3kJ·mol-1有偏差,产生此偏差的原因可能是。
A、用温度计测定HCl溶液起始温度后直接测定NaOH溶液的温度
B、一次性把NaOH溶液倒入盛有硫酸的小烧杯中
C.实验装置保温、隔热效果差
③若改用 60 mL 0.50 mol·L-1盐酸与 60 mL 0.55 mol·L-1 NaOH溶液进行反应,两个实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”)若用50mL0.5mol·L-1醋酸代替盐酸溶液进行上述实验,测得反应前后温度的变化值会(填“偏大”、“偏小”或“不受影响”)。