高中化学选择性必修1单元分层测试:第一章 化学反应的热效应 A卷
试卷更新日期:2023-11-17 类型:单元试卷
一、选择题
-
1. 下列关于化学反应中的能量变化说法正确的是( )A、需要加热才能发生的反应一定是吸热反应 B、化学反应不一定伴随能量变化 C、金刚石转化为石墨是放热反应,说明金刚石比石墨稳定 D、燃烧反应、酸碱中和反应是常见的放热反应2. 下列反应属于氧化还原反应且能量变化符合图像的是( )
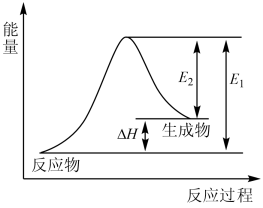 A、C(s)+CO2(g) = 2CO(g) B、CH4(g)+2O2(g) = CO2(g)+2H2O(l) C、NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) D、Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3(g)+10H2O(l)3. 自然界中臭氧形成反应的能量变化如图所示。下列说法中正确的是( )
A、C(s)+CO2(g) = 2CO(g) B、CH4(g)+2O2(g) = CO2(g)+2H2O(l) C、NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l) D、Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3(g)+10H2O(l)3. 自然界中臭氧形成反应的能量变化如图所示。下列说法中正确的是( )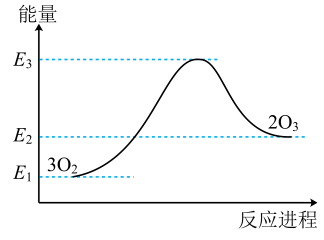 A、根据能量图可以判断为放热反应 B、臭氧比氧气稳定 C、O2的能量低于O3的能量 D、断开中的化学键吸收的能量大于形成中的化学键释放的能量4. 根据图示的能量转化关系判断下列说法正确的是( )
A、根据能量图可以判断为放热反应 B、臭氧比氧气稳定 C、O2的能量低于O3的能量 D、断开中的化学键吸收的能量大于形成中的化学键释放的能量4. 根据图示的能量转化关系判断下列说法正确的是( )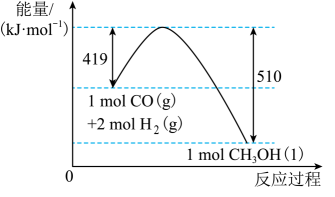 A、与反应生成32 g 吸收91 kJ能量 B、形成2 mol H-H和1 mol C≡O(CO)共吸收419 kJ的能量 C、分子中只含有极性共价键 D、1 mol 具有的能量高于2 mol 和1 mol 具有的能量5. 根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法正确的是( )
A、与反应生成32 g 吸收91 kJ能量 B、形成2 mol H-H和1 mol C≡O(CO)共吸收419 kJ的能量 C、分子中只含有极性共价键 D、1 mol 具有的能量高于2 mol 和1 mol 具有的能量5. 根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法正确的是( )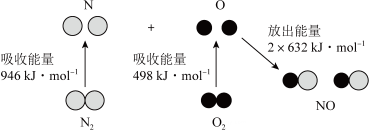 A、该反应中反应物所具有的总能量高于生成物所具有的总能量 B、2mol氮原子结合生成N2(g)时需要放出946kJ能量 C、1mol NO(g)分子中的化学键断裂时需要放出632kJ能量 D、上述过程描述的是2mol的N2与2mol O2反应的能量变化过程6. 下列与化学反应能量变化相关的叙述正确的是( )A、对于反应 , 在其他条件不变的情况下,改变压强,平衡不发生移动,反应放出的热量不变 B、同温同压下,在光照和点燃条件下的焓变不同 C、甲烷的标准燃烧热为 , 则甲烷燃烧的热化学方程式可表示为: D、500℃、30MPa下,将和置于密闭容器中充分反应生成气体,放热 , 其热化学方程式为:7. 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )
A、该反应中反应物所具有的总能量高于生成物所具有的总能量 B、2mol氮原子结合生成N2(g)时需要放出946kJ能量 C、1mol NO(g)分子中的化学键断裂时需要放出632kJ能量 D、上述过程描述的是2mol的N2与2mol O2反应的能量变化过程6. 下列与化学反应能量变化相关的叙述正确的是( )A、对于反应 , 在其他条件不变的情况下,改变压强,平衡不发生移动,反应放出的热量不变 B、同温同压下,在光照和点燃条件下的焓变不同 C、甲烷的标准燃烧热为 , 则甲烷燃烧的热化学方程式可表示为: D、500℃、30MPa下,将和置于密闭容器中充分反应生成气体,放热 , 其热化学方程式为:7. 各相关物质的燃烧热数据如下表。下列热化学方程式正确的是( )物质
A、 B、 C、 D、二、多选题
-
8. 下列说法正确的是( )A、当生成2mol时放出92.4kJ热量,将0.5mol和足量在此条件下充分反应,放出热量46.2kJ B、反应放热,则白磷比红磷稳定 C、反应放热,则相同条件下,1mol和1mol断键吸收的总能量小于生成2mol成键释放的总能量 D、相同条件下,如果1mol氢原子所具有的能量为 , 1mol氢分子的能量为 , 则9. 下列各组热化学方程式中,∆H的比较正确的是( )
①C(s)+O2(g)=CO2(g) ∆H1 C(s)+O2(g)=CO (g) ∆H2
②S(s)+O2(g)=SO2(g) ∆H3 S(g)+O2(g)=SO2(g) ∆H4
③H2(g)+O2(g)=H2O(l) ∆H5 2H2(g)+O2(g)=2H2O(l) ∆H6
④CaO(s)+H2O(l)=Ca(OH)2(s) ∆H7 CaCO3(s)=CaO(s)+CO2(g) ∆H8
A、∆H1<∆H2 B、∆H3<∆H4 C、∆H5>∆H6 D、∆H7>∆H810. 下列图示与对应的叙述不相符的是( )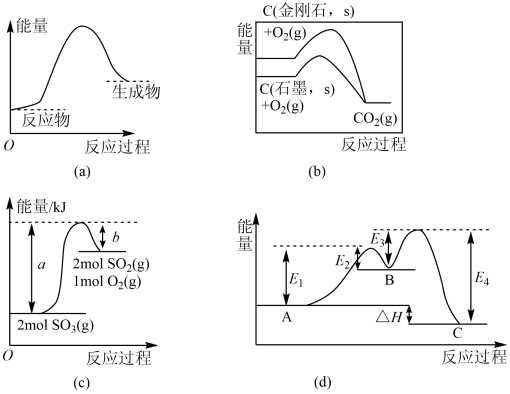 A、(a)图表示反应物断键吸收的能量大于生成物成键放出的能量 B、(b)图是金刚石与石墨分别被氧化生成的能量关系曲线,说明石墨转化为金刚石的反应的 C、由(c)图可知, D、(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(表示能量),整个反应中11. 合成氨对解决粮食问题贡献巨大,反应如下:。该反应的能量变化及微观历程的示意图如图所示表示物质吸附在催化剂表面的形态)。下列说法错误的是( )
A、(a)图表示反应物断键吸收的能量大于生成物成键放出的能量 B、(b)图是金刚石与石墨分别被氧化生成的能量关系曲线,说明石墨转化为金刚石的反应的 C、由(c)图可知, D、(d)图是某反应:A→C(由两步反应A→B→C完成,B为中间产物)的能量曲线(表示能量),整个反应中11. 合成氨对解决粮食问题贡献巨大,反应如下:。该反应的能量变化及微观历程的示意图如图所示表示物质吸附在催化剂表面的形态)。下列说法错误的是( )
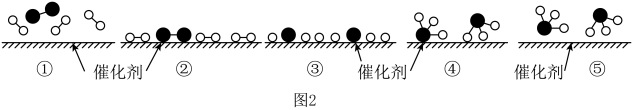 A、在催化剂表面只存在的断裂,不存在的形成 B、图2中②③的过程吸收能量 C、③④的过程可表示为: D、其他条件相同,使用催化剂可以减少合成氨反应放出的热量
A、在催化剂表面只存在的断裂,不存在的形成 B、图2中②③的过程吸收能量 C、③④的过程可表示为: D、其他条件相同,使用催化剂可以减少合成氨反应放出的热量三、非选择题
-
12. 已知乙炔与苯蒸气完全燃烧的热化学方程式如下所示:
①2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH= -2600 KJ•mol-1
②2C6H6(g)+15O2(g)=12CO2(g)+6H2O(l) ΔH= -6590 KJ•mol-1
(1)、C2H2(g)的燃烧热ΔH=kJ•mol-1。(2)、2molC6H6(l)完全燃烧生成液态水时|ΔH| (填“>、<或=”)(3)、3molC2H2(g)转化为1mol C6H6(g)反应的ΔH=kJ•mol-1。13. 回答下列问题:(1)、1902年德国化学家哈伯研究出合成氨的方法。断开1molH-H键、N-H键、N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ。则氮气和氢气生成1molNH3(填“吸收”或“放出”)的热量Q=kJ。在密闭容器中0.5molN2和1.5molH2充分反应后热量变化小于Q,原因是:。(2)、推测反应2NH3(l)2N2(g)+3H2(g)比反应2NH3(g)2N2(g)+3H2(g)(填“吸收”或“放出”)的热量(填“多”或“少”)。(3)、已知稀溶液中1molH2SO4与NaOH溶液恰好完全反应时,放出114.6kJ热量,写出稀溶液中H2SO4与NaOH发生中和反应时,表示中和热的热化学反应方程式:。(4)、已知下列热化学方程式:①CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(l)△H1=-870.3kJ·mol-1
②C(s)+O2(g)=CO2(g)△H2=-393.5kJ·mol-1
③2H2(g)+O2(g)=2H2O(1)△H3=-571.6kJ·mol-1
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式:。
14. 化学反应伴随能量变化,获取反应能量变化有多条途径。(1)、下列反应中,属于吸热反应的是____(填字母)。A、Na2O与水反应 B、甲烷的燃烧反应 C、Ba(OH)2·8H2O与氯化铵反应 D、锌与盐酸反应(2)、获取能量变化的途径①通过化学键的键能计算。已知:
化学键种类
H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
247
434
计算可得:H2(g)+Cl2(g)=2HCl(g) △H= kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:。
(3)、以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。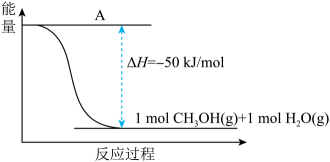
①补全上图:图中A处应填入。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H(填“变大”“变小”或“不变”)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
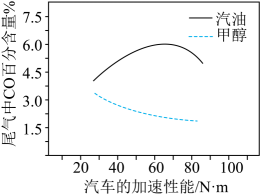
据图信息分析,与汽油相比,甲醇作为燃料的优点是。
15. 完成下列问题。(1)、下列变化中,属于放热反应的是 , 属于吸热反应的是。(填标号)①氧化钙与水反应;②石灰石在高温下的分解反应;③酸碱中和反应;④二氧化碳通过炽热的炭发生的反应;⑤食物因氧化而腐败发生的反应;⑥与的反应;⑦干冰汽化。
(2)、为探究固体M溶于水的热效应,选择如图所示装置进行实验(反应在甲中进行)。观察到烧杯里产生气泡,则M溶于水(填“一定”或“可能”)是放热反应。 (3)、2022年2月18日,“美丽中国·绿色冬奥”专场新闻发布会在北京新闻中心举行。发展碳捕集与利用的技术,将CO2转化为高附加值的化学品,实现CO2资源化利用,是一项重要的碳减排技术。CO2加氢(RWGS)制合成气(CO)
(3)、2022年2月18日,“美丽中国·绿色冬奥”专场新闻发布会在北京新闻中心举行。发展碳捕集与利用的技术,将CO2转化为高附加值的化学品,实现CO2资源化利用,是一项重要的碳减排技术。CO2加氢(RWGS)制合成气(CO)RWGS反应: 反应ⅰ
副反应: 反应ⅱ
①已知:
则。
②混合动力汽车所用的燃料之一是乙醇,lg乙醇完全燃烧生成CO2气体和液态H2O放出30.0kJ热量,写出乙醇燃烧的燃烧热的热化学方程式。