吉林省四平市普通高中2023-2024学年高二上学期期中教学质量检测化学试题
试卷更新日期:2023-11-17 类型:期中考试
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 下列不属于自发过程的是( )
A
B
C
D



水从高处往低处流
冰在常温下融化
铁在潮湿空气中生锈
石墨转化为金刚石
A、A B、B C、C D、D2. 下列反应既属于氧化还原反应又属于放热反应的是( )A、浓硫酸的稀释 B、受热分解 C、Na与水反应 D、与反应3. 下列热化学方程式书写正确的是( )A、 B、 C、 D、4. 已知:①②
③
则为(用a、b表示)( )
A、 B、 C、 D、5. 已知:。铬酸()可用于镀铬、制颜料,也可用于某些釉和彩色玻璃的生产。常温下,下列事实能说明是弱电解质的是( )A、易溶于水 B、等浓度0.01的盐酸和溶液,盐酸的pH=2,的pH>2 C、在水中发生电离: D、用物质的量浓度相同的NaCl溶液和溶液进行导电性实验,比较灯泡的亮度6. 在一密闭容器中发生反应: , 达到平衡时采取下列措施,可以使正反应速率()不变的是( )A、容积不变,充入“惰”气 B、扩大容积 C、缩小容积 D、移走少量D7. 下列事实不能用勒夏特列原理解释的是( )A、加热浓氨水制取氨气 B、对平衡体系增大压强使颜色变深 C、工业制金属钾: , 选取适宜的温度,使K从反应混合物中分离出来,有利于K的生成 D、光照新制氯水时,溶液的颜色逐渐变浅8. 实验设计的科学性反映了实验者的科学素养。以HCl溶液和NaOH溶液为例,进行中和反应反应热的测定实验,下列有关说法正确的是( )A、用温度计测量HCl溶液的温度后直接测量NaOH溶液的温度 B、测定中和热时,将NaOH溶液分次缓慢倒入装有盐酸的量热计中 C、同时增大反应物NaOH溶液和盐酸的体积,测得的中和反应的反应热同倍数增大 D、完成中和反应反应热测定实验中玻璃搅拌器不可用铜丝代替9. 一定条件下密闭容器中发生反应:。该反应达到平衡状态的标志是( )A、、、三种气体共存时 B、的消耗速率等于的消耗速率 C、容器中各组分的体积分数不随时间而变化 D、容器混合气体的总质量不变10. 已知0.1的醋酸溶液中存在电离平衡: , 要使溶液中增大.可以采取的措施是( )A、加少量烧碱溶液 B、升高温度 C、加固体 D、加水11. 生产液晶显示器过程中使用的化学清洗剂是一种温室气体,其存储能量的能力是的12000~20000倍,以下是几种化学键的键能:化学键
键能/()
941.7
154.8
283.0
则反应 (假设反应可以发生),为( )
A、 B、 C、 D、12. 羟胺()在水溶液中的电离方程式为。常温下,向该溶液中加入NaOH固体,下列说法不正确的是( )A、平衡常数K不变 B、增大 C、平衡向左移动 D、减小13. 在密闭容器中进行反应: , 下列有关图像的说法正确的是( ) A、依据图a可判断该反应为吸热反应 B、在图b中,虚线可表示压强增大 C、若该反应的 , 图c可表示升高温度使平衡向逆反应方向移动 D、由图d中气体平均相对分子质量随温度的变化情况,可推知该反应的14. Burns和Dainton研究发现与CO合成的反应机理如下:
A、依据图a可判断该反应为吸热反应 B、在图b中,虚线可表示压强增大 C、若该反应的 , 图c可表示升高温度使平衡向逆反应方向移动 D、由图d中气体平均相对分子质量随温度的变化情况,可推知该反应的14. Burns和Dainton研究发现与CO合成的反应机理如下:① 快
② 快
③ 慢
其中反应②存在;。下列说法正确的是( )
A、反应②的平衡常数 B、反应①②的活化能均大于反应③ C、增加浓度能增加活化分子百分数,加快反应速率 D、是该反应的催化剂15. 二氧化碳减排和再利用是促进社会环保和工业可持续发展的重要措施。将工业废气中的转化为 , 可以通过以下途径实现:反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
反应Ⅰ和反应Ⅱ的平衡常数K随温度T的变化如图所示。下列说法正确的是( )
 A、反应Ⅲ是吸热反应 B、温度: C、缩小反应器体积,可使反应Ⅲ的平衡向逆反应方向移动 D、时反成Ⅲ的平衡常数
A、反应Ⅲ是吸热反应 B、温度: C、缩小反应器体积,可使反应Ⅲ的平衡向逆反应方向移动 D、时反成Ⅲ的平衡常数二、非选择题:本题共4小题,共55分。
-
16. 已知反应过程的能量变化如图所示:
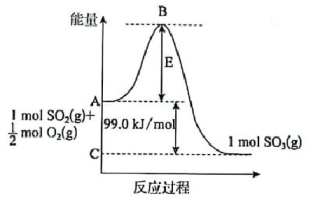 (1)、由图可知为(填“吸热”或“放热”)反应。(2)、图中C点表示。E所代表的能量是该反应的;E的大小对该反应的反应热(填“有”或“无”)影响。(3)、请求出反应的焓变。(4)、又知 , 请根据题给条件求出反应的焓变。(5)、25℃、101 kPa时,11g丙烷()完全燃烧生成和液态水时放出的热量是555.0 kJ,则表示丙烷燃烧热的热化学方程式是。17. 把在空气中久置的镁条7.2g投入盛有500mL 0.5硫酸的烧杯中,镁条与硫酸反应产生氢气的总体积与反应时间的关系如图所示。回答下列问题:
(1)、由图可知为(填“吸热”或“放热”)反应。(2)、图中C点表示。E所代表的能量是该反应的;E的大小对该反应的反应热(填“有”或“无”)影响。(3)、请求出反应的焓变。(4)、又知 , 请根据题给条件求出反应的焓变。(5)、25℃、101 kPa时,11g丙烷()完全燃烧生成和液态水时放出的热量是555.0 kJ,则表示丙烷燃烧热的热化学方程式是。17. 把在空气中久置的镁条7.2g投入盛有500mL 0.5硫酸的烧杯中,镁条与硫酸反应产生氢气的总体积与反应时间的关系如图所示。回答下列问题: (1)、0~a时间段内不产生氢气的原因是(用离子方程式表示)。(2)、(填“ab”“bc”或“cd”)段化学反应速率最快,原因是。(3)、在b到c这段时间内,收集到V L(标准状况)氢气,则这段时间内用硫酸表示的平均反应速率为(假设反应前后溶液体积不变)。(4)、为研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验:将表中所给的混合溶液分别加入6个盛有过量镁片的容器中,收集产生的气体,记录获得相同体积气体所需的时间。
(1)、0~a时间段内不产生氢气的原因是(用离子方程式表示)。(2)、(填“ab”“bc”或“cd”)段化学反应速率最快,原因是。(3)、在b到c这段时间内,收集到V L(标准状况)氢气,则这段时间内用硫酸表示的平均反应速率为(假设反应前后溶液体积不变)。(4)、为研究硫酸铜的量对氢气生成速率的影响,某同学设计了如下一系列实验:将表中所给的混合溶液分别加入6个盛有过量镁片的容器中,收集产生的气体,记录获得相同体积气体所需的时间。实验混合溶液
A
B
C
D
E
F
4的溶液/mL
30
饱和溶液/mL
0
0.5
2.5
5
20
/mL
10
0
①请完成此实验设计:其中 , 。
②该同学最后得出的结论为当加入少量饱和溶液时,生成氢气的速率会大大提高,但当加入的饱和溶液超过一定量时,生成氢气的速率反而会下降。请分析氢气生成速率下降的主要原因:。
18. 常温下,叠氮酸()是一元弱酸,高锰酸()是一元强酸,0.1的高铼酸()、0.1的高锰酸()溶液分别与0.1的NaOH溶液等体积混合,所得溶液均呈中性。请回答下列问题:(1)、高铼酸属于(填“强”或“弱”)酸,中Re的化合价为。(2)、的电离方程式为 , 常温下,已知 , 则0.1的溶液中。(3)、已知25℃时,三种酸的电离常数如下:化学式
HClO
—
—
写出下列在溶液中发生反应的离子方程式:
(少量):;
(少量):。
19. 科研、生产中常涉及碳的化合物。回答下列问题:(1)、700℃时,向容积为3L的恒容密闭容器中充入一定量的CO和 , 发生反应: , 反应过程中测定的部分数据见下表:反应时间/min
0
1.8
0.9
2
1.2
x
4
y
0.3
①反应前2min内的平均反应速率;表中y的值为。
②判定2min时达到平衡状态的理由是。
(2)、工业上可利用煤的气化产物(水煤气)合成二甲醚: 。一定条件下的密闭容器中,该反应达到平衡,要提高的转化率,可以采取的措施是(填字母)。a.升高温度 b.加入催化剂
c.减小的浓度 d.增大压强(缩小容器体积)
(3)、高炉炼铁中发生的主要反应为。已知该反应平衡常数随温度变化如图所示,该反应平衡常数表达式为 , 0(填“>”“<”或“=”)。 (4)、能与反应制得甲醇(): 。一定条件下,将2 mol 和4 mol 充入密闭容器中,发生反应制取甲醇,的平衡转化率与温度、平衡总压强的关系如图所示。
(4)、能与反应制得甲醇(): 。一定条件下,将2 mol 和4 mol 充入密闭容器中,发生反应制取甲醇,的平衡转化率与温度、平衡总压强的关系如图所示。
①、、由大到小的顺序为。
②条件下255℃时,该反应的压强平衡常数(为以分压表示的平衡常数,分压=总压×物质的量分数;计算结果保留1位小数)。