吉林省长春市南关区2023-2024学年高三上学期10月月考化学试题
试卷更新日期:2023-11-17 类型:月考试卷
一、选择题(每题只有一个正确选项,2×10=20分)
-
1. 下列应用中涉及到氧化还原反应的是A、使用明矾对水进行净化 B、雪天道路上撒盐融雪 C、暖贴中的铁粉遇空气放热 D、荧光指示牌被照发光2. 考古中出土的锡青铜(铜锡合金)文物常有覆盖其表面。下列说法正确的是( )A、锡青铜的熔点比纯铜高 B、锡青铜文物在潮湿环境中的腐蚀比干燥环境中快 C、锡青铜中的锡加速了铜的腐蚀速度 D、生成覆盖物是电化学腐蚀过程,但不是化学反应过程3. 下列说法正确的是( )A、用丁达尔效应区分溶液与胶体 B、用浓硫酸干燥碘化氢气体 C、用乙醇萃取碘水中的碘 D、用分液漏斗可分离溴苯和溴的混合物4. 为阿伏加德罗常数的值。下列叙述正确的是( )A、与的混合物中所含中子数为 B、标准状况下,11.2L丙烷具有的共价键数为 C、电解精炼铜时,若电路中转移0.2mol电子,阳极质量减少6.4g D、常温下,0.5molFe投入浓硫酸中,反应转移的电子数为5. 海洋是巨大的资源宝库,从海水中提取的氯化钠是一种重要的化工原料。下列说法正确的是( )A、利用日光和风力使海水蒸干,可以获得大量纯净氯化钠 B、工业上通过电解饱和氯化钠溶液来制取金属钠 C、氯化钠在日常生活中可用作调味剂,也可用作防腐剂 D、向饱和氯化钠溶液先通入过量 , 再通入氨气,会析出大量固体6. 一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是( )
A
硫酸亚铁溶液出现棕黄色沉淀
B
硫化钠溶液出现浑浊颜色变深
C
溴水颜色逐渐褪去
D
胆矾表面出现白色粉末
A、A B、B C、C D、D7. 向、的混合溶液中逐滴加入稀盐酸,生成气体的量随HCl的量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是( ) A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、8. 下列装置可以用于相应实验的是
A、a点对应的溶液中:、、、 B、b点对应的溶液中:、、、 C、c点对应的溶液中:、、、 D、d点对应的溶液中:、、、8. 下列装置可以用于相应实验的是A
B
C
D
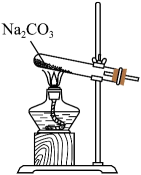
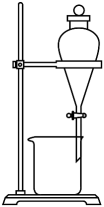
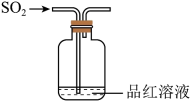
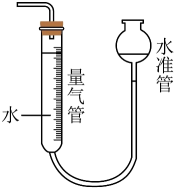
制备
分离乙醇和乙酸
验证酸性
测量体积
A、A B、B C、C D、D9. 把和组成的固体混合物溶于水配成100mL溶液,其中 , 若把等质量的固体混合物加热至恒重,残留固体质量是( )A、3.18g B、6.36g C、4.22g D、5.28g10. 称取一定质量的纯碱溶于水中,与适量的盐酸作用,下列关于盐酸的用量和气体产量的变化说法正确的是( )A、若纯碱中混有 , 盐酸用量将偏大;气体产量将偏大 B、若纯碱中混有 , 盐酸用量将偏大;气体产量将偏大 C、若纯碱中混有 , 盐酸用量将偏小;气体产量将偏大 D、若纯碱中混有 , 盐酸用量将偏大;气体产量将偏小二、选择题(每题只有一个正确选项,3×10=30分)
-
11. 下列有关金属的说法中,正确的是( )A、Al是地壳中含量最高的金属元素,金属Al的价格与Al的冶炼成本有关 B、Fe是现代工业的基础,铝热法冶炼Fe工艺简单,可以大规模推广 C、纯Cu多应用于电气工业,粗Cu的精炼应用了原电池原理 D、Na常应用于制高压钠灯原子反应堆的导热剂等,金属Na是氯碱工业的产品12. 化学实验中常将溶液或试剂进行酸化,下列酸化处理的措施正确的是( )A、定性检验 , 将溶液用稀硝酸酸化 B、为提高溶液的氧化能力,用盐酸将溶液酸化 C、检验溶液中是否含有时,用稀硝酸酸化 D、检验溶液中是否含时,在无其他阳离子干扰的条件下,先用盐酸酸化,再向溶液中加溶液13. 下列操作与现象及推论均正确的是( )
选项
操作与现象
推论
A
向溶液中加入少量的粉末,产生红褐色沉淀
硫酸亚铁已变质
B
向溶液中加入含淀粉的KI溶液,溶液变蓝色,并生成白色沉淀
白色沉淀是
C
向溶液中加入溶液,产生白色沉淀
用溶液可鉴别溶液和溶液
D
在乙醇中加入一小块钠,钠沉入底部并观察到气泡产生
钠的密度大于乙醇的密度,且生成的气体为氢气
A、A B、B C、C D、D14. 部分含铁微粒所带的电荷数与其中铁元素化合价的关系如图所示,由该图可预测含铁微粒间相互转化时所需试剂。下列推断不合理的是( ) A、M一定为FeO B、若R为单质,则常温下浓硫酸可使R针化 C、若Q为金属阳离子,则可用溶液检验 D、与氧化剂在碱性条件下反应可生成15. 某同学探究还原性的实验记录如下:
A、M一定为FeO B、若R为单质,则常温下浓硫酸可使R针化 C、若Q为金属阳离子,则可用溶液检验 D、与氧化剂在碱性条件下反应可生成15. 某同学探究还原性的实验记录如下:①
②
③



溶液变红,大约10秒左右红色褪去,有气体生成(经检验为)。取褪色后溶液,滴加盐酸和溶液,产生白色沉淀
溶液变红且不褪色,有气体生成(经检验为),经检验有丁达尔效应
溶液变红且不褪色,滴加盐酸溶液,无白色沉淀,经检验无丁达尔效应
下列说法错误的是( )
A、对比①②,可以判定酸性越强,的氧化能力越强 B、①中发生的氧化还原反应只有两个 C、②中红色溶液中含有胶体 D、③中发生的氧化还原反应为16. 某些化学知识用数轴表示更形象直观、简明易记。下列用数轴表示不合理的是( )A
铁和稀硝酸反应

B
向烧碱溶液通入后的产物

C
Na与加热反应的产物

D
向溶液中逐滴滴加NaOH溶液,铝元素的存在形式
 A、A B、B C、C D、D17. 学习小组用废弃的铝制易拉罐按如下流程制备明矾,并测定明矾中结晶水的含量。
A、A B、B C、C D、D17. 学习小组用废弃的铝制易拉罐按如下流程制备明矾,并测定明矾中结晶水的含量。
上述实验中不需要用到的操作是
A、 B、
B、 C、
C、 D、
D、 18. 将含和的混合气体充入装有的密闭容器中点燃,反应结束后,容器温度为150℃,压强为0pa,将残留物溶于水无气体逸出。下列叙述正确的是( )A、原混合气体中和的体积比为2:1 B、原混合气体中和的体积比为1:2 C、残留固体中有和、NaOH D、残留固体中只有19. 1941年,我国科学家侯德榜结合地域条件改进索尔维制碱法,提出纯碱与铵肥的联合生产工艺,后被命名为“侯氏制碱法”。主要工艺流程如图。下列说法正确的是( )
18. 将含和的混合气体充入装有的密闭容器中点燃,反应结束后,容器温度为150℃,压强为0pa,将残留物溶于水无气体逸出。下列叙述正确的是( )A、原混合气体中和的体积比为2:1 B、原混合气体中和的体积比为1:2 C、残留固体中有和、NaOH D、残留固体中只有19. 1941年,我国科学家侯德榜结合地域条件改进索尔维制碱法,提出纯碱与铵肥的联合生产工艺,后被命名为“侯氏制碱法”。主要工艺流程如图。下列说法正确的是( )
已知:侯氏制碱法总反应:
索尔维制碱法总反应:(作为废液排放)
A、气体1、气体2均为 B、溶液2中,含碳微粒主要是 C、侯氏制碱法和索尔维制碱法中原料NaCl的原子利用率相同 D、盐析池中加入NaCl,增大,的平衡逆向移动,析出20. 某固体混合物可能由Al、、、、中的一种或几种组成,现对该混合物做如下实验,所得现象和有关数据如下图所示(气体体积数据已换算成标准状况下的体积),则关于该固体混合物,下列说法中正确的是( ) A、一定含、且物质的量相等 B、一定含有Al,其质量为4.05g C、一定不含 , 可能含有和 D、一定含有、和
A、一定含、且物质的量相等 B、一定含有Al,其质量为4.05g C、一定不含 , 可能含有和 D、一定含有、和三、填空题(每空2分,共50分)
-
21. 按要求正确书写方程式:(1)、过氧化钠与水反应的化学方程式:。(2)、泡沫灭火器灭火原理的离子方程式:。(3)、铝单质与氢氧化钠溶液反应的离子方程式:。(4)、将气体通入溶液中产生淡黄色沉淀的离子方程式:。(5)、四氧化三铁溶于足量氢碘酸溶液的离子方程式:。22. 以焙烧黄铁矿(杂质为石英等)产生的红渣为原料制备铵铁蓝颜料。工艺流程如下:

回答下列问题:
(1)、红渣的主要成分为(填化学式),滤渣①的主要成分为(填化学式)。(2)、黄铁矿研细的目的是。(3)、还原工序中,不生成S单质的反应的离子方程式为:。(4)、工序①的名称为、、过滤、洗涤,所得母液循环使用。(5)、沉铁工序产生的白色沉淀中Fe的化合价为 , 氧化工序发生反应的离子方程式为:。(6)、若用还原工序得到的滤液制备和 , 所加试剂为和。(填化学式,不引入杂质)23. 氧化镧在光学玻璃、陶瓷电容器、燃料电池等领域有广泛应用,工业上通常将沉淀剂加入氯化镧溶液得水合碳酸镧 , 经灼烧获得氧化镧产品。(1)、I.水合碳酸镧的制备已知:制备水合碳酸镧时,若溶液碱性太强会有碱式碳酸镧生成。
向氯化镧溶液中加入适量碳酸氢铵溶液,控制溶液pH为6.5~7,充分搅拌后陈化2h,洗涤数次,真空抽滤,得到水合碳酸镧。①制备时不宜用溶液代替溶液,其原因是。
②证明固体已洗涤干净的实验操作是。
(2)、某兴趣小组利用以下装置模拟制备水合碳酸镧。
仪器X的名称为;装置接口的连接顺序为af(填接口字母)。
24. 某锂离子二次电池的正极材料主要为 , 还含有少量Al、Fe、Mn、Ni的化合物。通过如下流程利用废旧锂离子电池制备草酸钴晶体: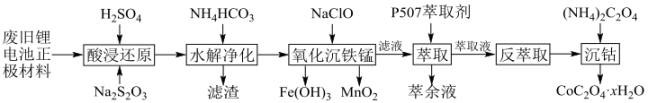
已知该工艺条件下,有关金属离子沉淀完全的pH见下表:
离子
pH
9.3
3.2
9.0
4.7
10.1
8.9
回答下列问题:
(1)、“酸浸还原”步骤,发生的反应中氧化产物为硫酸盐,则氧化剂与还原剂的物质的量之比为。(2)、“滤渣”成分是。“水解净化”时,温度不宜超过70℃,原因是。(3)、“氧化沉铁锰”中,反应生成的离子方程式为。(4)、利用“P507萃取剂”从“滤液”中分离。研究水相pH对金属离子分离的影响,所得结果如下图所示,其中分离因素越大,表明萃取剂对不同离子分离效果越好。
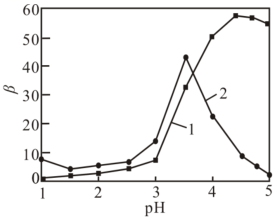
图1 水相pH对萃取率的影响 图2 水相pH对分离因素的影响
由图可知,萃取时的最佳水相pH为____(填字母)。
A、2.5 B、3.0 C、3.5 D、4.0(5)、“沉钴”适宜温度为50℃,温度过高会使沉淀率下降,可能的原因是。(6)、采用热重分析法测定草酸钴晶体样品所含结晶水数目,将样品加热到140℃时失掉1个结晶水,失重9.84%。中。