高中化学必修1单元分层测试:第四章 物质结构 元素周期律
试卷更新日期:2023-11-17 类型:单元试卷
一、选择题
-
1. 下列物质的变化,仅破坏范德华力的是( )A、碘单质的升华 B、溶于水 C、将液态水加热变为水蒸气 D、受热2. 中国先进研究堆是开展中子物理基础研究与应用、反应堆燃料与材料辐照性能研究,以及放射性同位素辐照研发的重要科学研究和实验应用平台。下列说法不正确的是( )A、中子位于原子核内部,不带电荷 B、与质子数相同、中子数不同 C、钠钾合金可用做反应堆的导热剂、工作时呈液态 D、某元素由放射性同位素转化为稳定同位素的过程,属于化学变化3. 据新华社报道,我国科学家首次合成了B一种新核素镅(Am),这种新核素同铀(U)比较,下列叙述正确的是( )A、具有相同的质子数 B、原子核中具有相同的中子数 C、具有相同的质量数 D、原子核外电子总数相同4. 部分含氯物质的分类与相应氯元素的化合价的关系如图所示。下列说法错误的是
 A、②和④都有漂白性,可使有色物质褪色 B、用化学方程式表示浓氨水检查输送②的管道是否漏气: C、用电子式表示⑤的形成过程:
A、②和④都有漂白性,可使有色物质褪色 B、用化学方程式表示浓氨水检查输送②的管道是否漏气: C、用电子式表示⑤的形成过程: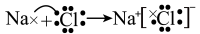 D、用离子方程式表示与①的浓溶液制备②:
5. 某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第1周期除外),八角星的每个顶角对应一种元素。为原子序数依次增大的五种短周期主族元素,基态原子核外电子占据3个能级且成对电子数是末成对电子数的3倍。下列说法错洖的是( )
D、用离子方程式表示与①的浓溶液制备②:
5. 某学者绘制了一种八角星元素周期表,每个八角星代表一个周期(第1周期除外),八角星的每个顶角对应一种元素。为原子序数依次增大的五种短周期主族元素,基态原子核外电子占据3个能级且成对电子数是末成对电子数的3倍。下列说法错洖的是( )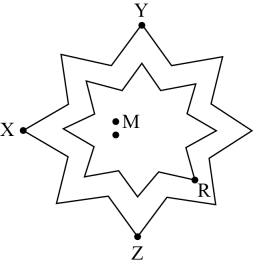 A、三种元素形成的化合物一定是离子化合物 B、分别与形成的最简单化合物的沸点: C、最高价氧化物的水化物之间均能两两反应 D、形成的两种常见化合物阴阳离子个数比均为
A、三种元素形成的化合物一定是离子化合物 B、分别与形成的最简单化合物的沸点: C、最高价氧化物的水化物之间均能两两反应 D、形成的两种常见化合物阴阳离子个数比均为二、多选题
-
6. 下列叙述中正确的是( )A、卤素单质与水反应均可用X2+H2O=HXO+HX表示 B、从F2到I2 , 卤素单质的颜色随着相对分子质量的增大而加深 C、熔、沸点:Li>Na>K D、还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠7. 某元素原子结构示意图为
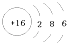 ,该原子( ) A、核电荷数为32 B、核外电子数为16 C、最外层电子数为6 D、核外电子层数为38. 某短周期元素原子的最外电子层只有2个电子,该元素可能是()A、0族元素 B、IIA族元素 C、第二周期元素 D、IVA族元素9. 下列有关叙述正确的是A、在BCl3分子中,所有原子都满足最外层8电子结构 B、核外电子排布完全相同的两种微粒,其化学性质一定相同 C、已知NaH是离子化合物,则其电子式是Na+[:H]- D、NaCl晶体中,每个Na+同时吸引6个Cl-
,该原子( ) A、核电荷数为32 B、核外电子数为16 C、最外层电子数为6 D、核外电子层数为38. 某短周期元素原子的最外电子层只有2个电子,该元素可能是()A、0族元素 B、IIA族元素 C、第二周期元素 D、IVA族元素9. 下列有关叙述正确的是A、在BCl3分子中,所有原子都满足最外层8电子结构 B、核外电子排布完全相同的两种微粒,其化学性质一定相同 C、已知NaH是离子化合物,则其电子式是Na+[:H]- D、NaCl晶体中,每个Na+同时吸引6个Cl-三、非选择题
-
10.(1)、碱金属元素原子最外层的电子都是个,在化学反应中它们容易失去个电子;卤族原子最外层的电子都是个,在化学反应中它们得到个电子。(2)、①钠有多种化合物,其中俗称“纯碱”的是(填“”或“”)
②铁有多种氧化物,其中为黑色且具有磁性的是(填“”或“”)。
③日常生活中,活泼的铝在空气中能稳定存在的原因是表层的铝在空气中反应生成了[填“”或“”],保护内层金属。
11. W、Q、X、Y、Z是原子序数依次增大的短周期主族元素,其最外层电子数之和为19,W只有一个电子层,Q与X、Y、Z位于不同周期,X、Y相邻,Y原子最外层电子数是Q原子内层电子数的2倍,仅由Z元素形成的固体在常温下为淡黄色。回答下列问题:(1)、Y在元素周期表中的位置为。(2)、最简单氢化物的沸点:Q(填“>”、“<”或“=”)Z。(3)、写出X元素形成的单质与Q的最高价氧化物对应的水化物的稀溶液发生反应的离子方程式:。(4)、仅由W、Q、Z三种元素可形成化合物和:①化合物的名称为 , 该化合物中Q元素的化合价为价。
②化合物含有化学键的类型为(填“离子键”、“共价键”或“离子键与共价键”)。
(5)、化合物与热水反应仅生成X的最高价氧化物对应的水化物和一种具有臭鸡蛋气味的气体,写出其化学方程式:。(6)、可用作火箭的燃料,1 mol 中所含的电子总数为。12. 某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2 . 该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2 , 该同学推测反应中可能生成了H2O2 , 并进行实验探究.(1)、写出Na2O2与水反应的化学方程式 .(2)、试设计实验证明溶液X中含过氧化氢 .(3)、通过上述实验证明溶液中确实存在H2O2 . 取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式: H2O2+Fe2++OH﹣﹣﹣ Fe(OH)3↓,该反应中H2O2表现了性(填“氧化”或“还原”).(4)、已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了性(填“氧化”或“还原”).13. 下表是元素周期表的一部分,①~⑦代表对应的元素,回答下列问题: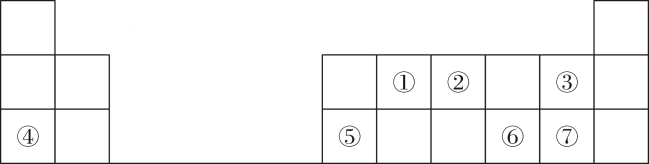 (1)、①的一种核素常用于文物考古,该核素的符号为(以形式表示)。(2)、⑥在元素周期表中的位置是第周期第族。(3)、③④⑦的简单离子半径由大到小的顺序为(填离子符号)。(4)、①②的最高价氧化物对应水化物酸性较强的是(填化学式,下同);③⑦的氢化物稳定性更高的是。(5)、⑤的单质与④的最高价氧化物对应水化物的溶液反应的离子方程式为。(6)、⑥的简单氢化物与⑦的单质反应的化学方程式为。14. 下表是元素周期表前20号元素的有关信息:
(1)、①的一种核素常用于文物考古,该核素的符号为(以形式表示)。(2)、⑥在元素周期表中的位置是第周期第族。(3)、③④⑦的简单离子半径由大到小的顺序为(填离子符号)。(4)、①②的最高价氧化物对应水化物酸性较强的是(填化学式,下同);③⑦的氢化物稳定性更高的是。(5)、⑤的单质与④的最高价氧化物对应水化物的溶液反应的离子方程式为。(6)、⑥的简单氢化物与⑦的单质反应的化学方程式为。14. 下表是元素周期表前20号元素的有关信息:元素
a
b
c
d
e
f
g
h
原子半径()
0.030
0.066
0.117
0.232
0.106
0.186
0.143
0.099
最高正化合价
最低负化合价
已知:的半径为 , 的半径为
回答下列问题:
(1)、元素e在周期表中的位置 , 元素y与e同主族且多一电子层,y的原子结构示意图为。(2)、c、d、g原子半径由大到小的顺序为(填元素符号)。(3)、f的单质与b的常见单质加热条件下反应,产物中含有的化学键类型为。(4)、 溶液中先加入d元素最高价氧化物对应的水化物,再通入 , 可观察到的现象是 , 发生反应的离子方程式为。