高中化学必修1单元分层测试:第三章 铁 金属材料B卷
试卷更新日期:2023-11-17 类型:单元试卷
一、选择题
-
1. 下列关于我国飞机所用的材料中,主要成分属于金属材料的是( )
 A、座椅滑轨——铝锂合金 B、轮胎——橡胶 C、尾翼主盒——碳纤维 D、风挡——玻璃2. 下列叙述I和II均正确并且有因果关系的是( )
A、座椅滑轨——铝锂合金 B、轮胎——橡胶 C、尾翼主盒——碳纤维 D、风挡——玻璃2. 下列叙述I和II均正确并且有因果关系的是( )选项
叙述I
叙述II
A
具有氧化性
用溶液可以鉴别
B
性质不稳定
可加热制备
C
具有氧化性
可用制作印刷电路板
D
是一种红棕色粉末
常用作油漆
A、A B、B C、C D、D3. 将43.8g Al、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为( )A、39.2g B、44.8g C、58.8g D、66.4g4. 某种磁铁矿样品中含 , , 其它不含铁的杂质15.0%,则该样品中铁的质量分数约为( )A、58.5% B、55.7% C、55.0% D、54.3%5. 取一定体积的两种试剂进行反应,改变两种试剂的滴加顺序(试剂浓度均为),反应现象没有明显差别的是选项
试剂①
试剂②
A
氨水
溶液
B
溶液
溶液
C
溶液
酸性溶液
D
溶液
溶液
A、A B、B C、C D、D6. 某同学用KSCN溶液和FeCl2溶液探究Fe2+的还原性时出现异常现象,实验如下:①
②
③



溶液变红,大约10秒左右红色褪去,有气体生成(经检验为O2)。取褪色后溶液,滴加盐酸和BaCl2溶液,产生白色沉淀
溶液变红且不褪色,有气体生成(经检验为O2),经检验有丁达尔效应。
溶液变红且不褪色,滴加盐酸和BaCl2溶液,无白色沉淀,经检验无丁达尔效应。
下列说法错误的是( )
A、②中红色溶液中含有Fe(OH)3胶体 B、实验②中发生的氧化还原反应只有两种 C、对比①②③,可以判定酸性条件下H2O2可以氧化SCN- D、③中发生的氧化还原反应为:4Fe2++O2+4H+=4Fe3++2H2O7. 向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液。下列图象中能符合题意表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )A、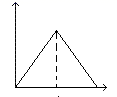 B、
B、 C、
C、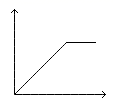 D、
D、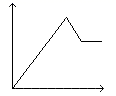 8. 已知还原性。向一定体积的和混合溶液中通入氯气,测得溶液中离子的物质的量随氯气体积的变化曲线如图所示(e和g点横坐标分别为2.5和4.5)。下列说法正确的是 ( )
8. 已知还原性。向一定体积的和混合溶液中通入氯气,测得溶液中离子的物质的量随氯气体积的变化曲线如图所示(e和g点横坐标分别为2.5和4.5)。下列说法正确的是 ( )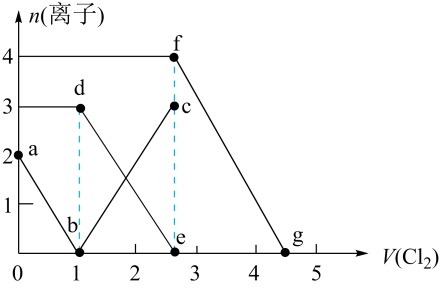 A、ab段表示物质的量的变化情况 B、原溶液中和的物质的量分别为、 C、fg段发生反应: D、反应能发生
A、ab段表示物质的量的变化情况 B、原溶液中和的物质的量分别为、 C、fg段发生反应: D、反应能发生二、多选题
-
9. 某同学将钾投入溶液中,待其充分反应。下列叙述错误的是( )A、反应后的溶液中的数目约为 B、充分反应后有白色沉淀生成 C、生成标准状况下 D、反应后的溶液中,溶质只有10. 在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是( )A、0.5molNa和0.5molMg B、0.1molZn和0.1molAl C、8.4gMgCO3和8.4gNaHCO3 D、10gCaCO3和10gMgCO311. 利用废旧镀锌铁皮制备胶体粒子的流程如图。
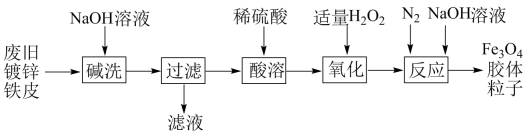
已知:Zn溶于强碱时生成可溶于水的
下列有关说法不正确的是( )
A、是一种复杂的化合物,是具有磁性的黑色晶体 B、滤液中主要存在的离子有、、 C、“酸溶”的离子方程式为: D、“氧化”的目的是将全部氧化为三、非选择题
-
12. 钠、铝和铁是中学化学常见的三种重要金属。请回答下列问题:(1)、钠在空气中燃烧生成淡黄色的(填“Na2O”或“Na2O2”); Al2O3能溶于酸或强碱溶液生成盐和水,则是一种(填“酸性”、“碱性”或“两性”)氧化物;(2)、写出钠与水反应的化学方程式:。(3)、写出铝与NaOH溶液反应的化学方程式:;(4)、现有下列3种物质:①Na2O2、②NaHCO3、③Na2CO3 , 请回答:受热易分解的是 (填序号,下同),溶于水显碱性的是 , 与CO2反应产生的气体能使带火星木条复燃的是。13. 某工厂的酸性废水中主要含有、等离子,为了减少污染并变废为宝,工程师设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。
 (1)、酸性废水中加入铁粉后,发生反应的离子方程式是:、、。(2)、操作1是。(3)、试剂甲是。(4)、检验溶液B中是否除尽的实验方法是。(5)、获得的需密闭保存,原因是。(6)、绿矾可消除某种酸性工业废水中价铬()的污染,使之转化为毒性较小的 , 该反应的离子方程式是。14. 某同学按下表操作,当物质充分反应后,最终发现仅有一个烧杯中有固体剩余。
(1)、酸性废水中加入铁粉后,发生反应的离子方程式是:、、。(2)、操作1是。(3)、试剂甲是。(4)、检验溶液B中是否除尽的实验方法是。(5)、获得的需密闭保存,原因是。(6)、绿矾可消除某种酸性工业废水中价铬()的污染,使之转化为毒性较小的 , 该反应的离子方程式是。14. 某同学按下表操作,当物质充分反应后,最终发现仅有一个烧杯中有固体剩余。烧杯编号
①
②
③
盛装的液体
稀硫酸
稀硫酸
稀硫酸
加入的固体(质量相等)
粒
粉
片
(1)、有固体剩余的是(填编号),固体的质量m满足的范围是;(2)、当产生量满足①>③>②时,固体的质量m满足的范围是;此时将反应后中①的溶液逐滴加入到②的溶液中并放置一段时间,整个过程中可以观察到的现象有。(3)、将③中的溶液过滤,向滤液中滴加的溶液,得到沉淀,则加入的溶液的体积为。15. 物质可根据其组成和性质进行分类: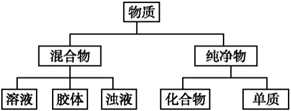 (1)、如图所示的物质分类方法名称是。(2)、人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内。当胃酸过多时就会出现“吐酸水”“烧心”“胃部隐隐作痛”等症状。目前市场上的抗酸药主要有:①吸收性抗酸药,如NaHCO3等;②非吸收性抗酸药,如CaCO3、MgO等。
(1)、如图所示的物质分类方法名称是。(2)、人体胃液中含有胃酸(0.2%~0.4%的盐酸),起杀菌、帮助消化等作用,但胃酸的量不能过多或过少,它必须控制在一定范围内。当胃酸过多时就会出现“吐酸水”“烧心”“胃部隐隐作痛”等症状。目前市场上的抗酸药主要有:①吸收性抗酸药,如NaHCO3等;②非吸收性抗酸药,如CaCO3、MgO等。①将上述所举抗酸药填入表对应类别,属于盐的有 , 属于氧化物的有。
②写出CaCO3与胃酸反应的化学方程式:。
(3)、写出制备氢氧化铁胶体的化学方程式: , 胶体和溶液的本质区别是。16. 某校研究性学习小组用一些大部分已经锈蚀(成分为 Fe2O3)的废铁屑制备绿矾(FeSO4·7H2O),实验操作过程如下:
已知:杂质不溶于稀硫酸。
请回答下列问题:
(1)、步骤①中,稀硫酸与 Fe2O3反应的离子方程式为 , 废铁屑用硫酸处理后,还含有不溶性杂质,为获取澄清的A溶液,需进行的操作名称是。(2)、步骤②中溶液A与铁粉反应的离子方程式为。(3)、检验溶液 B 中是否还存在杂质金属阳离子的方法是。17. 过去电子工业常用30%的FeCl3溶液腐蚀覆有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为3FeCl3+Cu=2FeCl2+CuCl2。(1)、检验腐蚀后的溶液中含有Fe3+应选用的试剂是 , 上述反应说明Fe3+、Cu2+氧化性的强弱关系为。(2)、采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液的流程如图所示。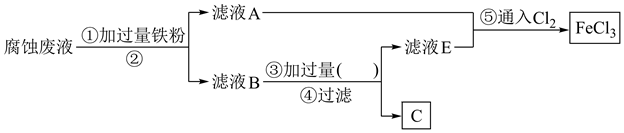
①滤液A中主要含有(填化学式,下同),滤渣B主要为。
②流程图中②的操作名称为 , ③处加过量的(填名称)。
③写出步骤⑤中反应的离子方程式:。
18. 铁是人类迄今为止人类冶炼和使用最多的金属。铁在人们的生产生活,乃至于国防、现代化建设中均发挥着极其重要的作用。(1)、“秦砖汉瓦”是我国传统建筑文化的一个缩影。同是由含铁元素的黏土烧制,但经过不同的工艺烧制,有的是黑色的,有的却是红色的,分析其原因可能是。(2)、某补铁剂的主要成分是硫酸亚铁,请回答下列有关问题。①补铁剂药片外层有糖衣包裹,糖衣的作用是。
②补铁剂中常添加维生素C,其作用之一是防止被氧化,由此推测维生素C具有性。
③若该补铁剂已经氧化变质,将其溶于水并滴加KSCN试剂会观察到。
(3)、某研究小组配制FeSO4溶液时,为了防止被氧化,需向溶液中加入少量的 , 其原理是(用离子方程式表示)。(4)、为了进一步制备氢氧化亚铁沉淀,向新配制的FeSO4溶液中滴加NaOH溶液。并放置了一段时间,观察到的现象是 , Fe(OH)2被氧化的化学方程式为。(5)、小组成员改良了方法制得白色的Fe(OH)2沉淀并使之较长时间保存,实验装置如下: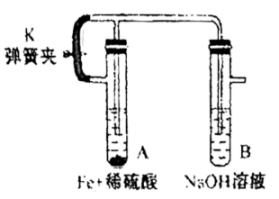
根据你的理解,请写出补全以下实验步骤。
①装配好试剂和装置后打开止水夹,使得A试管中反应产生的H:排净该装置中的空气(氧气)
② , 以确定空气已经被排尽。
③ , 制备得到Fe(OH)2。
(6)、已知还原性 , 向含有1molFeI2和1molFeBr2的溶液中通入的2.5molCl2。①被氧化的离子依次为:。
②对应的被氧化的离子的物质的量分别是:。
③对应氧化产物的物质的量分别是:。
19. 某实验小组同学用KSCN探究久置 固体变质的情况。将0.3 g 固体用10mL蒸馏水溶解,配成待测液,进行实验。(1)、(初步实验)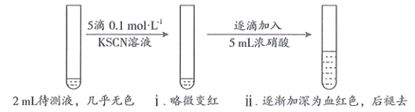
用KSCN检验 的原理是(用离子方程式表示)。
(2)、甲同学认为 固体几乎未变质,ⅱ中变血红色是由于 被氧化,反应的离子方程式为;ⅱ中血红色褪去的可能原因是。(3)、乙同学不认同甲对现象的解释,他推测加入浓硝酸后ⅱ中变血红色还可能与其它因素有关,可能的影响因素是。(4)、(继续探究)步骤
操作
现象
Ⅰ
取2mL待测液,加入5滴0.1 KSCN溶液,再加入5mL浓 溶液
溶液颜色无明显变化
Ⅱ
取2mL待测液,
溶液变为红色
Ⅲ
向Ⅱ中所得溶液中逐滴加入5mL浓硝酸,边加边振荡
溶液逐渐加深为血红色,继续滴加浓硝酸,溶液褪色,pH变化始终不明显
(5)、请补全步骤Ⅱ中的操作:。(6)、由Ⅰ~Ⅲ推测 固体变质的情况是(填字母序号),理由是。a.几乎未变质 b.部分变质 c.完全变质
(7)、(反思与迁移)从上述探究中获得启发,在用KSCN检验 及进行 还原性验证实验时,需要注意的事项有(至少2条)。