高中化学必修1单元分层测试:第三章 铁 金属材料A卷
试卷更新日期:2023-11-17 类型:单元试卷
一、选择题
-
1. 中华文化源远流长、博大精深,陕西历史博物馆馆藏文物是中华文化的重要代表。下列物品主要是由金属材料制成的是
A.白瓷马蹬壶
B.东汉青铜奔马
C.液晶显示屏
D.西夏文佛经纸本



 A、A B、B C、C D、D2. 纯铁实际使用范围有限,钢和生铁都是主要含铁的合金。以下说法正确的是( )A、钢是铁合金,只含有金属元素 B、生铁和钢都是碳铁合金 C、生铁更具韧性,而钢更脆 D、它们的熔点都比纯铁高3. 含铁物质或微粒所带电荷数与化合价的关系如图所示,下列说法不正确的是( )
A、A B、B C、C D、D2. 纯铁实际使用范围有限,钢和生铁都是主要含铁的合金。以下说法正确的是( )A、钢是铁合金,只含有金属元素 B、生铁和钢都是碳铁合金 C、生铁更具韧性,而钢更脆 D、它们的熔点都比纯铁高3. 含铁物质或微粒所带电荷数与化合价的关系如图所示,下列说法不正确的是( ) A、若M为氢氧化物,则制备M所用的溶液需先煮沸 B、常温下,可以用R制的容器盛装浓硝酸 C、可用KSCN溶液检验N D、Fe3+与强氧化剂在碱性条件下可反应生成FeO42-4. 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是( )
A、若M为氢氧化物,则制备M所用的溶液需先煮沸 B、常温下,可以用R制的容器盛装浓硝酸 C、可用KSCN溶液检验N D、Fe3+与强氧化剂在碱性条件下可反应生成FeO42-4. 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是( ) A、新制氯水滴加到pH试纸及淀粉-KI溶液孔穴,发生的现象都体现了新制氯气的漂白性 B、生锈铁屑加入过量稀硫酸反应后,若加入溶液后,溶液褪色,说明该溶液中有存在 C、固体中滴加溶液后最终为白色沉淀 D、生锈铁屑加入足量稀硫酸后,若加入KSCN溶液,溶液一定变血红色5. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、6. 下列说法中正确的是( )
A、新制氯水滴加到pH试纸及淀粉-KI溶液孔穴,发生的现象都体现了新制氯气的漂白性 B、生锈铁屑加入过量稀硫酸反应后,若加入溶液后,溶液褪色,说明该溶液中有存在 C、固体中滴加溶液后最终为白色沉淀 D、生锈铁屑加入足量稀硫酸后,若加入KSCN溶液,溶液一定变血红色5. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、6. 下列说法中正确的是( )①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖和硫酸钡均属于电解质
④盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1~100nm
A、5个 B、4个 C、3个 D、2个7. 向100mLFe2(SO4)3和CuSO4的混合溶液中逐渐加入铁粉,充分反应后溶液中固体剩余物的质量与加入铁粉的质量如图所示(忽略溶液体积的变化)。下列说法正确的是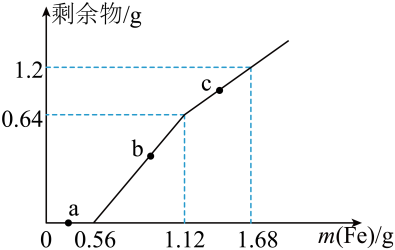 A、a点时溶液中阳离子只有Cu2+、Fe2+ B、b点时溶液中发生的反应为Fe+2Fe3+=3Fe2+ C、c点时溶液中溶质的物质的量浓度为0.4mol∙L-1 D、原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为2∶1
A、a点时溶液中阳离子只有Cu2+、Fe2+ B、b点时溶液中发生的反应为Fe+2Fe3+=3Fe2+ C、c点时溶液中溶质的物质的量浓度为0.4mol∙L-1 D、原溶液中Fe2(SO4)3和CuSO4的物质的量浓度之比为2∶1二、多选题
-
8. 某学生探究小组将 FeCl3溶液腐蚀铜箔制作电路板后的酸性废液“再生”,同时回收铜,实验流程如下:
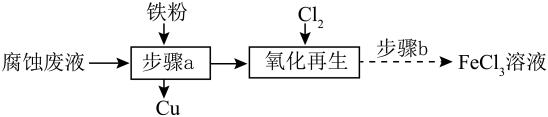
“腐蚀废液”中除Fe外,一定存在的金属离子还有( )
A、Fe B、Ag C、Na D、Cu9. 工业中有着广泛的应用。近年来,我国科学家在分子筛研究领域不断取得新的突破。这些研究中涉及的部分元素在周期表中位置如下:周期
族
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
1
H
2
C
N
O
3
Na
Al
Si
4
K
Ca
分子筛中含有O和Al结合而成的Al2O3可以和下面的哪些物质反应?( )
A、水 B、稀硫酸 C、氢氧化钠溶液 D、氯化钠溶液10. 下列实验操作、现象与对应结论均正确的是( )选项
操作
现象
结论
A
向某溶液中滴加几滴KSCN溶液
溶液变红
溶液中不可能含Fe2+
B
将铝箔置于火焰上灼烧
铝箔胀大并有熔融物滴落
铝箔灼烧生成氧化铝
C
将几滴饱和FeCl3溶液滴入一烧杯的沸水中,继续煮沸至溶液呈红褐色,停止加热
用激光笔照射烧杯中的液体,看到一条光亮的“通路”
生成了Fe(OH)3胶体
D
向新制氯水中滴加几滴紫色石蕊试液
溶液先变红后褪色
新制氯水具有酸性和强氧化性
A、A B、B C、C D、D三、非选择题
-
11. 如图所示是铁及其化合物的价类二维图。回答下列问题:
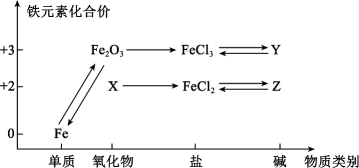 (1)、X的化学式为 , 生铁在潮湿空气中主要发生(填“析氢”或“吸氧”)腐蚀。(2)、工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是(填标号)。
(1)、X的化学式为 , 生铁在潮湿空气中主要发生(填“析氢”或“吸氧”)腐蚀。(2)、工业上用赤铁矿(Fe2O3)冶炼Fe常用的方法是(填标号)。a.电解法 b.热还原法 c.热分解法 d.物理方法
(3)、检验FeCl3和FeCl2混合溶液中Fe2+的操作是;除去FeCl2溶液中的少量FeCl3加入的最佳试剂为。(4)、Z在空气中很容易变成Y,该反应的化学方程式为。(5)、FeCl3和KI在水溶液中转化的离子反应有:2Fe3++2I-2Fe2++I2 , 为了探究该反应存在一定的限度,某化学兴趣小组取10mL0.5mol·L-1的KI溶液于试管中,再加入10mL0.2mol·L-1的FeCl3溶液,振荡,使试管中的物质充分反应一段时间。为了达到实验目的,还需要再向试管中加入下列试剂中的____(填标号)。A、淀粉溶液 B、KSCN溶液 C、硝酸银溶液 D、酸性高锰酸钾溶液12. 计算(1)、标准状况下,甲烷和一氧化碳的混合气体共 , 其质量为 , 则混合气体中甲烷的物质的量为 。(2)、测定样品含氯化钠杂质中的质量分数:称取样品放入烧杯内加水溶解,加入过量的氯化钙溶液充分反应,过滤、洗涤、干燥,称量沉淀的质量为。则样品中的质量分数为。(3)、中含有 , 则的相对原子质量为。(4)、标准状况下,氯气通入足量溶液中,转移的电子数目为。13. 将3.84g铜粉与600mL浓硝酸反应(忽略体积变化),当铜完全溶解时,收集到NO、NO2混合气体2.24L(标准状况下),试计算:(1)、反应后溶液中铜离子浓度为mol/L;(2)、反应所消耗硝酸的物质的量是mol;(3)、生成的NO与NO2体积比为。14. 铁是人类较早使用的金属之一,运用所学知识,回答下列问题。(1)、Fe(OH)2很不稳定,露置在空气中容易被氧化,该反应的化学方程式为 , 现象为。(2)、为了获得白色的Fe(OH)2沉淀,在用硫酸亚铁晶体配置硫酸亚铁溶液时,往往会加入 , 目的是。(3)、Fe3+比 Fe2+稳定,请写出 Fe3+的检验过程和现象 , 涉及反应的离子方程式是。(4)、野外铺设钢轨时,通常用铝和氧化铁混合粉末反应得到的液态铁来焊接钢轨。写出反应的化学方程式 , 该反应是(吸或放)热反应,其中铝发生(氧化或还原)反应。15.(1)、Ⅰ.盐酸是HCl气体的水溶液。回答下列问题。现有气体,其质量是 , 在标况下的体积是 , 所含HCl分子的数目是 , 若将这气体完全溶于水配成溶液,所得盐酸的物质的量浓度为。
(2)、Ⅱ. 用固体配制溶液,请回答下列问题。用到的仪器有:托盘天平、药匙、量筒、烧杯、玻璃棒、胶头滴管和。
(3)、用托盘天平称取固体的质量是g。(4)、下列主要操作步骤的正确顺序是(填序号)。①称取一定质量的固体,放入烧杯中,用适量蒸馏水稀释;
②向容量瓶中加水至液面离容量瓶刻度线下 , 改用胶头滴管向容量瓶中加入蒸馏水至凹液面与刻度线相切;
③将溶液转移到容量瓶中;
④盖好瓶塞,反复翻转,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中。
(5)、下列情况中,会使所配溶液浓度偏低的是____(填字母)。A、使用前容量瓶中有残留水 B、没有洗涤烧杯和玻璃棒 C、定容时加蒸馏水超过了刻度线立即将多余的液体吸出16. 某学习小组为认识铁及其化合物的性质、分散系的性质做了如下一组综合实验,根据实验流程回答相关问题: (1)、请写出与①反应的离子方程式。(2)、请写出与铁粉反应的化学方程式。(3)、向溶液中滴加NaOH溶液最终生成浊液,该过程的现象为 , 此过程中发生的氧化还原反应为(用化学方程式表达)。(4)、将饱和溶液滴入沸水中,并继续煮沸至红褐色,此过程中发生的化学反应为(用化学方程式表达)。(5)、溶液能使酸性高锰酸钾溶液褪色,生成二价锰离子,此过程中发生的化学反应为(用离子方程式表达)。17.(1)、Ⅰ、某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
(1)、请写出与①反应的离子方程式。(2)、请写出与铁粉反应的化学方程式。(3)、向溶液中滴加NaOH溶液最终生成浊液,该过程的现象为 , 此过程中发生的氧化还原反应为(用化学方程式表达)。(4)、将饱和溶液滴入沸水中,并继续煮沸至红褐色,此过程中发生的化学反应为(用化学方程式表达)。(5)、溶液能使酸性高锰酸钾溶液褪色,生成二价锰离子,此过程中发生的化学反应为(用离子方程式表达)。17.(1)、Ⅰ、某研究性学习小组为了制取、收集纯净干燥的氯气并探究氯气的性质,他们设计了如图所示的实验装置:
请回答下列问题:
整套实验装置的连接顺序是(各接口处的字母代号);(2)、E装置中制取氯气的离子方程式是。(3)、A装置中试剂X是。B装置中试剂Y是 , 其作用是;(4)、C装置中可观察到的现象是。(5)、Ⅱ、如下图所示,此装置可用来制取和观察在空气中被氧化的颜色变化。实验时必须使用铁屑和的硫酸,其他试剂任选。填写下列空白:
B中盛有一定量的溶液,A中应预先加入的固体药品是 , A中反应的离子方程式是。 (6)、实验开始时先将止水夹a(填“打开”或“关闭”),其目的是。(7)、简述生成的操作过程。(8)、实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中观察到的现象是 , 发生的反应为。(用方程式表示)18. 某班同学用如下实验探究、性质。回答下列问题:(1)、分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制溶液时需加入少量铁屑,其目的是。(2)、甲组同学取2mL溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明可将氧化。溶液与氯水反应的离子方程式为。(3)、乙组同学认为甲组的实验不够严谨,该组同学在2mL溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是。(4)、丁组同学为了探究与Cu的反应,做了如图所示实验:
(6)、实验开始时先将止水夹a(填“打开”或“关闭”),其目的是。(7)、简述生成的操作过程。(8)、实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中观察到的现象是 , 发生的反应为。(用方程式表示)18. 某班同学用如下实验探究、性质。回答下列问题:(1)、分别取一定量硫酸铁、硫酸亚铁固体,均配制成100mL0.1mol/L的溶液。在配制溶液时需加入少量铁屑,其目的是。(2)、甲组同学取2mL溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明可将氧化。溶液与氯水反应的离子方程式为。(3)、乙组同学认为甲组的实验不够严谨,该组同学在2mL溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是。(4)、丁组同学为了探究与Cu的反应,做了如图所示实验:
①与Cu反应的离子方程式为。
②为了探究白色沉淀产生的原因,同学们查阅资料得知:
ⅰ.CuSCN是难溶于水的白色固体;ⅱ.SCN的化学性质与相似;ⅲ.
填写实验方案:
实验方案
现象
步骤1:取4mL0.2mol/L的溶液,向其中滴加3滴0.1mol/L的KSCN溶液。
无明显现象
步骤2:取4mL_▲_mol/L的溶液,向其中滴加3滴0.1mol/L的KSCN溶液。
产生白色沉淀
步骤2中的溶液的浓度是mol/L,与反应的离子方程式为。