浙江省宁波市余姚市六校2023-2024学年九年级第一学期科学第一次联考试卷
试卷更新日期:2023-11-13 类型:月考试卷
一、选择题(每题只有一个正确答案,每题3分,共60分)
-
1. 下列属于化学变化的是( )A、铁生锈 B、浓盐酸挥发 C、海水晒盐 D、氢氧化钠固体潮解2. 科学家发现,苍蛹排斥碱性强的食物。下列食物最不容易吸引苍蝇的是( )
 A、苹果 B、蚕豆 C、莴苣 D、茶叶蛋3. 下列操作正确的是( )A、干燥氧气
A、苹果 B、蚕豆 C、莴苣 D、茶叶蛋3. 下列操作正确的是( )A、干燥氧气 B、稀释浓硫酸
B、稀释浓硫酸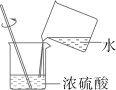 C、pH试纸测酸碱性
C、pH试纸测酸碱性 D、锌粒放入试管中
D、锌粒放入试管中 4. 目前,中国制造的“国产大飞机”,其机身使用了钛合金等多种特殊材料。关于金属“钛”,下列说法错误的是( )A、钛合金是金属钛和其他金属(或非金属)经高温熔合而成的物质,是一种化合物 B、钛合金能承受剧烈的温差考验,可使战斗机在不同温度大气层高速飞行 C、金属钛密度高于铝低于铁、铜等金属,可减少战斗机的自重 D、金属钛在各领域中的应用越来越广泛,可能跃居为除铁和铝之外的“第三金属”5. 推理是科学学习中常用的思维方法。下列推理正确的是( )A、中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应 B、单质是由一种元素组成的纯净物,所以由一种元素组成的纯净物一定是单质 C、置换反应生成单质和化合物,所以生成单质和化合物的反应一定是置换反应 D、燃烧都伴随着发光、放热现象,所以有发光、放热现象的一定是燃烧6. 端午插艾。艾草中含有丰富的黄酮类物质,其中矢车菊黄素的化学式为(C18H16O8)。下列关于(C18H16O8)的说法不正确的是( )A、矢车菊黄素不是氧化物 B、矢车菊黄素是由碳原子、氢原子、氧原子构成 C、碳元素的质量分数最大 D、氢、氧元素的质量比为1:87. 下列各组气体中均混有水蒸气,其中可以用固体氢氧化钠干燥的是( )A、CO、H2、HCl B、SO2、CO2、HCl C、H2、O2、N2 D、SO2、H2、CO8. 下列各组物质分别加入足量的水中,能得到无色透明溶液的是( )A、FeCl3、NaOH、NaCl B、AgNO3、NaCl、HCl C、CuSO4、NaCl、HCl D、HCl、NaCl、H2SO49. 光亮的铁钉在下列几种情况下,最不容易生锈的是( )A、
4. 目前,中国制造的“国产大飞机”,其机身使用了钛合金等多种特殊材料。关于金属“钛”,下列说法错误的是( )A、钛合金是金属钛和其他金属(或非金属)经高温熔合而成的物质,是一种化合物 B、钛合金能承受剧烈的温差考验,可使战斗机在不同温度大气层高速飞行 C、金属钛密度高于铝低于铁、铜等金属,可减少战斗机的自重 D、金属钛在各领域中的应用越来越广泛,可能跃居为除铁和铝之外的“第三金属”5. 推理是科学学习中常用的思维方法。下列推理正确的是( )A、中和反应有盐和水生成,所以有盐和水生成的反应一定是中和反应 B、单质是由一种元素组成的纯净物,所以由一种元素组成的纯净物一定是单质 C、置换反应生成单质和化合物,所以生成单质和化合物的反应一定是置换反应 D、燃烧都伴随着发光、放热现象,所以有发光、放热现象的一定是燃烧6. 端午插艾。艾草中含有丰富的黄酮类物质,其中矢车菊黄素的化学式为(C18H16O8)。下列关于(C18H16O8)的说法不正确的是( )A、矢车菊黄素不是氧化物 B、矢车菊黄素是由碳原子、氢原子、氧原子构成 C、碳元素的质量分数最大 D、氢、氧元素的质量比为1:87. 下列各组气体中均混有水蒸气,其中可以用固体氢氧化钠干燥的是( )A、CO、H2、HCl B、SO2、CO2、HCl C、H2、O2、N2 D、SO2、H2、CO8. 下列各组物质分别加入足量的水中,能得到无色透明溶液的是( )A、FeCl3、NaOH、NaCl B、AgNO3、NaCl、HCl C、CuSO4、NaCl、HCl D、HCl、NaCl、H2SO49. 光亮的铁钉在下列几种情况下,最不容易生锈的是( )A、 B、
B、 C、
C、 D、
D、 10. 下列现象描述以及对现象的解释叙述不正确的是( )A、浓盐酸敞口放置质量会变小,因为浓盐酸易挥发 B、浓硫酸敞口放置质量会变小,因为浓硫酸具有脱水性 C、固态氢氧化钠可以做氧气的干燥剂,因为它具有潮解吸水的性质 D、盛石灰水的试剂瓶存放时间久了内壁会附有白膜,因为氢氧化钙会与二氧化碳反应11. 分离与提纯是获得物质的重要方法。下列实验操作能达到实验目的的是( )
10. 下列现象描述以及对现象的解释叙述不正确的是( )A、浓盐酸敞口放置质量会变小,因为浓盐酸易挥发 B、浓硫酸敞口放置质量会变小,因为浓硫酸具有脱水性 C、固态氢氧化钠可以做氧气的干燥剂,因为它具有潮解吸水的性质 D、盛石灰水的试剂瓶存放时间久了内壁会附有白膜,因为氢氧化钙会与二氧化碳反应11. 分离与提纯是获得物质的重要方法。下列实验操作能达到实验目的的是( )选项
实验目的
实验操作
A
除去氮气中的氧气
将气体缓缓通过红热的木炭粉
B
除去碳酸钠溶液中的少量氯化钠
加入足量稀盐酸
C
除去氯化钙溶液中的少量盐酸
加入过量的氢氧化钙溶液
D
除去铜粉中的少量氧化铜
加入足量稀硫酸,过滤、洗涤、干燥
A、A B、B C、C D、D12. 欲把Ba(NO3)2、AgNO3、Na2CO3三种无色溶液区分开来,可选用( )A、盐酸 B、硝酸 C、氢氧化钠 D、石蕊试液13. 四种制取氧气的方法如图所示。下列有关四种氧气制取方法的说法,错误的是( )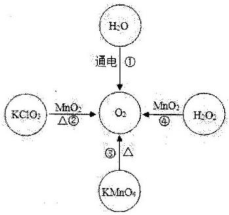 A、四种方法都是利用含氧化合物来制取О2 B、四种反应的生成物都不止一种 C、反应时加入的MnO2能增加产生氧气的质量 D、从安全、环保、节能、简便等方面考虑,最佳方法是H2O2分解制取O214. 如图所示是一个化学反应的微观模型图,其中“
A、四种方法都是利用含氧化合物来制取О2 B、四种反应的生成物都不止一种 C、反应时加入的MnO2能增加产生氧气的质量 D、从安全、环保、节能、简便等方面考虑,最佳方法是H2O2分解制取O214. 如图所示是一个化学反应的微观模型图,其中“ ”和“
”和“ ”分别表示两种原子,甲、乙分别表示反应前和反应后的物质,下列说法中错误的是( )
”分别表示两种原子,甲、乙分别表示反应前和反应后的物质,下列说法中错误的是( ) A、该反应遵守质量守恒定律 B、该反应可能为水的电解 C、参加反应的两种分子个数之比为2:3 D、该反应属于分解反应15. 向Zn(NO3)2和Cu(NO3)2混合溶液中加入一定量的铁粉,充分反应后,过滤。向滤渣中再加入稀盐酸,有气体放出。下列说法正确的是( )A、滤渣中一定有锌 B、滤渣中一定有铜 C、所得溶液中一定有Zn2+、Cu2+ D、所得溶液中一定有Cu2+、Fe2+16. 某校科学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )
A、该反应遵守质量守恒定律 B、该反应可能为水的电解 C、参加反应的两种分子个数之比为2:3 D、该反应属于分解反应15. 向Zn(NO3)2和Cu(NO3)2混合溶液中加入一定量的铁粉,充分反应后,过滤。向滤渣中再加入稀盐酸,有气体放出。下列说法正确的是( )A、滤渣中一定有锌 B、滤渣中一定有铜 C、所得溶液中一定有Zn2+、Cu2+ D、所得溶液中一定有Cu2+、Fe2+16. 某校科学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( ) A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中 D、由b点到c点的变化过程中没有发生化学反应17. 稀盐酸、稀硫酸以及其他的酸溶液中都含有氢离子,所以它们具有相似的化学性质,这就是酸的通性。为了验证酸的通性小明进行了以下实验,下列说法正确的是( )
A、图中c点所示溶液呈碱性 B、图中a点所示溶液中,含有的溶质是K2SO4和H2SO4 C、该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸的烧杯中 D、由b点到c点的变化过程中没有发生化学反应17. 稀盐酸、稀硫酸以及其他的酸溶液中都含有氢离子,所以它们具有相似的化学性质,这就是酸的通性。为了验证酸的通性小明进行了以下实验,下列说法正确的是( ) A、试管①无明显现象 B、试管②能验证酸的通性 C、将试管③中的铁粉换成铜粉也能验证酸的通性 D、试管④中的溶液变红18. 在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )
A、试管①无明显现象 B、试管②能验证酸的通性 C、将试管③中的铁粉换成铜粉也能验证酸的通性 D、试管④中的溶液变红18. 在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )物质
甲
乙
丙
丁
反应前质量/g
10
0.3
4.8
2.8
反应后质量/g
3.2
待测
8
6.4
A、待测值为0.6 B、此反应可表示为:丙+丁→甲 C、反应中甲和丁变化的质量比为1:2 D、甲一定是化合物19. 下列关于科学实验中“操作—现象—结论”的描述不正确的是( )选项
操作
现象
结论
A
在某固体物质中加入稀盐酸
产生大量气泡
该物质可能是碳酸盐
B
某溶液中加入硝酸钡和稀硝酸
产生白色沉淀
该溶液中一定含有SO42-
C
将某溶液滴在plH试纸上
pH值>7
该溶液一定是碱性溶液
D
浓硫酸、生石灰、固体氢氧化钠长期暴露在空气中
质量增加
都发生了变质
A、A B、B C、C D、D20. 在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系,能用如图曲线表示的是( )
选项
甲
乙
A
HCl溶液
NaOH溶液
B
HCl溶液
大理石
C
BaCl2溶液
Na2CO3溶液
D
CuSO4溶液
铁粉
A、A B、B C、C D、D二、填空题(每空2分,共34分)
-
21. 将一根表面生锈的铁钉放入稀硫酸中,可观察到铁钉表面的铁锈逐渐溶解,溶液变为色,该反应的化学方程式为 , 如果稀硫酸足量,将会观察到铁钉表面有气泡产生,这是由于(用化学方程式表示),该反应的基本类型是反应。22. “价类图”是以化合价为纵坐标、物质类别为横坐标绘制的图像,它能将散乱的科学知识联系在一起,有助于对科学问题的理解和整体认知。如图所示为含氯元素的物质的价类图,其中“→”表示物质间的转化关系。请回答:
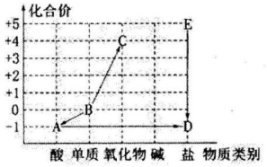 (1)、A和氢氧化钾反应生成D和水,则该反应属于基本反应类型中的反应。(2)、物质C的化学式为。(3)、E在一定条件下生成D的化学方程式为。23. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小科将少量样品配制成溶液,取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验
(1)、A和氢氧化钾反应生成D和水,则该反应属于基本反应类型中的反应。(2)、物质C的化学式为。(3)、E在一定条件下生成D的化学方程式为。23. 为探究一瓶久置的氢氧化钠固体样品是否全部变质,小科将少量样品配制成溶液,取少量溶液分别装入两支试管中,进行了如甲、乙两图所示实验 (1)、由甲图实验现象可以得出溶液呈性。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(选填“不变质、部分变质、完全变质”)(3)、图乙中,滴加足量的BaCl2溶液的目的是。24. 金属及金属材料在生产、生活中有广泛的应用。(1)、下列金属制品中,利用金属导热性的是____(填字母)。A、金属硬币 B、铝制导线 C、铜制火锅(2)、近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。建造高铁使用了大量铁合金,构成金属铁的粒子是(填“分子”“原子”或“离子”)。(3)、铝合金中主要含铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了以下3个实验:甲实验能得出的结论是铝的金属活动性更强,小明同学认为乙、丙实验对验证这三种金属活动性没有作用,可以省去,你的看法是____(填字母)。
(1)、由甲图实验现象可以得出溶液呈性。(2)、分析乙图实验的现象,可以确定样品的变质情况为。(选填“不变质、部分变质、完全变质”)(3)、图乙中,滴加足量的BaCl2溶液的目的是。24. 金属及金属材料在生产、生活中有广泛的应用。(1)、下列金属制品中,利用金属导热性的是____(填字母)。A、金属硬币 B、铝制导线 C、铜制火锅(2)、近年来,我国高铁飞速发展,已成为世界上唯一高铁成网运行的国家。建造高铁使用了大量铁合金,构成金属铁的粒子是(填“分子”“原子”或“离子”)。(3)、铝合金中主要含铝、铜、镁三种金属,为验证这三种金属的活动性顺序,某同学设计了以下3个实验:甲实验能得出的结论是铝的金属活动性更强,小明同学认为乙、丙实验对验证这三种金属活动性没有作用,可以省去,你的看法是____(填字母)。 A、乙、丙都可以省去 B、乙、丙都不能省去 C、丙可以省去,乙不能省 D、乙可以省去,丙不能省(4)、如图横坐标表示反应时间,纵坐标表示的质量:能代表等质量的Mg、Zn、Fe分别与足量的盐酸反应的图象是____。A、
A、乙、丙都可以省去 B、乙、丙都不能省去 C、丙可以省去,乙不能省 D、乙可以省去,丙不能省(4)、如图横坐标表示反应时间,纵坐标表示的质量:能代表等质量的Mg、Zn、Fe分别与足量的盐酸反应的图象是____。A、 B、
B、 C、
C、 D、
D、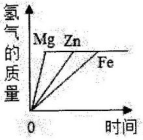 25. 某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算:
25. 某锥形瓶盛有盐酸和氯化铜的混合溶液100g,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量与滴入的氢氧化钠溶液的质量的变化关系如图所示。请计算: (1)、反应至A点时加入氢氧化钠溶液的质量为g(2)、反应至A点时,溶液中的溶质有。(3)、反应至B点时,锥形瓶内溶液中NaCl的质量为g
(1)、反应至A点时加入氢氧化钠溶液的质量为g(2)、反应至A点时,溶液中的溶质有。(3)、反应至B点时,锥形瓶内溶液中NaCl的质量为g三、实验探究题(每空2分,共36分)
-
26. 我国提出努力争取在2060年前实现“碳中和”,充分体现了解决气候问题的大国担当。“筑梦”活动小组开展了“低碳有我”实践活动,请回答下列问题。
【活动一】探究碳“捕捉”
根据二氧化碳的性质,可以用水和碱溶液“捕捉”二氧化碳。为比较“捕捉”效果,小组同学设计如图一所示实验,装置a端连接气压传感器,测得烧瓶内压强与时间的关系曲线如图二所示。
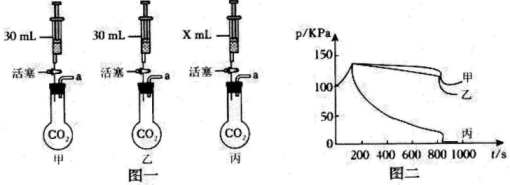
图一中,甲、乙、丙注射器内的试剂分别是水、饱和石灰水、氢氧化钠浓溶液,X的数值为mL;分析图二可知“捕捉”二氧化碳效果最好的是(选填甲乙丙),该装置中发生反应的化学方程式为。
【活动二】计算碳转化
基于元素守恒,小组同学推测可以将二氧化碳转化为更高价值的物质,实现二氧化碳的再利用。我国科学家在利用二氧化碳直接合成乙醇(C2H5OH)的研究上已取得重大突破,其转化的化学方程式为2CO2+6RC2H5OH+3H2O,其中R的化学式为。如果用此方法处理44kg二氧化碳,使其完全反应,则生成乙醇的质量是kg。
27. 为满足生产生活对氧气的需求,市场上出现了多种类型制氧机。(1)、分子筛制氧机
分子筛制氧机以空气为原料,空气经过分子筛时氮气被吸附,氧气通过,获得高浓度的O2。其微观示意过程如图所示,分离过程中的变化属于(填“物理”或“化学”)变化。
(2)、化学药剂制氧机如图是某品牌制氧机的工作原理示意图。

在反应仓中依次加入水、粉末状过碳酸钠(2Na2CO3·3H2O2)、粉末状二氧化锰,即产生氧气。该制氧机的制氧原理有两步:
第一步:2Na2CO3·3H2O2=2Na2CO3+3H2O2
第二步:(用化学方程式表示)。
(3)、某家庭制氧机上有湿化瓶装置,湿化瓶装置类似于如图。关于该装注水口置,下列说法正确的有____。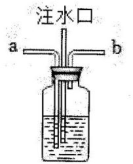 A、b导管连接制氧机 B、b导管连接病人吸氧的塑料管 C、可以观察氧气生成的速率(4)、探究不同物质对过氧化氢分解速率的影响
A、b导管连接制氧机 B、b导管连接病人吸氧的塑料管 C、可以观察氧气生成的速率(4)、探究不同物质对过氧化氢分解速率的影响相同温度下,向过氧化氢溶液中分别加入氯化钠、碳酸钠、氢氧化钠,一段时间后用传感器测定溶液中溶解氧浓度(一定体积水中所溶解氧气的质量)。
实验序号
试剂
溶解氧浓度/(mg/L)
①
100g4%H2O2溶液
6.44
②
100g4%H2O2溶液、lg氯化钠固体
6.44
③
100g4%H2O2溶液、1g碳酸钠固体
9.11
④
100g4%H2O2溶液、1g氢氧化钠固体
10.97
由实验可知,能加快过氧化氢的分解速率的有;由实验可知Na+对过氧化氢的分解没有影响;综上可知,(填碱性、中性、或酸性)条件下过氧化氢的分解速率更快。
28. 中国化学家侯德榜发明了将制碱与制氨结合起来的联合制碱法,又称“侯氏制碱法”。某化学兴趣小组对侯氏制碱法的产物及其性质、用途等开展项目式学习。任务一:了解“侯氏制碱法”的产物——Na2CO3和NH4Cl
⑴请写出Na2CO3的俗称:(写一个即可)。
⑵NH4Cl在物质的分类中属于“盐”。
任务二:探究NH4Cl的性质——NH4Cl溶液呈酸性
【提出问题】NH4Cl溶液呈酸性的原因是什么?
【查阅资料】①溶液呈酸性,是因为溶液中存在较多的H+。
②NH4Cl在水中全部解离出和Cl-。
③Na2SO4 , 溶液呈中性,Na+对溶液的酸碱性没有影响。
【提出猜想】
猜想一:水分子单独起作用,产生较多的H+ , 使溶液呈酸性;
猜想二:Cl-与水作用,产生较多的H+ , 使溶液呈酸性;
猜想三:。
【实验探究】
实验操作
实验现象
结论
⑴向试管中加入一定量的蒸馏水,滴入2滴紫色石蕊溶液
溶液呈紫色
猜想一不成立
⑵向试管中加入一定量的NaCl溶液,滴入2滴紫色石蕊溶液
溶液呈紫色
猜想二不成立
⑶向试管中加入一定量的NH4Cl溶液,滴入2滴紫色石蕊
猜想三成立
【解释与结论】同学们向老师请教,得知一部分NH4+ , 和水分子作用,产生较多的H,使溶液呈酸性。
【拓展与延伸】同学们在查阅资料的过程中还发现:
①酸和碱都有强弱之分,盐酸、硫酸、硝酸是强酸,碳酸、醋酸等是弱酸;氢氧化钠、氢氧化钾是强碱;氨水、氢氧化铁、氢氧化铜是弱碱。
②盐是酸碱中和的产物,强酸跟弱碱反应生成的盐叫强酸弱碱盐,其盐溶液呈酸性;强碱跟弱酸反应生成的盐叫强碱弱酸盐,其盐溶液呈碱性;强酸跟强碱反应生成的盐叫强酸强碱盐,其盐溶液呈中性。
NH4Cl溶液可以看成是强酸与弱碱反应生成的盐溶液。由此可推出醋酸钠溶液呈性,硝酸钾溶液呈性。
任务三:了解NH4Cl的用途——用于生产化肥
⑴NH4Cl属于化肥中的(选填“氮”、“磷”或“钾”)肥。
⑵化肥对农作物增产具有十分重要的作用。但是在使用NH4Cl作为化学肥料时,要注意不能与熟石灰混合使用,原因是(用化学方程式表示)。
四、解答题(共30分。29题6分,30题4分,31题10分,32题6分,33题4分)
-
29. “青团”是宁波的一种传统食物。在“青团”制作过程中,需要往糯米粉中添加艾草(或艾草汁)。艾草含有侧柏莲酮芳香油(C10H10O),侧柏莲酮芳香油是一种淡黄色液体,具有香脂香气,所以“青团”具有独特风味。(1)、侧柏莲酮芳香油由种元素组成。(2)、侧柏莲酮芳香油的相对分子质量是。(3)、7.3g侧柏莲桐芳香油中碳元素的质量为g。30. 13g锌与148.4g稀硫酸恰好完全反应,求:(1)、产生氢气的质量.(2)、反应后所得溶液中溶质的质量分数.31. 古籍中有记载制烧碱的方法,其核心反应可表示为:Na2CO3+Ca(OH)2=2NaOH+CaCO3↓。小宁模仿古法,以实验室中的Na2CO3、Ca(OH)2 , 固体为原料,制备500g溶质质量分数为10%的NaOH溶液用于制作叶脉书签。(1)、制作叶脉书签时,用NaOH溶液去除叶肉,是利用了NaOH的。(2)、500g溶质质量分数为10%的NaOH溶液中,含NaOH的质量为g、水的质量为g。(3)、需称取Na2CO3、Ca(OH)2的质量各为多少?32. 某纯碱样品中含有少量氯化钠杂质。称取该样品22.8g,加入到盛有一定质量稀盐酸的烧杯中,碳酸钠与稀盐酸恰好完全反应,气体完全逸出,得到不饱和NaCl溶液。反应过程中测得烧杯内混合物的质量(m)与返时间(t)关系如图所示。试回答:
 (1)、生成CO2的质量。(2)、计算样品中碳酸钠的质量分数。(精确到0.1%)(3)、计算所得溶液中溶质的质量分数。(精确到0.1%)33. 某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品12g放入烧杯,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。请计算:
(1)、生成CO2的质量。(2)、计算样品中碳酸钠的质量分数。(精确到0.1%)(3)、计算所得溶液中溶质的质量分数。(精确到0.1%)33. 某学校的学习小组对当地的石灰石矿区进行调查,测定石灰石中碳酸钙的质量分数,采用的方法如下:取该石灰石样品12g放入烧杯,把80g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,也不与稀盐酸反应)。请计算:序号
第一次
第二次
第三次
第四次
加入稀盐酸的质/g
20
20
20
20
剩余固体的质量/g
8
4
2
2
(1)、所用盐酸的溶质质量分数为(精确到0.1%)(2)、第四次后所得溶液中氯化钙的质量分数为。(精确到1%)