江苏省南通市启东市2023年化学中考二模试题
试卷更新日期:2023-11-09 类型:中考模拟
一、单选题
-
1. 中国历史文化悠久,流传下许多精美文物。下列文物主要由金属材料制成的是( )A、商周青铜器 B、唐代丝绸 C、宋代陶瓷 D、清代玉器2. 科学的分类能够反映事物的本质特征。下列说法正确的是( )A、氯酸钾属于氧化物 B、乙醇属于无机化合物 C、油脂属于基本营养素 D、稀有气体属于纯净物3. 南梁陶弘景在《本草经集注》中记载了石灰的制法与性质:“近山生石,青白色;作灶 烧竟,以水沃之,即热蒸而解。” 下列有关说法不正确的是( )A、“青白色石”主要成分是CaCO3 B、“作灶烧竟”过程发生分解反应 C、“以水沃之”过程放出大量的热 D、“热蒸而解”表明石灰受热溶解4. 下列有关物质的性质与用途具有对应关系的是( )A、铁粉锈蚀吸收氧气,可用作食品脱氧剂 B、活性炭具有吸附性,可用于硬水的软化 C、酒精具有挥发性,可用于杀菌消毒 D、浓硫酸具有脱水性,可用作干燥剂5. 燃油汽车行驶中会产生CO、NO等多种污染物。图为汽车发动机及催化转化器中发生的部分化学反应,通过反应最终转化为无毒物质排放。以下判断不正确的是( )
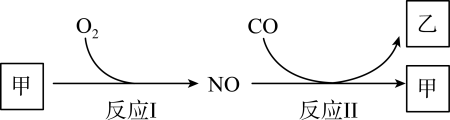 A、甲是空气中体积分数最大的成分 B、乙是引起温室效应的气体之一 C、反应Ⅰ在常温下容易发生 D、反应Ⅱ中NO被还原6. 氯化钠、碳酸钠、硝酸钾在不同温度时的溶解度如表所示,某同学根据表中数据作出了其中一种物质的溶解度曲线(如图),请根据表和图中信息指出下列说法不正确的 ( )
A、甲是空气中体积分数最大的成分 B、乙是引起温室效应的气体之一 C、反应Ⅰ在常温下容易发生 D、反应Ⅱ中NO被还原6. 氯化钠、碳酸钠、硝酸钾在不同温度时的溶解度如表所示,某同学根据表中数据作出了其中一种物质的溶解度曲线(如图),请根据表和图中信息指出下列说法不正确的 ( )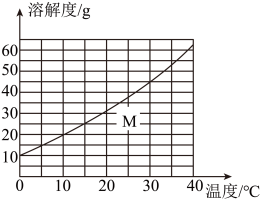
温度/℃
0
10
20
30
40
溶解度/g
氯化钠
35.7
35.8
36
36.5
37
碳酸钠
6
16
18
36.5
50
硝酸钾
13.3
20.9
31.6
45.8
63.9
A、曲线M是表中硝酸钾的溶解度曲线 B、将20℃时氯化钠和碳酸钠的饱和溶液升温至30℃,两溶液溶质的质量分数相等 C、从混有少量硝酸钾的氯化钠溶液中提纯氯化钠固体,可采用的方法是蒸发结晶 D、如果将表中三种物质的溶解度曲线全部画出,在0℃~40℃范围内有2个两线交点7. 下列实验方案能达到实验目的的是 ( )A、比较铜和银的活泼性:将金属分别投入稀硫酸溶液中,观察现象 B、检验碳酸钠中是否含有氯化钠:加过量的稀盐酸后,再加硝酸银溶液,观察现象 C、检验NaOH固体是否变质:取样加水溶解后,滴加酚酞溶液,观察溶液是否变红 D、配制50g5%的NaCl溶液:向盛有2.5gNaCl固体的烧杯中,加入47.5mL水(密度为1g/mL),搅拌至充分溶解8. 某小组以图1装置用CO还原CuO制取Cu,不同温度下反应4小时后固体物质的XRD图如图2所示(XRD图谱可用于判断某固体物质是否存在,不同固体出现的衍射峰的衍射角不同)。下列说法正确的是 ( )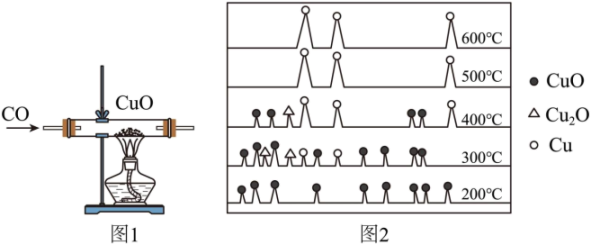 A、400℃时固体产物只有Cu B、实验中,随着温度的升高,CuO先全部转化为Cu2O,再转化为Cu C、取32gCuO放在图1管中,在一定温度下全部转化为Cu时,消耗CO的质量大于11.2g D、取32gCuO放在图1管中,在一定温度下实验,最终得到固体产物Cu和Cu2O的质量的为27.2g,则生成的CO2质量为14.2g
A、400℃时固体产物只有Cu B、实验中,随着温度的升高,CuO先全部转化为Cu2O,再转化为Cu C、取32gCuO放在图1管中,在一定温度下全部转化为Cu时,消耗CO的质量大于11.2g D、取32gCuO放在图1管中,在一定温度下实验,最终得到固体产物Cu和Cu2O的质量的为27.2g,则生成的CO2质量为14.2g二、选择题组
-
9. 阅读下列材料,完成下面小题。
Cl2是一种黄绿色有刺激性气味的有毒气体,密度比空气大,易溶于水。能和NaOH反应:。实验室以MnO2和浓盐酸共热制取氯气,其化学反应方程式为: 。
(1)、实验室制取Cl2时,下列装置能达到实验目的是( )A、制取Cl2 B、干燥Cl2
B、干燥Cl2 C、收集Cl2
C、收集Cl2 D、吸收Cl2尾气
D、吸收Cl2尾气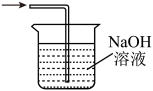 (2)、下列有关说法正确的是( )A、打开盛装浓盐酸的试剂瓶的瓶塞,瓶口有白烟产生 B、能闻到氯气的刺激性气味,是因为分子在不断运动 C、制取氯气时,二氧化锰在反应中作催化剂 D、制取Cl2过程中溶液的pH不断减小
(2)、下列有关说法正确的是( )A、打开盛装浓盐酸的试剂瓶的瓶塞,瓶口有白烟产生 B、能闻到氯气的刺激性气味,是因为分子在不断运动 C、制取氯气时,二氧化锰在反应中作催化剂 D、制取Cl2过程中溶液的pH不断减小三、填空题
-
10. 镁是一种重要的金属材料,在生产和生活中有广泛的应用。(1)、发现制取镁。
①德国生物学家韦尔斯泰特最早发现了叶绿素中含有镁,这里的镁是指。
a.单质 b.原子 c.元素
②1792年,人类首次加热苦土(氧化镁)和木炭混合物制得金属镁,同时生成二氧化碳,该反应体现了木炭的性。
(2)、了解认识镁。图1为镁原子的结构示意图,图2为镁元素价类二维图。图3为CO2与H2在MgO和Pd联合催化下实现CO2再利用的反应机理图(虚线处部分中间产物略去)。
①图1中x的数值为。已知元素在周期表中的周期序数等于该元素原子具有的电子层数,则镁位于周期表的第周期。
②图2中的Mg(NO3)2可由A与发生中和反应而获得。
③写出图3中总反应的化学方程式。
四、流程题
-
11. 工业上利用软锰矿(主要成分为MnO2 , 还含有Fe2O3、Al2O3、MgO、CaO、SiO2等杂质)与葡萄糖反应制备Mn3O4 , 工艺流程如图所示。
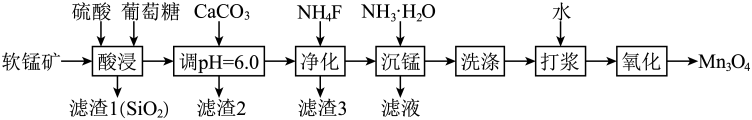 (1)、“酸浸”时MnO2发生反应的化学方程式为:
(1)、“酸浸”时MnO2发生反应的化学方程式为:C6H12O6+12MnO2+12H2SO4=12MnSO4+6CO2↑+18X,X的化学式为。
其他金属氧化物和硫酸反应生成相应的硫酸盐,写出Fe2O3和硫酸反应的化学方程式。
(2)、已知相关离子形成氢氧化物沉淀的pH范围如下表所示。金属离子
Fe3+
Al3+
Mg2+
Mn2+
开始沉淀时pH
1.6
3.0
8.9
8.1
完全沉淀时pH
2.8
4.7
10.9
10.1
则滤渣2的主要成分是。
(3)、“净化”时,加入NH4F是为了将Mg2+转化为MgF2沉淀除去,同时还能除去(填元素符号)。(4)、“沉锰”时的反应为MnSO4+2NH3·H2O=Mn(OH)2↓+(NH4)2SO4。该反应的基本类型为。所得滤液的一种用途为。(5)、将Mn(OH)2加水“打浆”制成悬浊液,可加快“氧化”反应速率的原因是。(6)、“氧化”时,氧化时间对产品中锰含量的影响如图所示,最合理的氧化时间为min。
五、综合应用题
-
12. 四大发明是中国古代劳动人民的智慧成果,也为世界留下了一串光耀的足迹。(1)、造纸术:古法造纸工艺包含将竹子蒸煮、抄纸、漂白等步骤。
①蒸煮时往浆水中加入草木灰(主要成分K2CO3)和石灰水,成浆效果更佳。写出K2CO3和Ca(OH)2反应的化学方程式。
②现代壁纸、包装纸要求纸张具有阻燃性,氢氧化铝是常见的阻燃剂,其受热至220℃开始分解生成氧化铝和水,反应过程中(填“吸收”或“放出”)热量,同时生成的固体覆盖在纸张表面,起到作用。
(2)、指南针:古代指南针用天然磁石打磨而成,磁石的主要成分为Fe3O4 , 其中铁元素和氧元素的质量比为。打磨磁石制成指南针的过程属于(填“物理”或“化学”)变化。(3)、黑火药:黑火药爆炸时的化学方程式为 , 反应中化合价降低的元素有(填元素符号)。(4)、印刷术:活字印刷的步骤有制模、挑字、排版、涂墨、上纸印刷。①排版时,需用小火烘烤模板上的石蜡,使其熔化,烘烤过程中温度不能过高的原因是。
②用墨印刷的字画能够长久保存而不褪色的原因是。
六、科学探究题
-
13. 铁是人体必需的元素,主要以Fe2+的形式被人体吸收,但Fe2+容易被O2、H2O2等氧化成Fe3+而不利于吸收。某小组对某种包有糖衣的补铁药片的成分展开探究。(1)、 铁对于人体来说是(填“常量”或“微量”)元素,人体缺少铁元素会引起的疾病是。(2)、【提出问题】
补铁药片中铁元素的价态是什么?糖衣的作用是什么?
【查阅资料】
①该补铁剂不溶于水,但能溶于人体中的胃液。
②KSCN溶液遇Fe3+显示红色,遇到Fe2+不变色。
③Fe3+遇K3[Fe(CN)6]溶液不变色,Fe2+遇K3[Fe(CN)6]溶液会生成蓝色沉淀。
【实验探究】
甲同学向碾碎后的补铁剂中加入足量的水,分别滴加KSCN溶液和K3[Fe(CN)6]溶液均未观察到明显现象,可能的原因是。
(3)、乙同学思考后设计下列流程进行探究: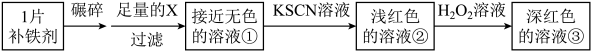
①在实验室里碾碎补铁剂可在(填仪器名称)中进行,试剂X是。
②加入KSCN后溶液变为浅红色,说明溶液①中含有(填离子符号)。
③能证明溶液①中含有Fe2+的实验现象是。
(4)、【交流反思】该药片外表包有一层糖衣,除了包装药物外,糖衣的另一个作用可能是。
(5)、【拓展延伸】医生建议在服用补铁剂时,同时服用维生素C确保补铁效果,猜想维生素C能将Fe3+转化为Fe2+ , 以利于人体吸收,请设计实验验证这一猜想(须使用的试剂有Fe2(SO4)3溶液、维生素C、KFe(CN)6溶液)。
七、计算题
-
14. 碱式碳酸铜[Cu2(OH)2CO3]常用于烟花、农药等行业、将CuSO4溶液和Na2CO3溶液混合可制备碱式碳酸铜[Cu2(OH)2CO3],反应原理为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+CO2↑+2Na2SO4。某小组同学利用该原理制备碱式碳酸铜,并测定所用CuSO4溶液的质量分数。(1)、实验测得所取用的CuSO4溶液的pH=6,则该CuSO4溶液呈(填“酸性”“碱性”或“中性”)。(2)、已知碱性条件下有利于大颗粒碱式碳酸铜的生成,为了得到较大颗粒的碱式碳酸铜,混合碳酸钠和硫酸铜两溶液的操作方法是。(3)、取100gCuSO4溶液和足量的碳酸钠溶液按(2)中正确方法混合后,过滤,将所得的沉淀过滤、洗涤、低温烘干后称量,质量为2.22g。
①计算所取CuSO4溶液的质量分数。
②如没有对所得沉淀进行洗涤,则CuSO4溶液的质量分数将 (填“偏大”“偏小”或“无影响”)。
-
-
-
-
-