江苏省淮安市金湖县2023年化学中考三模试题
试卷更新日期:2023-11-09 类型:中考模拟
一、单选题
-
1. 《天工开物)中记载有我国历史上出现的下列造物过程,其中涉及化学变化的是( )A、织衣布 B、钉术舟 C、炼生铁 D、晒海盐2. “垃圾分一分,环境美十分”。塑料矿泉水瓶应投放垃圾桶的标志是( )A、可回收物
 B、有害垃圾
B、有害垃圾 C、厨余垃圾
C、厨余垃圾 D、其它垃圾
D、其它垃圾 3. “操作千万条,安全第一条”。下列实验操作中,正确的是( )A、加热液体
3. “操作千万条,安全第一条”。下列实验操作中,正确的是( )A、加热液体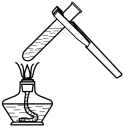 B、移开蒸发皿
B、移开蒸发皿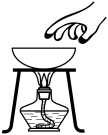 C、氢气验纯
C、氢气验纯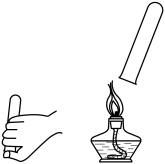 D、铁丝在氧气中燃烧
D、铁丝在氧气中燃烧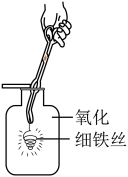 4. 钼酸锂(Li2MoO4)上要用于金属陶瓷、电阻器材料导领域,其中Li的化合价为+1价。则Mo的化合价为( )A、+6 B、+4 C、-3 D、+25. 某位病人体检时检测出的体液pH如下,其中酸性最强的是( )A、血液:7.45 B、胃液:1.0 C、胆汁:6.9 D、尿液:5.46. 在一次家庭小实验中,当点燃装有半杯水的纸杯时,发现水面以下部分没有燃烧,其主要原因是( )
4. 钼酸锂(Li2MoO4)上要用于金属陶瓷、电阻器材料导领域,其中Li的化合价为+1价。则Mo的化合价为( )A、+6 B、+4 C、-3 D、+25. 某位病人体检时检测出的体液pH如下,其中酸性最强的是( )A、血液:7.45 B、胃液:1.0 C、胆汁:6.9 D、尿液:5.46. 在一次家庭小实验中,当点燃装有半杯水的纸杯时,发现水面以下部分没有燃烧,其主要原因是( ) A、纸杯着火点变低 B、温度低于着火点 C、与氧气接触面太小 D、纸杯不是可燃物7. 下列有关物质的性质和用途具有对应关系的是( )A、干冰升华吸热,可用作制冷剂 B、氮气难溶于水,可作食品保护气 C、金刚石折光性好,可用作钻头 D、酒精有挥发性,可用于杀菌消毒8. 奥闻他韦(化学式可表示为C16H28N2O4)胶囊是治疗流感的特效药。下列有关奥司他韦的说法中正确的是( )A、相对分子质量为312g,含有1个氮分子 B、相对分子质量大,属于有机高分子化合物 C、分子中氢元素和氮元素的质量比为14:1 D、分子中碳元素的质量分数是氧元素的3倍9. 某实验探究小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应过程,实验操作和测定结果如图所示。下列叙述中正确的是( )
A、纸杯着火点变低 B、温度低于着火点 C、与氧气接触面太小 D、纸杯不是可燃物7. 下列有关物质的性质和用途具有对应关系的是( )A、干冰升华吸热,可用作制冷剂 B、氮气难溶于水,可作食品保护气 C、金刚石折光性好,可用作钻头 D、酒精有挥发性,可用于杀菌消毒8. 奥闻他韦(化学式可表示为C16H28N2O4)胶囊是治疗流感的特效药。下列有关奥司他韦的说法中正确的是( )A、相对分子质量为312g,含有1个氮分子 B、相对分子质量大,属于有机高分子化合物 C、分子中氢元素和氮元素的质量比为14:1 D、分子中碳元素的质量分数是氧元素的3倍9. 某实验探究小组用pH传感器探究稀盐酸和氢氧化钠溶液的反应过程,实验操作和测定结果如图所示。下列叙述中正确的是( )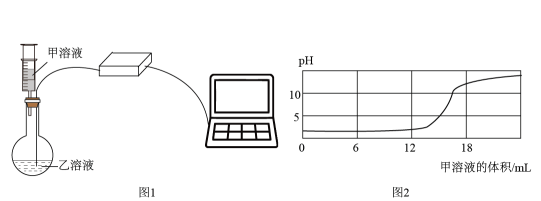
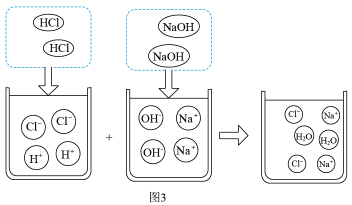 A、图1使用注射器加入甲溶液,主要是为了精确地计量液体体积 B、依据图2给定结果,圆底烧瓶内加入的乙溶液为NaOH溶液 C、结合图3分析,加入甲溶液6mL时,烧瓶中的溶液只有Na+、Cl- D、加入甲溶液12mL后,将所得溶液蒸干,得到固体只含NaCl10. 用Pt-Rh合金保化氧化NH3制NO,其反应的微观模型如图1,含氮生成物产率随反应温度的变化曲线如图2所示。关于该转化过程的说法不正确的是( )
A、图1使用注射器加入甲溶液,主要是为了精确地计量液体体积 B、依据图2给定结果,圆底烧瓶内加入的乙溶液为NaOH溶液 C、结合图3分析,加入甲溶液6mL时,烧瓶中的溶液只有Na+、Cl- D、加入甲溶液12mL后,将所得溶液蒸干,得到固体只含NaCl10. 用Pt-Rh合金保化氧化NH3制NO,其反应的微观模型如图1,含氮生成物产率随反应温度的变化曲线如图2所示。关于该转化过程的说法不正确的是( )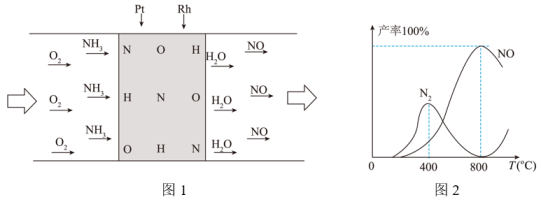 A、催化过程中,NH3、O2在Pt-Rh合金表面拆分成原子 B、当产物全为NO和H2O时,m(NO):m(H2O)=10:9 C、400℃时,通入的NH3全都与O2反应生成N2和H2O D、Pt-Rh合金催化氧化NH3制NO,适宜的温度为800℃
A、催化过程中,NH3、O2在Pt-Rh合金表面拆分成原子 B、当产物全为NO和H2O时,m(NO):m(H2O)=10:9 C、400℃时,通入的NH3全都与O2反应生成N2和H2O D、Pt-Rh合金催化氧化NH3制NO,适宜的温度为800℃二、填空题
-
11. 金湖是苏北的“鱼米之乡”。物产言饶,美食之都。(1)、交实俗称“鸡头米”,个小须软,口感香糯,其含有的淀粉属于____(填字母)。A、糖类 B、油脂 C、蛋白质(2)、鱼圆洁白弹嫩,入口顺滑,制作时将鱼肉普倒在炒布上,清水冲洗,去除鱼血。该分离过程中,纱布的作用相当于实验室中“过滤"所用到的。(3)、吕良镇的棋盘古街,青砖黛瓦述说着小镇的悠久历史,在烧制青砖过程中,水蒸气会与灼热的炭反应生成CO和一种气体单质,该反应化学方程式为。(4)、金湖的公共交通正在蓬勃发展,所使用的电车主要采用磷酸铁锂电池供电,其能量转换形式是转化为电能。
三、综合应用题
-
12. 水是一切生合体生在所必委的物质。(1)、爱护水资源,在节约用水的同时防治水体污染,下列做法合理的是____(填标号)。A、水龙头漏水不及时更换 B、生活河水集中处理和排放 C、洗脸水冲厕所 D、农业上合理使用农药和化肥(2)、①某同学从三河中取间水样、用自制冷水器处理,净水器中活性炭可以(填“吸附”或“蒸馏”)水样中的异味和色素。
②向处理后的水样中加入肥皂水,振荡。观察到泡沫较少,浮渣较多,则该水样属于(填“硬水”或“软水")。
(3)、碳酸氢钠和氯化铵的溶解度曲线如图所示。下列说法正确的是____。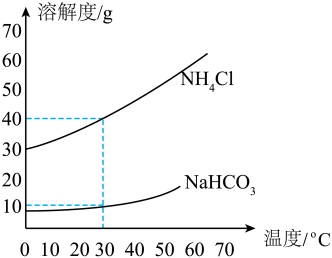 A、30℃时,NaHCO3的溶解度是40g B、30℃时,饱和溶液的溶质质量分数NH4Cl小于NaHCO3 C、将50℃时NH4Cl的饱和溶液降低到10℃,该饱和溶液的溶质质量分数变大 D、饱和NaCl溶液通NH3至饱和再通入CO2 , 生成NaHCO3和NH4Cl,NaHCO3将结晶析出13. 燃烧是人类最早利用的化学反应之一、(1)、《墨经》中记载了“立窑烧烟法”制墨。将松木置于炉膛中燃烧,瓮中收集的烟可用于制墨。“立窑烧烟法”利用了松木的(填“完全”或“不完全”)燃烧。(2)、火善用之为福,不善用之为锅。下面是一些常用的灭火方法。请你从灭火原理角度看,属于隔绝空气(或氧气)的有____。A、熄灭液化气灶火焰时,关闭阀门 B、木材着火时,用泡沫灭火器灭火 C、油锅着火时,用锅盖盖灭 D、熄灭酒精灯时,用灯帽盖灭(3)、化学链燃烧是利用载氧体在两个反应器之间的循环,实现燃料在较温度下燃烧。以氧化镍(NiO)作载氧体的“化学链燃烧“过程如下:
A、30℃时,NaHCO3的溶解度是40g B、30℃时,饱和溶液的溶质质量分数NH4Cl小于NaHCO3 C、将50℃时NH4Cl的饱和溶液降低到10℃,该饱和溶液的溶质质量分数变大 D、饱和NaCl溶液通NH3至饱和再通入CO2 , 生成NaHCO3和NH4Cl,NaHCO3将结晶析出13. 燃烧是人类最早利用的化学反应之一、(1)、《墨经》中记载了“立窑烧烟法”制墨。将松木置于炉膛中燃烧,瓮中收集的烟可用于制墨。“立窑烧烟法”利用了松木的(填“完全”或“不完全”)燃烧。(2)、火善用之为福,不善用之为锅。下面是一些常用的灭火方法。请你从灭火原理角度看,属于隔绝空气(或氧气)的有____。A、熄灭液化气灶火焰时,关闭阀门 B、木材着火时,用泡沫灭火器灭火 C、油锅着火时,用锅盖盖灭 D、熄灭酒精灯时,用灯帽盖灭(3)、化学链燃烧是利用载氧体在两个反应器之间的循环,实现燃料在较温度下燃烧。以氧化镍(NiO)作载氧体的“化学链燃烧“过程如下:
①反应器1中发生反应的基本类型是 , Ni(固体)的颗粒越(选填“大”或“小”),则反应越充分。
②一定温度下,反应器2中发生反应的化学方程式是 , 该容器中反应引发后,不需要再加热,可能的原因是。
四、流程题
-
14. 我国是燃煤大国,煤燃烧时产生的粉煤灰(主要成分为Al2O3、SiO2及少量Fe2O3等)也是一种可利用的资源。以粉煤灰为原料制取Al2O3的部分工艺流程如图:

【资料】①SiO2既不溶于水也不溶于酸。
②煅烧时发生的反应为:
(1)、操作Ⅰ中用到的玻璃仪器有烧杯、玻璃棒和。(2)、“酸浸”步骤中不宜使用浓盐酸,主要原因是 , 对环境污染大。(3)、“除铁”时的反应为FeCl3+3NH4HCO3=3NH4Cl+X↓+3CO2↑,X的化学式为。(4)、流程中可循环利用的物质为(填化学式)。(5)、高温烧结的Al2O3 , 又称人造刚玉,可用于制机械轴承、耐高温坩埚、高强度陶瓷等,由此可推知此类Al2O3性质为(任写一种)。五、综合题
-
15. 阅读下列材料,回答相关问题。
双氧水是过氧化氢的水溶液,市售的双氧水的浓度般是30%和3%的水溶液。双氧水常用于杀菌消毒,医用双氧水浓度等于或低于3%,擦拭到创伤面,会有灼烧感,创伤表面被氧化成白色并冒气泡,用清水清洗一下,3~5分钟后就恢复原来的颜色。
双氧水可用作氧化剂、漂白剂。脱氯剂,具有不稳定性。将水蒸气冷凝在硅、玻璃、塑料、金属等材料表面,均在其中发现了过氧化氢。
研究显示:水蒸气冷凝为粒径小于10微来的液滴时,部分水分子会转化为过氧化氢分子。水微海中形成的过氧化氢含量随液滴尺寸的增大而减少。过氧化氢的产生量与温度等环境条件密切相关。
(1)、文中涉及的材料中,属于有机合成材料的是。(2)、双氧水擦拭到创伤面,创伤表面管出气泡的化学方程式是。(3)、水蒸气冷凝为粒径小于10微米的液滴时,可能发生化学变化,因为《从微观角度解释》。(4)、水蒸气在玻璃表面冷凝得到的粒径小于10微米的液滴,属于(选填“混合物”或“纯净物”)。(5)、结合材料信息分析,在一定条件下,水蒸气冷凝液可用于。(6)、当使用硅材料、相对湿度为55%时,得到过氧化氢的最大浓度随温度变化关系如图所示。图中a点(-2.8℃)未生成过氧化氢的原因可能是。
六、实验题
-
16. 化学小组的同学利用下图装置进行气体制备,回答下列问题。
 (1)、标号为①的仪器名称是。(2)、写出实验室用KMnO4制取氧气的化学方程式;用E装置收集氧气时,待集气瓶里的水排完后, , 再小心地把集气瓶移出水槽,正放在桌面上。(3)、若需制备并收集一瓶二氧化碳,可选择的装置是(填字母)。(4)、在F装置的实验中,瓶口棉花可以减缓气体的扩散,同时NaOH溶液能吸收(填化学式),防止污染环境。
(1)、标号为①的仪器名称是。(2)、写出实验室用KMnO4制取氧气的化学方程式;用E装置收集氧气时,待集气瓶里的水排完后, , 再小心地把集气瓶移出水槽,正放在桌面上。(3)、若需制备并收集一瓶二氧化碳,可选择的装置是(填字母)。(4)、在F装置的实验中,瓶口棉花可以减缓气体的扩散,同时NaOH溶液能吸收(填化学式),防止污染环境。七、科学探究题
-
17. 铜及其化合物的冶炼与人类生活、社会发展有密切联系。(1)、分别在H2与CO气氛下,还原氧化铜样品。对反应后的样品进行X射线衍射,得到的XRD图谱(图谱中的峰值可以表征某物种的存在)结果如图1所示。
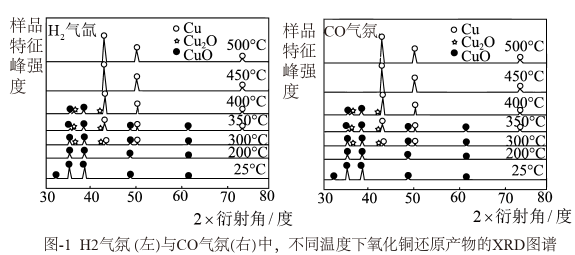
结合图像说明,(选填“能“或“不能”)采用热还原的方法直接制得纯净的Cu2O产品,原因是。
(2)、在实验室选择如图2装置探究木炭和氧化铜反应的最佳质量比。
【查阅资料】
Ⅰ.木炭能在较高温度环境中将氧化铜中的氧元素夺去,生成单质铜
Ⅱ.酒精灯防风罩能将酒精灯火焰温度提升至600~800℃
Ⅲ.铜的熔点为1083*C
【装置分析】
①该实验并未采用略向下倾斜试管的加热方法,原因可能是。
A.使火焰更好包裹住药品部位,提高反应温度
B.防止生成的气体冲散药品,降低实验成功率
C.过程中会生成液态的铜,且防止石灰水倒吸
【实验过程】
实验:取0.1g木炭粉与一定量的氧化铜粉末按下表所示比例充分混合,在粉末堆中插入一块灼烧过的铜片,进行实验。
序号
木炭粉与氧化铜粉末混合质量比
充分反应后试管底部固体的颜色
1
1:9
红色固体有金属光泽
混有少量黑色物质
2
1:10
混有很少量黑色物质
3
1:11
混有极少量黑色物质
4
1:12
无黑色物质
5
1:13
混有少量黑色物质
②从表中可知,木炭还原氧化铜的最佳质量比是。
③无需再进行木炭粉与氧化铜粉末质量比为1:14的实验,原因是。
④取出铜片观察,发现埋入粉末的部分变红,有金属光泽,上方铜片也变为亮红色,右侧澄清石灰水变浑浊,由此推测反应中产生的气体一定有。
⑤试管底部的亮红色固体呈“海绵状”,如图-3所示,结合以上信息,实验得到“海绵铜”而非块状铜的原因是。
⑥某同学取8.0gCuO固体粉末与一定量木炭以最佳质量比混合,若CuO完全转化为Cu,理论上预计能得到Cu的质量为(写出计算过程)。
-
-
-
-