云南市昆明市名校2023-2024学年高二上学期10月月考化学试题
试卷更新日期:2023-11-08 类型:月考试卷
一、选择题(本大题共24小题,每小题2分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的)
-
1. 下列关于常见物质的分类正确的是( )A、汽油——化合物 B、纯碱——盐 C、硫酸氢钠——酸 D、碘酒——电解质2. 化学与生产生活密切相关,下列说法正确的是( )A、在我国最早使用的合金是钢 B、石油的分馏属于化学变化 C、从海水中提取物质都要通过化学反应才能实现 D、高纯硅可用于制作光感电池3. 巴豆酸的结构简式为CH3CH=CHCOOH,下列有关该物质的说法正确的是( )A、属于乙酸的同系物 B、所有原子均处于同一平面 C、可发生加成反应不能发生取代反应 D、能使溴水和酸性高锰酸钾溶液褪色4. 下列各组离子,在无色澄清溶液中能大量共存的是( )A、、、、 B、、、、 C、、、、 D、、、、5. 为阿伏加德罗常数的值,下列说法正确的是( )A、常温下,中含质子数为 B、标准状况下,中含有的分子数为 C、标准状况下,含有的共价键数目为 D、溶液中含有的分子数目为6. 能正确表示下列反应的离子方程式为( )A、过量溶解在NaOH溶液中: B、和盐酸反应: C、溶于氢碘酸: D、硫酸铜溶液中滴加氨水:7. 下列物质的转化关系(反应条件略去),一步反应不能实现的是( )A、Fe+Cl2→FeCl3 B、Na+O2→Na2O2 C、H2S+O2→SO3 D、NH3+O2→NO8. 下列反应属于吸热反应的是( )A、碘化氢分解 B、二氧化碳和氧化钙化合 C、氢气在氧气中燃烧 D、铝条溶于盐酸9. 镁可在中燃烧: 2Mg+CO2 2MgO+C ,下列说法不正确的是( )A、的电子式:
 B、基态镁原子的电子排布式:
C、第一电离能:Mg<C<O
D、C元素在周期表中位于P区
10. 下列说法错误的是( )A、键与键的电子云图像都呈轴对称 B、s轨道与s轨道不能形成键,p轨道与p轨道能形成键 C、乙烯与乙烷化学性质不同,主要是因为乙烯中的键不如键牢固 D、1,3-丁二烯()分子中含有7个键2个键11. 下列说法错误的是( )A、键能是衡量化学键稳定性的参数之一,键能越大,则化学键就越牢固 B、键长与共价键的稳定性没有关系 C、键角是两个相邻共价键之间的夹角,多原子分子的键角一定,说明共价键有方向性 D、共价键是通过原子轨道重叠并共用电子对而形成的,所以共价键有饱和性12. 下列关于共价键的叙述,正确的是( )A、键键能一定比键键能大,且键与键电子云均为镜面对称 B、键的键长比键长,键的键能是键的两倍 C、分子中有键不一定有键,有键则一定有键 D、含有键的数目为13. 下列关于原子结构与元素周期表的说法正确的是( )A、电负性最大的元素位于周期表的左下角 B、某基态原子的价电子排布式为4s24p1 , 该元素位于周期表第四周期第ⅢA族 C、2s轨道电子云轮廓图呈哑铃形 D、第四能层最多可容纳16个电子14. 工业上常用碳和水蒸气反应制水煤气。在密闭容器中加入一定量的C(s)和H2O(g),发生反应:C(s)+H2O(g)CO(g)+H2(g),下列说法错误的是( )A、用碳粉代替碳块,CO(g)的生成速率增加 B、保持容器体积不变,充入氦气,反应速率增加 C、保持容器体积不变,将CO(g)抽离出来,反应速率减慢 D、升高温度,反应的正、逆速率均增加15. 是常见的水处理剂。实验室利用以下反应制备:
B、基态镁原子的电子排布式:
C、第一电离能:Mg<C<O
D、C元素在周期表中位于P区
10. 下列说法错误的是( )A、键与键的电子云图像都呈轴对称 B、s轨道与s轨道不能形成键,p轨道与p轨道能形成键 C、乙烯与乙烷化学性质不同,主要是因为乙烯中的键不如键牢固 D、1,3-丁二烯()分子中含有7个键2个键11. 下列说法错误的是( )A、键能是衡量化学键稳定性的参数之一,键能越大,则化学键就越牢固 B、键长与共价键的稳定性没有关系 C、键角是两个相邻共价键之间的夹角,多原子分子的键角一定,说明共价键有方向性 D、共价键是通过原子轨道重叠并共用电子对而形成的,所以共价键有饱和性12. 下列关于共价键的叙述,正确的是( )A、键键能一定比键键能大,且键与键电子云均为镜面对称 B、键的键长比键长,键的键能是键的两倍 C、分子中有键不一定有键,有键则一定有键 D、含有键的数目为13. 下列关于原子结构与元素周期表的说法正确的是( )A、电负性最大的元素位于周期表的左下角 B、某基态原子的价电子排布式为4s24p1 , 该元素位于周期表第四周期第ⅢA族 C、2s轨道电子云轮廓图呈哑铃形 D、第四能层最多可容纳16个电子14. 工业上常用碳和水蒸气反应制水煤气。在密闭容器中加入一定量的C(s)和H2O(g),发生反应:C(s)+H2O(g)CO(g)+H2(g),下列说法错误的是( )A、用碳粉代替碳块,CO(g)的生成速率增加 B、保持容器体积不变,充入氦气,反应速率增加 C、保持容器体积不变,将CO(g)抽离出来,反应速率减慢 D、升高温度,反应的正、逆速率均增加15. 是常见的水处理剂。实验室利用以下反应制备:下列说法正确的是( )
A、还原性:大于 B、在反应中被氧化,失电子 C、净水利用了的还原性 D、反应中,每产生22.4L气体,转移电子16. 某温度下,在恒容密闭容器中发生可逆反应:。下列情况中,一定能说明该反应已达到化学平衡状态的是( )A、单位时间内消耗 , 同时消耗 B、混合气体的密度不再发生改变 C、和HI的物质的量浓度之比为 D、密闭容器中的压强保持不变17. 如图所示曲线Ⅰ~Ⅵ分别表示卤素的某种性质与核电荷数的关系,相关判断正确的是( ) A、曲线Ⅰ纵坐标可表示第一电离能 B、曲线Ⅱ纵坐标可表示电负性 C、曲线Ⅲ纵坐标可表示元素最高正化合价 D、曲线Ⅳ纵坐标表示物质熔点18. 价层电子对互斥理论和杂化轨道理论都可以判断、解释分子或离子的空间结构,下列说法正确的是( )A、和的键角相同 B、、中S原子的杂化方式相同 C、、的中心原子价层电子对数相同 D、、都是直线形分子19. 化合物M(结构简式如图所示)是DNA结构的重要组成部分,由原子半径依次增大的短周期元素X、Y、Z、W构成,其中X元素与其他元素不在同一周期,W的一种核素常用于测定文物年代。下列说法正确的是( )
A、曲线Ⅰ纵坐标可表示第一电离能 B、曲线Ⅱ纵坐标可表示电负性 C、曲线Ⅲ纵坐标可表示元素最高正化合价 D、曲线Ⅳ纵坐标表示物质熔点18. 价层电子对互斥理论和杂化轨道理论都可以判断、解释分子或离子的空间结构,下列说法正确的是( )A、和的键角相同 B、、中S原子的杂化方式相同 C、、的中心原子价层电子对数相同 D、、都是直线形分子19. 化合物M(结构简式如图所示)是DNA结构的重要组成部分,由原子半径依次增大的短周期元素X、Y、Z、W构成,其中X元素与其他元素不在同一周期,W的一种核素常用于测定文物年代。下列说法正确的是( ) A、M是共价化合物,分子中每个原子都满足8电子稳定结构 B、最高价氧化物对应水化物酸性:Z>W C、分子的空间结构为直线形 D、X与Y形成的化合物的沸点高于X与W形成的化合物20. 下列说法不正确的是( )A、只要分子的空间结构为平面三角形,中心原子均为杂化 B、中心原子是sp杂化的,其分子的空间结构不一定为直线形 C、当中心原子无孤电子对时,价层电子对互斥模型和分子空间结构就会完全相同 D、杂化轨道不可能形成键21. 下列说法正确的是( )A、1s电子云呈球形,表示电子绕原子核做圆周运动 B、第四周期基态原子未成对电子数为1的元素有4种 C、元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素 D、能级的能量一定高于能级的能量22. 磷酸铁锂()主要用作锂离子电池正极材料,下列说法不正确的是( )A、基态Li原子含有3种不同运动状态的电子 B、Fe在第四周期第Ⅷ族,位于元素周期表ds区 C、基态O原子核外电子占据的最高能级的电子云轮廓图为哑铃形 D、阴离子的VSEPR模型为四面体形23. 下表列出了W、X、Y三种短周期元素的各级电离能数据(用、……表示)。关于W、X、Y三种元素的下列推断中,不正确的是( )
A、M是共价化合物,分子中每个原子都满足8电子稳定结构 B、最高价氧化物对应水化物酸性:Z>W C、分子的空间结构为直线形 D、X与Y形成的化合物的沸点高于X与W形成的化合物20. 下列说法不正确的是( )A、只要分子的空间结构为平面三角形,中心原子均为杂化 B、中心原子是sp杂化的,其分子的空间结构不一定为直线形 C、当中心原子无孤电子对时,价层电子对互斥模型和分子空间结构就会完全相同 D、杂化轨道不可能形成键21. 下列说法正确的是( )A、1s电子云呈球形,表示电子绕原子核做圆周运动 B、第四周期基态原子未成对电子数为1的元素有4种 C、元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素 D、能级的能量一定高于能级的能量22. 磷酸铁锂()主要用作锂离子电池正极材料,下列说法不正确的是( )A、基态Li原子含有3种不同运动状态的电子 B、Fe在第四周期第Ⅷ族,位于元素周期表ds区 C、基态O原子核外电子占据的最高能级的电子云轮廓图为哑铃形 D、阴离子的VSEPR模型为四面体形23. 下表列出了W、X、Y三种短周期元素的各级电离能数据(用、……表示)。关于W、X、Y三种元素的下列推断中,不正确的是( )元素
电离能
……
W
496
4562
6912
9543
X
738
1451
7733
10540
Y
578
1817
2745
11575
A、W元素单质的还原性最强 B、X元素位于元素周期表第ⅡA族 C、最高价氧化物对应水化物的碱性:X>W D、Y元素的最高正化合价为+3价24. 短周期主族元素X、Y、Z、W的原子序数依次增大,其中基态X原子核外电子只有一种运动状态,Y、Z、W位于X的下一周期,四种元素形成的化合物(结构如图)可用于检验;M位于元素周期表第四周期第Ⅷ族,且基态M原子价层含有2个未成对电子。下列说法正确的是( ) A、原子半径:X<Y<Z<W B、第一电离能:Y<W<Z C、电负性:Y<W<Z D、基态M原子核外电子占据最高能级的电子云轮廓图为哑铃形
A、原子半径:X<Y<Z<W B、第一电离能:Y<W<Z C、电负性:Y<W<Z D、基态M原子核外电子占据最高能级的电子云轮廓图为哑铃形二、填空题(本大题共4小题,共52分)
-
25. 习近平总书记指出“要把粮食安全主动权牢牢握在手里”。氨气在农业生产中有广泛的应用。某实验小组设计如图所示装置,制备氨气并验证其性质,回答下列问题:
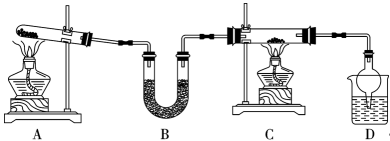 (1)、装置A是氨气发生装置,发生反应的化学方程式为。氨气的水溶液显(填“酸”或“碱”)性。(2)、装置B的名称是 , 下列盛放在B中的药品可以是(填序号)。
(1)、装置A是氨气发生装置,发生反应的化学方程式为。氨气的水溶液显(填“酸”或“碱”)性。(2)、装置B的名称是 , 下列盛放在B中的药品可以是(填序号)。a.P2O5 b.CaCl2 c.碱石灰 d.AlCl3
(3)、装置C中装有氧化铜,通入气体加热后出现光亮的红色固体同时产生的气体是空气的主要成分之一,该反应的方程式是 , 该反应体现氨气的(填“氧化”或“还原”)性。(4)、装置D中,球形管的作用是。利用如图装置完成NH3的喷泉实验,引发喷泉的操作是。 26. 完成下列问题:(1)、写出的电子式: , 它的阳离子价层电子对数为。(2)、Cu的基态原子结构示意图为 , 的价层电子排布图为 , 的价层电子排布式为 , 和较稳定的是(填离子符号),原因是。(3)、乙炔和乙烯分子,它们的键个数之比为 , 乙烯分子中C原子杂化轨道类型为。27. 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据相关信息,回答下列问题:
26. 完成下列问题:(1)、写出的电子式: , 它的阳离子价层电子对数为。(2)、Cu的基态原子结构示意图为 , 的价层电子排布图为 , 的价层电子排布式为 , 和较稳定的是(填离子符号),原因是。(3)、乙炔和乙烯分子,它们的键个数之比为 , 乙烯分子中C原子杂化轨道类型为。27. 现有七种元素,其中A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。请根据相关信息,回答下列问题:A元素的核外电子数和电子层数相等
B元素原子的核外p电子总数比s电子总数少1
核外电子排布与Ne相同
基态D原子价电子层的p轨道半满
E元素的主族序数与周期数的差为4
F是前四周期中电负性最小的元素
G在周期表的第七列
(1)、写出的电子式:。(2)、B元素基态原子中能量最高的电子,其电子云在空间有个取向。(3)、某同学根据上述信息,推断C基态原子的核外电子排布图为 , 该同学所画的电子排布图违背了。 (4)、G元素位于区,该元素的核外电子排布式为。(5)、中心原子的杂化方式为 , 分子空间结构为。(6)、检验F元素的方法是 , 请用原子结构的知识解释产生此现象的原因。28. 下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:
, 该同学所画的电子排布图违背了。 (4)、G元素位于区,该元素的核外电子排布式为。(5)、中心原子的杂化方式为 , 分子空间结构为。(6)、检验F元素的方法是 , 请用原子结构的知识解释产生此现象的原因。28. 下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,回答下列问题:①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
(1)、元素⑩在周期表中的位置是 , 其基态原子价电子轨道表示式为 , 该元素对应基态原子具有种能量不同的电子,具有种运动状态不同的电子。(2)、④、⑤、⑥的简单离子半径由大到小的顺序为(用离子符号和“>”表示)。(3)、②③④⑧⑨的简单气态氢化物中,最稳定的是(用化学式表示,下同),最高价氧化物对应水化物中,酸性最强的是。(4)、⑤的最高价氧化物对应的水化物与⑦的最高价氧化物对应的水化物发生反应的离子方程式为。