云南省昆明市昆八中2023-2024学年高一上学期9月月考化学试卷
试卷更新日期:2023-11-08 类型:月考试卷
一、选择题(每题只有一个正确答案,每题2分,共40分)
-
1. 下列诗文中隐含化学变化的是( )A、月落乌啼霜满天,江枫渔火对愁眠 B、掬水月在手,弄花香满衣 C、飞流直下三千尺,疑是银河落九天 D、举头望明月,低头思故乡2. 下列各组物质中,前者为混合物,后者为单质的是( )A、、 B、盐酸、液氧 C、石油、氨水(氨气水溶液) D、干冰、碘酒3. 下列叙述中正确的是( )A、液态、固体均不导电,所以和均是非电解质 B、、的水溶液均导电,所以、均是电解质 C、铜丝、石墨均导电,所以它们是电解质 D、蔗糖、酒精在水溶液中和熔融时均不导电,所以它们是非电解质4. 下列有关分散系的说法正确的是( )A、胶体是分散系,溶液、乳浊液、悬浊液都不属于分散系 B、云、雾属于气溶胶,其分散质粒子直径介于1~100mm之间 C、胶体区别于其它分散系的本质特征是胶体具有丁达尔效应 D、将浓溶液滴加到饱和溶液中可制备胶体5. 在某澄清透明的酸性溶液中,能共存的离子组是( )A、、、、 B、、、、 C、、、、 D、、、、6. 只用一种试剂,将、、、种物质溶液区分开,这种试剂是( )A、溶液 B、溶液 C、溶液 D、溶液7. 下列离子方程式的书写正确的是( )A、铁跟稀盐酸反应: B、碳酸氢钙溶液中加入盐酸: C、少量通入澄清石灰水中: D、溶液中加入盐酸:8. 已知在酸性溶液中易被还原成 , 且还原性:。下列反应在水溶液中不可能发生的是( )A、 B、 C、 D、9. 用下列方法均可制得氯气:
①
②
③
若要制得相同质量的氯气,①②③反应中电子转移数目之比为( )
A、6:5:6 B、1:3:5 C、15:5:3 D、1:6:1010. 某研究小组欲分析某矿石的主要成分,粉碎后将其溶于过量稀盐酸中充分反应,过滤后用所得溶液进行如下实验,下列说法正确的是( )A、取少量滤液向其滴加少量溶液,无白色沉淀,说明矿石中一定不含 B、取少量滤液向其中滴加过量溶液,产生白色沉淀,说明矿石中含有 C、取少量滤液,向其中滴加适量溶液,产生白色沉淀,说明矿石中一定含有 D、取少量滤液向其加入硝酸酸化的硝酸银,产生白色沉淀,说明矿石中一定有11. 在两份相同的溶液中,分别滴入物质的量浓度相等的、溶液,其导电能力随滴入溶液体积变化的曲线如图所示。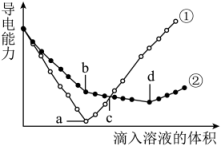
下列分析不正确的是( )
A、①代表滴加溶液的变化曲线 B、b点,溶液中大量存在的离子是、 C、c点,两溶液中含有相同量的 D、a、d两点对应的溶液均显中性12. 将气体与足量溶液完全反应后,再加入溶液,发生如下两个化学反应: , , 有关说法正确的是( )A、还原性 B、氧化性 C、两个反应中均作还原剂 D、能将氧化成13. 某溶液中大量存在以下五种离子:、、、、M,它们的个数之比为 , 则M可能为( )(具有强氧化性)A、 B、 C、 D、14. 下列化学方程式中,表示电子转移的方向和数目都正确的是( )A、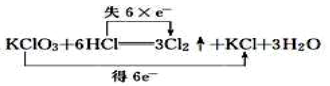 B、
B、 C、
C、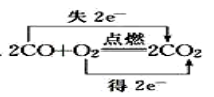 D、
D、 15. 下列关于物质分类的正确组合是( )
15. 下列关于物质分类的正确组合是( )分类组合
碱
酸
盐
碱性氧化物
酸性氧化物
A
纯碱
B
C
D
熟石灰
A、A B、B C、C D、D16. 在甲、乙两烧杯溶液中,分别含有大量的、、、、、中的三种,已知甲烧杯的溶液呈蓝色,则乙烧杯的溶液中大量存在的离子是( )A、、、 B、、、 C、、、 D、、、17. 在一定条件下,和可发生如下反应: , 从而可知在中,元素R的化合价是( )A、价 B、价 C、价 D、价18. 反应①②分别是从海藻灰和某种矿石中提取碘的主要反应:① ;② 。下列说法正确的是( )A、两个反应中硫元素均被氧化 B、碘元素在反应①中被还原,在反应②中被氧化 C、氧化性: D、反应①②中生成等量的 时,转移电子数之比为1:519. 某无色透明的溶液a中可能含有、、、、和中的一种或几种离子,为了确定该溶液的组成,取一定体积的上述溶液进行如下实验,下列说法正确的是( ) A、“白色沉淀1”和“白色沉淀2”中都含有 B、加入时会发生反应 C、“溶液a”中可能存在和 D、向“溶液2”中滴加稀酸化的溶液,若产生白色沉淀说明“溶液a”中含有20. 铅丹()可作防锈用涂料,其中铅的化合价为价和价,它与浓盐酸反应的化学方程式为。下列说法正确的是( )A、与浓盐酸反应时,作为还原剂 B、物质的氧化性: C、中价的铅与价的铅的个数之比为2:1 D、当上述反应中消耗1个时,转移电子数为1个
A、“白色沉淀1”和“白色沉淀2”中都含有 B、加入时会发生反应 C、“溶液a”中可能存在和 D、向“溶液2”中滴加稀酸化的溶液,若产生白色沉淀说明“溶液a”中含有20. 铅丹()可作防锈用涂料,其中铅的化合价为价和价,它与浓盐酸反应的化学方程式为。下列说法正确的是( )A、与浓盐酸反应时,作为还原剂 B、物质的氧化性: C、中价的铅与价的铅的个数之比为2:1 D、当上述反应中消耗1个时,转移电子数为1个二、非选择题(共60分)
-
21. 现有以下物质:a.溶液,b.液氨,c.固体,d. , e.胶体,f.铜,g. , h.。(1)、①以上物质中属于非电解质的是(填字母)。
②写出d在水溶液中电离方程式:。
③在足量d的水溶液中加入少量c的水溶液,发生反应的离子方程式为。
④在含a的水溶液中缓缓通少量 , 该过程的离子反应方程式为。
(2)、向煮沸的蒸馏水中逐滴加入饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可制得胶体。①制取胶体的离子方程式为。
②下列描述的分别是胶体的性质或现象,请按要求填空:
A.胶体的聚沉 B.胶体的电泳 C.丁达尔效应
区分胶体和溶液的方法是(填字母,下同);“卤水点豆腐”,利用的性质是;工厂采用高压静电除尘,利用的胶体性质是。
22.(1)、Ⅰ.饮用水中的会对人类健康产生危害,为了降低饮用水中的浓度,某饮用水研究人员提出,在碱性条件下用铝粉将还原为 , 其化学方程式为。请回答下列问题:
上述反应中,(填元素名称,下同)元素的化合价升高,则该元素的原子(填“得到”或“失去”)电子;元素的化合价降低,则该元素的原子(填“被氧化”或“被还原”)。(2)、用单线桥法表示该反应中电子转移的方向和数目:。(3)、每生成1份氮气,转移份电子。(4)、Ⅱ.针对以下A~D四个涉及的反应填空:A.
B.
C.
D.
仅体现氧化性的是(填序号,下同),仅体现还原性的是 , 既体现氧化性又体现还原性的是 , 既不作氧化剂又不作还原剂的是。23.(1)、Ⅰ.写出下列反应的离子方程式:
鸡蛋壳溶解在醋酸中;(2)、溶液与溶液混合。(3)、Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其中可能含有、、、、、、中的若干种。然后又作了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2mL该溶液用溶液和稀盐酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
原溶液中一定存在的离子是 , 一定不存在的离子是。(4)、按上述实验操作,(填“能”或“不能”)确定原溶液中有 , 若不能请说明原因:。24.(1)、Ⅰ.高铁酸钾()是一种新型、高效、多功能绿色水处理剂,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入至饱和,使高铁酸钾析出。
干法制备高铁酸钠的主要反应为: , 该反应中是(填氧化剂、还原剂,是氧化剂又是还原剂)(2)、湿法制备高铁酸钾的反应体系中有六种微粒:、、、、、。①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:。
②若反应过程中转移了0.3个电子,则还原产物的个数为。
(3)、Ⅱ.已知: , 。
含有1份和2份的溶液中通入2份 , 此时被氧化的离子是份。(4)、若向含a份和b份的溶液中通入c份 , 当、、完全被氧化时,(用含a、b的代数式表示)。