湖南省长沙市重点高中2023-2024学年高三上学期第三次阶段性测试化学试题
试卷更新日期:2023-11-08 类型:月考试卷
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一个项是符合题目要求的)
-
1. 我们的生活与化学密切相关。下列叙述正确的是( )A、氢燃料汽车是利用电解池的原理提供电能 B、石油分馏出来的各馏分仍是多种烃的混合物 C、苏打常用于治疗胃酸过多 D、“葱油粑粑”中的“油”属于酯类,是高分子2. 下列化学用语表达正确的是( )A、2-丁烯的键线式:
 B、中子数为10的氧原子:
C、的电子式:
D、的中心原子的杂化轨道类型:
3. 设为阿伏加德罗常数的值,下列说法不正确的是( )A、浓度均为的溶液和溶液中数目均为 B、和于密闭容器中充分反应后,分子总数为 C、溶液中阴阳离子总数大于 D、常温常压下,与混合物中含有的氧原子数目为4. “摩尔盐”是分析化学中的重要试剂,化学式为。下列有关说法正确的是( )A、在的溶液中,还可大量共存 B、常温下,在溶液中,水电离出的可能为 C、检验溶液中反应的离子方程式为: D、往摩尔盐溶液中滴入溶液使恰好完全沉淀(隔绝空气)的离子反应为:5. 下列操作或装置(略去部分夹持仪器)能达到预期目的的是( )
B、中子数为10的氧原子:
C、的电子式:
D、的中心原子的杂化轨道类型:
3. 设为阿伏加德罗常数的值,下列说法不正确的是( )A、浓度均为的溶液和溶液中数目均为 B、和于密闭容器中充分反应后,分子总数为 C、溶液中阴阳离子总数大于 D、常温常压下,与混合物中含有的氧原子数目为4. “摩尔盐”是分析化学中的重要试剂,化学式为。下列有关说法正确的是( )A、在的溶液中,还可大量共存 B、常温下,在溶液中,水电离出的可能为 C、检验溶液中反应的离子方程式为: D、往摩尔盐溶液中滴入溶液使恰好完全沉淀(隔绝空气)的离子反应为:5. 下列操作或装置(略去部分夹持仪器)能达到预期目的的是( )



该图为实验室制取氨气的装置
实验室用该图装置制备氢氧化铁胶体
碱式滴定管排气操作,排气后记录初始读数
验证非金属性:
A
B
C
D
A、A B、B C、C D、D6. 是一种极强的氧化剂,在酸性或碱性介质下均能将溶解,得到紫色溶液。其中一种制备流程如图:
下列说法正确的是( )
A、“还原”过程反应的环境为强碱性介质 B、“还原”过程中消耗葡萄糖和物质的量之比为 C、“制备”过程中发生的离子方程式为: D、在碱性介质下,的氧化性强于7. 钠硫电池作为一种新型化学电源,具有体积小、容量大、寿命长、效率高等重要优点,其结构与工作原理如图所示:下列说法错误的是( ) A、放电过程中,极为电源负极 B、放电过程中,电池总反应为 C、充电过程中,由极移动到极 D、充电过程中,外电路中流过电子,负极材料理论上增重8. 对于可逆反应 , 下列各项对示意图的解释与图像相符的是( )
A、放电过程中,极为电源负极 B、放电过程中,电池总反应为 C、充电过程中,由极移动到极 D、充电过程中,外电路中流过电子,负极材料理论上增重8. 对于可逆反应 , 下列各项对示意图的解释与图像相符的是( ) A、①压强对反应的影响 B、②温度对该反应中平衡转化率的影响 C、③恒容平衡体系增大对反应的影响 D、④催化剂对反应的影响9. 周南化学兴趣小组对的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下浓度随时间变化如图所示:
A、①压强对反应的影响 B、②温度对该反应中平衡转化率的影响 C、③恒容平衡体系增大对反应的影响 D、④催化剂对反应的影响9. 周南化学兴趣小组对的分解速率影响因素进行研究。在相同温度下,实验测得不同条件下浓度随时间变化如图所示:
下列说法不正确的是( )
A、图甲表明,可通过适当增大浓度,加快分解速率 B、图乙表明,可通过调节溶液的酸碱性,控制分解速率快慢 C、图丙表明,少量存在时,碱性太强,不利于分解 D、图乙、图丙和图丁表明,是分解的催化剂,提高的浓度就能增大分解速率10. 只改变一个条件,化学反应的变化图象如下(其中表示的平衡转化率):
下列说法不正确的是( )
A、由图甲可知,若 , 则为非气体 B、由图乙可知, C、由丙图可知,点时, D、由丁图可知,该反应的11. 丙烷氧化脱氢法可以制备丙烯,主要反应如下:。在催化剂作用下,氧化脱氢除生成外,还生成等物质,的转化率和的产率与温度变化关系如下图1:研究人员以铬的氧化物为催化剂,利用的弱氧化性,开发丙烷氧化脱氢制丙烯的新工艺,该工艺反应机理如下图2所示。
下列说法不正确的是( )
A、对于丙烷制备丙烯的主要反应,增大氧气浓度可以提高的转化率 B、时,的选择性为(的选择性) C、图2的第ⅰ步反应中只有键的断裂和形成 D、图2总反应化学方程式为12. 在工业上,电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。利用工业废水发电进行氨的制备(纳米作催化剂)的原理如图所示,其中电极均为惰性电极。
已知:极区发生的变化视为按两步进行,其中第二步为(未配平)。下列说法错误的是( )
A、极是负极,发生的电极反应为 B、在极发生电极反应: C、理论上废水发电产生的与合成消耗的的物质的量之比为 D、上述废水发电在高温下进行优于在常温下进行13. 草酸为二元弱酸,其电离过程为: , 。常温下向溶液中逐滴加入溶液,混合溶液中和的物质的量分数(随变化关系如图所示:
下列说法正确的是( )
A、草酸的一级电离平衡常数的数量级为 B、曲线Ⅰ表示的物质的量分数 C、当加入溶液的体积为时,溶液中存在如下关系: D、时,对应的溶液中存在关系:14. 用还原不仅可以消除污染,而且可以得到单质 , 反应如下:。时,在容积为的恒容密闭容器中测得反应在不同时刻各物质的物质的量如下表:物质的量时间物质
0
2
4
6
8
10
4.8
2.64
1.8
1.8
2.1
2.1
0
1.08
1.5
1.5
1.75
1.75
下列说法不正确的是( )
A、前的平均反应速率 B、时的转化率等于时的转化率 C、其它条件不变,在第后降低温度,可使容器中的的浓度升高到 D、向容器内通入适量的 , 会使平衡逆向移动二、非选择题(本题共4小题,共58分)
-
15. 氮化铬熔点高、硬度大,常用作耐磨材料。周南化学兴趣小组在实验室用无水氯化铬与氨气在高温下反应制备氮化铬。回答下列问题:(1)、【实验一】制备无水氯化铬
反应原理为:。相关实验装置如图(夹持装置略)
已知:①的沸点是。 ②有毒,遇水发生水解反应。

实验的主要操作步骤有:a.水浴加热并维持的温度在
b.点燃处酒精喷灯,使瓷舟温度升至左右,反应一定时间
c.打开 , 通入并保证锥形瓶中每分钟有250个左右的气泡逸出
d.一段时间后停止通入
e.先后停止加热A、B,冷却,并继续通入一段时间的
上述操作步骤的先后顺序为: .(2)、D中盛有过量溶液,用离子反应方程式说明的作用: .(3)、比较分子中键角大小:(填“>”“<”或“=”)。(4)、【实验二】制备氮化铬周南化学兴趣小组设计如图装置在实验室制备氮化铬(加热及夹持装置略)。
a仪器的名称:。(5)、写出E中所发生反应的化学方程式:。(6)、F的作用为。(7)、【实验三】测产品氮化铬的纯度向所得产品中加入足量氢氧化钠溶液(杂质与氢氧化钠溶液不反应),然后通入水蒸气将氨气全部蒸出,将氨气用溶液完全吸收,剩余的硫酸用溶液恰好中和,则所得产品中氮化铬的纯度为 .
16. 烟道灰中含有等,分离回收其中的金属资源可有效缓解矿藏资源不足的问题。分离回收时的流程如下: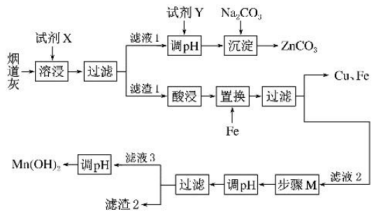
已知:
①该工艺条件下,溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示.
金属离子
开始沉淀的
7.0
1.9
8.1
完全沉淀的
9.0
3.2
10.1
②的化学性质与相似。常温下,水溶液中不同形式含锌微粒物质的量浓度的对数与的关系如图所示。
回答下列问题:
(1)、基态原子、原子核外未成对电子数之比为 .(2)、试剂X可能为____.A、溶液 B、氨水 C、溶液 D、稀(3)、步骤的目的是;(4)、步骤后应调节的范围为;不同 , 含微粒在体系中的存在形式不同,依据图数据,求该温度下的为 .(5)、在空气中易被氧化为 , 反应的化学方程式为 .(6)、某实验室设计了如图b所示装置,通过通入来制备。双极膜是阴、阳复合膜,层间的解离成和并可分别通过阴、阳膜定向移动。石墨电极反应式为 .
 17.(1)、Ⅰ、煤是重要的化工原料,利用煤的气化、液化可制取甲醇等有机物,其中发生的反应有:
17.(1)、Ⅰ、煤是重要的化工原料,利用煤的气化、液化可制取甲醇等有机物,其中发生的反应有:①
②
相关物质的化学键键能数据如下:
化学键
703
355
465
516
583
试计算该反应 .
(2)、Ⅱ、“绿水青山,就是金山银山”,环境问题已被受全球广泛关注。氮的氧化物是大气主要污染物之一,环境保护的重要任务之一就是减少氮的氧化物等污染物在大气中的排放。
查有关资料可知:的反应历程分两步:
第一步:(快) ;
;
第二步:(慢) ;
;
一定条件下,当反应达到平衡状态时:①可用、、、表示该反应的平衡常数,其表达式为;
②已知:上述反应的平衡常数的对数随温度的变化如图所示,在温度为时此反应在点达到平衡。若升高温度,B、C、D、E四点中能正确表示该反应的与的关系的点为 .
 (3)、是一种新型硝化剂,人们对它的性质和制备广泛关注。已知:在时可发生分解:。此温度下,测得恒容密闭容器中浓度随时间的变化如下表:
(3)、是一种新型硝化剂,人们对它的性质和制备广泛关注。已知:在时可发生分解:。此温度下,测得恒容密闭容器中浓度随时间的变化如下表:0
10
20
2.5
1.5
1.3
①内,用来表示的平均化学反应速率为;
②在此温度下,于恒容密闭容器中充入进行此反应,能说明该反应已达到化学平衡状态的是(填字母)
a.
b.和的浓度之比保持不变
c.在绝热容器中,反应的平衡常数不再变化
d.容器内气体的平均相对分子质量为45,且保持不变
(4)、将一定量的加入到恒温恒压的密闭容器中(温度、压强)。在反应中,正反应速率 , 逆反应速率 , 其中、为速率常数,p为分压(分压=总压×物质的量分数),若该条件下 , 当的分解时, .(5)、将一定量加入恒容密闭容器中,发生反应。测得在不同温度下,的物质的量分数如图所示。已知的起始压强为 , 试计算图中a点对应温度下以平衡分压来表示的平衡常数 . 18. 以芳香族化合物A为原料制备某药物中间体G的路线如图:
18. 以芳香族化合物A为原料制备某药物中间体G的路线如图:
已知:①同一碳原子上连两个羟基时不稳定,易发生反应:。
②
③

请回答下列问题:
(1)、C→D的反应类型是。(2)、C的分子式为 , G中含氧官能团的名称为。(3)、E的结构简式为。(4)、F→G的化学方程式为。(5)、H是D的同分异构体,同时满足下列条件的H有种(不包括立体异构)。①遇氯化铁溶液发生显色反应;②能发生水解反应;③苯环上只有两个取代基。
其中,核磁共振氢谱显示4组峰,且峰的面积之比为3∶2∶2∶1的结构简式为(写一种即可)。
(6)、根据上述路线中的相关知识,设计以 和乙酸为原料制备
和乙酸为原料制备 的合成路线。(无机试剂任选)
的合成路线。(无机试剂任选)