黑龙江省哈尔滨市道外区2023-2024学年高二上学期第一次考试化学试题
试卷更新日期:2023-11-07 类型:月考试卷
一、选择题(每题只有一个正确答案,每题3分,共54分)
-
1. 改革开放40多年来,我国材料化学的发展为科技进步做出了突出贡献。下列有关材料的说法不正确的是( )A、二水氯化钙(CaCl2▪2H2O)属于纯净物 B、“纳米”铜比表面积大,可与盐酸剧烈反应生成H2 C、碳纳米管与石墨互为同素异形体 D、将"纳米材料"粒子分散到液体分散剂中所得混合物有丁达尔效应2. 下列叙述中不正确的是( )A、蔗糖与麦芽糖互为同分异构体 B、向鸡蛋清溶液中加入饱和硫酸铵溶液,有固体析出,属于盐析 C、氨基酸分子中既含有羧基又含有氨基 D、天然油脂的主要成分是高级脂肪酸甘油酯,没有恒定的熔沸点,属于高分子化合物3. 某澄清透明溶液,能与NaHCO3反应,此溶液中可能大量共存的离子组是( )A、、Na+、Cl-、Cu2+ B、、Na+、、K+ C、、Mg2+、ClO-、Ba2+ D、Ca2+、Cl-、Fe2+、4. 化学与生活密切相关,下列叙述错误的是( )A、青铜和陶瓷制品均为无机非金属材料 B、二氧化硅是光纤制品的基本原料 C、华为手机芯片麒麟990主要原材料是硅单质 D、被称为“黑金”的新型纳米材料石墨烯属于新型无机非金属材料5. 用下图所示装置制备氯化铜并探究氯气的某些性质,下列说法错误的是( )
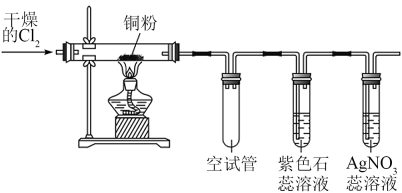 A、加热之前应通入干燥的氯气排出装置中的空气 B、空试管没有用处,可以去掉 C、持续通入氯气后紫色石蕊溶液变红 D、为防止氯气污染环境,实验装置末端处应连接一个尾气处理装置6. 某微型实验装置(夹持仪器已省略)如图所示,其中a棉球蘸有品红溶液,b棉球蘸有含酚酞的溶液,c棉球蘸有与淀粉的混合溶液。实验时将滴入装有固体的培养皿中。下列说法错误的是( )
A、加热之前应通入干燥的氯气排出装置中的空气 B、空试管没有用处,可以去掉 C、持续通入氯气后紫色石蕊溶液变红 D、为防止氯气污染环境,实验装置末端处应连接一个尾气处理装置6. 某微型实验装置(夹持仪器已省略)如图所示,其中a棉球蘸有品红溶液,b棉球蘸有含酚酞的溶液,c棉球蘸有与淀粉的混合溶液。实验时将滴入装有固体的培养皿中。下列说法错误的是( )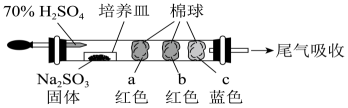 A、a棉球会变白,微热后变红 B、b棉球变为白色,离子反应为: C、c棉球变为白色,说明具有漂白性 D、若将试剂改为浓和固体反应产生Cl2 , a、b处棉球也会变白色7. 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。已知其燃烧时P被氧化为P4O10 , 下列有关P4S3的说法中不正确的是( )
A、a棉球会变白,微热后变红 B、b棉球变为白色,离子反应为: C、c棉球变为白色,说明具有漂白性 D、若将试剂改为浓和固体反应产生Cl2 , a、b处棉球也会变白色7. 三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如图所示。已知其燃烧时P被氧化为P4O10 , 下列有关P4S3的说法中不正确的是( ) A、P4S3中既含离子键又含共价键 B、P4S3属于共价化合物 C、1molP4S3分子中含有9mol共价键 D、P4S3充分燃烧的化学方程式为P4S3+8O2P4O10+3SO28. 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,80gSO3的体积为22.4L B、标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA C、已知反应:2NH3+NO+NO2=2N2+3H2O,每生成28gN2转移的电子数目为3NA D、58.5gNaCl中含有NA个NaCl分子9. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
A、P4S3中既含离子键又含共价键 B、P4S3属于共价化合物 C、1molP4S3分子中含有9mol共价键 D、P4S3充分燃烧的化学方程式为P4S3+8O2P4O10+3SO28. 用NA表示阿伏加德罗常数的值。下列叙述正确的是( )A、标准状况下,80gSO3的体积为22.4L B、标准状况下,2.24LCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA C、已知反应:2NH3+NO+NO2=2N2+3H2O,每生成28gN2转移的电子数目为3NA D、58.5gNaCl中含有NA个NaCl分子9. 部分含铁物质的分类与相应化合价关系如图所示。下列推断不合理的是( ) A、在水溶液中,a可与e反应生成b B、b既可被氧化,也可被还原 C、可将e的溶液加入NaOH溶液中制得d(OH)3胶体 D、可存在b→c→d→e→b的循环转化关系10. 下列关于元素和元素周期表的叙述正确的是( )A、周期表包含元素最多的族是第Ⅷ族 B、ⅠA族元素与ⅥA族元素间形成的化合物可能不只一种 C、质子数相同的粒子一定是同种元素 D、用中文"馍"命名第115号元素在周期表中位于第七周期第14列11. 下列说法正确的是( )A、分子式为C3H6与C6H12的两种有机物一定互为同系物 B、正戊烷分子中所有的碳原子均在同一条直线上 C、可用酸性高锰酸钾溶液来除去甲烷中混有的少量乙烯 D、异戊烷的一氯代物有4种12. 硫化氢(H2S)是一种有毒、有害的不良气体。处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是( )
A、在水溶液中,a可与e反应生成b B、b既可被氧化,也可被还原 C、可将e的溶液加入NaOH溶液中制得d(OH)3胶体 D、可存在b→c→d→e→b的循环转化关系10. 下列关于元素和元素周期表的叙述正确的是( )A、周期表包含元素最多的族是第Ⅷ族 B、ⅠA族元素与ⅥA族元素间形成的化合物可能不只一种 C、质子数相同的粒子一定是同种元素 D、用中文"馍"命名第115号元素在周期表中位于第七周期第14列11. 下列说法正确的是( )A、分子式为C3H6与C6H12的两种有机物一定互为同系物 B、正戊烷分子中所有的碳原子均在同一条直线上 C、可用酸性高锰酸钾溶液来除去甲烷中混有的少量乙烯 D、异戊烷的一氯代物有4种12. 硫化氢(H2S)是一种有毒、有害的不良气体。处理某废气中的H2S,是将废气与空气混合通入FeCl2、CuCl2、FeCl3的混合液中,其转化的流程如图所示。下列说法正确的是( )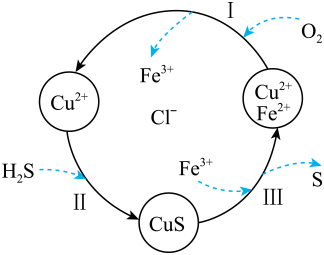 A、转化过程中参与循环的离子只有Fe2+ B、转化过程有四种元素的化合价发生了变化 C、过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ D、氧化性由强到弱的顺序:S>Fe3+>O213. 下列反应一定属于放热反应的是( )
A、转化过程中参与循环的离子只有Fe2+ B、转化过程有四种元素的化合价发生了变化 C、过程Ⅲ中发生的反应为CuS+2Fe3+=S+2Fe2++Cu2+ D、氧化性由强到弱的顺序:S>Fe3+>O213. 下列反应一定属于放热反应的是( ) A、Ba(OH)2·8H2O晶体和NH4Cl晶体的反应 B、能量变化如图所示的反应 C、不需要加热就能发生的反应 D、化学键断裂吸收的能量比化学键形成放出的能量少的反应14. 五种短周期元素(用字母表示)在周期表中的相对位置如下,其中Y的单质在空气中含量最高。下列判断正确的是( )
A、Ba(OH)2·8H2O晶体和NH4Cl晶体的反应 B、能量变化如图所示的反应 C、不需要加热就能发生的反应 D、化学键断裂吸收的能量比化学键形成放出的能量少的反应14. 五种短周期元素(用字母表示)在周期表中的相对位置如下,其中Y的单质在空气中含量最高。下列判断正确的是( )X
Y
Z
M
R
A、气态氢化物稳定性:X>Y B、最高价氧化物的水化物的酸性:M>Y C、R的氧化物的水化物是离子化合物 D、Z、M、R的原子半径依次减小,最高化合价依次升高15. 为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:下列说法不正确的是( )
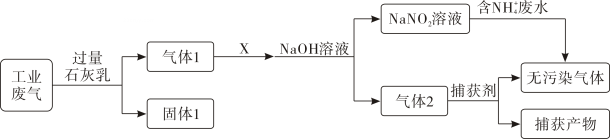 A、固体1中主要含有Ca(OH)2、CaCO3、CaSO3 B、X可以是空气,且需过量 C、捕获剂所捕获的气体主要是CO D、处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O16. 某有机物
A、固体1中主要含有Ca(OH)2、CaCO3、CaSO3 B、X可以是空气,且需过量 C、捕获剂所捕获的气体主要是CO D、处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-=N2↑+2H2O16. 某有机物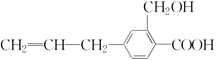 ,其可能具有的性质是( )
,其可能具有的性质是( ) ①能发生加成反应;②能使酸性高锰酸钾溶液褪色;③能发生取代反应;④能发生中和反应;⑤能发生氧化反应。
A、全部 B、只能发生①③④ C、除⑤外都能 D、除④⑤外都能17. 科学家开发出的固体电解质可以提升锂-硫电池的放电性能(如图)。下列说法正确的是( ) A、a极为负极 B、该离子交换膜仅允许阴离子通过 C、a极的电极反应式为 D、当b极上消耗14gLi时,转移1mol电子18. 类比推理是化学中常用的思维方法,下列推理合理的是( )
A、a极为负极 B、该离子交换膜仅允许阴离子通过 C、a极的电极反应式为 D、当b极上消耗14gLi时,转移1mol电子18. 类比推理是化学中常用的思维方法,下列推理合理的是( )选项
已知
推理
A
电解熔融的MgCl2冶炼镁
电解熔融的AlCl3也能冶炼铝
B
Fe与S能直接化合生成FeS
Cu和S也能直接化合生成CuS
C
25℃时溶解度:CaCO3<Ca(HCO3)2
25℃时溶解度:Na2CO3<NaHCO3
D
CO2能使澄清石灰水变浑浊
SO2也能使澄清石灰水变浑浊
A、A B、B C、C D、D二、填空题
-
19. 丙烯酸乙酯天然存在于菠萝等水果中,是一种食品用合成香料,可以用乙烯、丙烯等石油化工产品为原料进行合成:
 (1)、由丙烯生成有机物B的化学反应的类型是。(2)、有机物A与Na反应的化学方程式为。(3)、有机物B中含有的官能团是(填名称),A与B反应生成丙烯酸乙酯的化学方程式是 , 该反应的类型是。(4)、久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。请用化学方程式表示上述聚合过程(5)、根据丙烯酸的结构判断,丙烯酸可能发生的反应有____(填正确答案标号)。
(1)、由丙烯生成有机物B的化学反应的类型是。(2)、有机物A与Na反应的化学方程式为。(3)、有机物B中含有的官能团是(填名称),A与B反应生成丙烯酸乙酯的化学方程式是 , 该反应的类型是。(4)、久置的丙烯酸乙酯自身会发生聚合反应,所得聚合物具有较好的弹性,可用于生产织物和皮革处理剂。请用化学方程式表示上述聚合过程(5)、根据丙烯酸的结构判断,丙烯酸可能发生的反应有____(填正确答案标号)。①中和反应 ②取代反应 ③加成反应 ④氧化反应
A、①③ B、①②③ C、①③④ D、①②③④20. NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
回答下列问题:
(1)、NaClO2中Cl的化合价为 .(2)、写出“反应”步骤中生成ClO2的化学方程式 .(3)、“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+ , 要加入的试剂分别为、 . “电解”中阴极反应的主要产物是 .(4)、“尾气吸收”是吸收“电解”过程排出的少量ClO2 . 此吸收反应中,氧化剂与还原剂的物质的量之比为 , 该反应中氧化产物是 .(5)、“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力.NaClO2的有效氯含量为 . (计算结果保留两位小数)21.(1)、 I.在一定温度下,在容积为5.0L的密闭容器中发生如下反应:N2(g)+3H2(g)2NH3(g),起始时,充入的N2和H2的物质的量分别是3.0mol和6.0mol,2min达化学平衡状态,此时生成NH3的物质的量与总物质的量之比为2:5。试求:
计算2min内N2的平均反应速率为g/min。(2)、H2的转化率是(3)、平衡时混合气体中N2的体积分数是(4)、下列叙述中能说明上述反应达到平衡状态的是____A、反应中N2与H2的物质的量之比为1:3 B、混合气体的总质量不随时间的变化而变化 C、混合气体的总物质的量不随时间的变化而变化 D、2v(N2)=v(NH3) E、混合气体的压强不随时间的变化而变化 F、H2的转化率达到最大,且保持不变(5)、以下能使此反应速率加快的措施是①通过减小容器体积增大压强 ②升高温度
③恒压条件通入He ④恒容条件下通入N2
(6)、Ⅱ.电动汽车上用的铅蓄电池是以一组充满海绵状态铅的铅板和另一组结构相似的充满二氧化铅的铅板组成,用H2SO4作电解质溶液。放电时总反应为Pb+PbO2+2H2SO4=2PbSO4+2H2O。①写出放电时负极的电极反应式:(注:PbSO4不溶于水)
②铅蓄电池放电时,负极质量将(填"增大""减小"或"不变")。当外电路上有2mol电子通过时,溶液中消耗H2SO4的物质的量为。