黑龙江省哈尔滨师范顶级名校2023-2024学年高三上学期第二次调研化学考试
试卷更新日期:2023-11-07 类型:月考试卷
一、选择题(本题包括15题,每题有一个正确答案,共45分)
-
1. 《新修本草》是我国古代中药学著作之一,其中关于“青矾”的描述为:“本来绿色,新出窟未见风者,正如琉璃……,烧之赤色……”,则“青矾”的主要成分是( )A、 B、 C、 D、2. 下列叙述正确的是( )A、物质按照组成可以分为单质和化合物 B、氢氧化铁胶体带正电荷,土壤胶体带负电荷 C、无机化合物主要包括:酸、碱、盐和氧化物 D、按照树状分类法可将化学反应分为:氧化还原反应和离子反应3. 下列关于钠及其化合物的说法不正确的是( )A、钠通常保存在煤油中 B、过氧化钠长期露置于空气中最终会变成氢氧化钠 C、氢氧化钠固体称量时应放在烧杯或其他玻璃器皿中 D、向饱和碳酸钠溶液中通入二氧化碳气体会产生细小晶体4. 化学与生活、生产、环境等密切相关。下列说法不正确的是( )A、乙醇、含氯消毒剂、过氧乙酸均可以有效灭活新型冠状病毒 B、冬奥会短道速滑“战衣”含有聚氨基甲酸酯纤维材料,是一种合成有机高分子化合物 C、二氧化碳、二氧化氮和二氧化硫是大气主要污染物,所以它们的含量是空气质量报告的主要项目 D、天然气是一种清洁的燃料,它作为化工原料则主要用于合成氨和生产甲醇等5. 价类二维图是学习元素化合物的工具,a~g分别表示氮元素的不同价态所对应的物质,其关系如图所示。下列说法正确的是( )
 A、f属于强碱 B、b能支持呼吸 C、e可用于实验室制H2 D、可用湿润的红色石蕊试纸检验a6. 下列化学用语表达正确的是( )A、乙烯的实验式: B、水分子间的氢键: C、的空间结构:平面三角形 D、在元素周期表的位置:第四周期第ⅤB族7. 下列对应离子方程式书写正确的是( )A、向酸性高锰酸钾溶液中滴加双氧水:2MnO+H2O2+6H+=2Mn2++4H2O+3O2↑ B、已知酸性强弱顺序:H2CO3>HCN>HCO , 则向NaCN溶液中通入少量CO2:2CN-+CO2+H2O=2HCN+CO C、向Fe(NO3)2溶液中滴加盐酸,有气泡产生:3Fe2++NO+4H+=3Fe3++NO↑+2H2O D、向淀粉KI溶液中滴加“84”消毒液,溶液变蓝:2I-+ClO-+2H+=I2+Cl-+H2O8. 中科院通过调控N-carbon的孔道结构和表面活性位构型,成功实现了电催化生成甲酸和乙醇,合成过程如图所示。用表示阿伏加德罗常数的值,下列叙述正确的是( )
A、f属于强碱 B、b能支持呼吸 C、e可用于实验室制H2 D、可用湿润的红色石蕊试纸检验a6. 下列化学用语表达正确的是( )A、乙烯的实验式: B、水分子间的氢键: C、的空间结构:平面三角形 D、在元素周期表的位置:第四周期第ⅤB族7. 下列对应离子方程式书写正确的是( )A、向酸性高锰酸钾溶液中滴加双氧水:2MnO+H2O2+6H+=2Mn2++4H2O+3O2↑ B、已知酸性强弱顺序:H2CO3>HCN>HCO , 则向NaCN溶液中通入少量CO2:2CN-+CO2+H2O=2HCN+CO C、向Fe(NO3)2溶液中滴加盐酸,有气泡产生:3Fe2++NO+4H+=3Fe3++NO↑+2H2O D、向淀粉KI溶液中滴加“84”消毒液,溶液变蓝:2I-+ClO-+2H+=I2+Cl-+H2O8. 中科院通过调控N-carbon的孔道结构和表面活性位构型,成功实现了电催化生成甲酸和乙醇,合成过程如图所示。用表示阿伏加德罗常数的值,下列叙述正确的是( ) A、标准状况下,中所含质子的数目为 B、常温常压下,分子中所含键的数目为 C、甲酸和乙醇的混合物所含氢原子的数目一定为 D、电催化过程中,每生成甲酸,转移电子的数目为9. 格氏试剂(RMgX)与醛、酮反应是制备醇的重要途径。Z的一种制备方法如图:
A、标准状况下,中所含质子的数目为 B、常温常压下,分子中所含键的数目为 C、甲酸和乙醇的混合物所含氢原子的数目一定为 D、电催化过程中,每生成甲酸,转移电子的数目为9. 格氏试剂(RMgX)与醛、酮反应是制备醇的重要途径。Z的一种制备方法如图:
下列说法不正确的是( )
A、以CH3COCH3、CH3MgBr和水为原料也可制得Z B、Y分子与Z分子中均含有手性碳原子 C、Z易溶于水是因为Z分子与水分子之间能形成氢键 D、X中碳原子的杂化轨道类型为sp3和sp210. 下列关于各种物质的工业制法的说法中正确的是( )A、工业制溴:利用氯气将海水中的溴离子氧化后,鼓入热空气或水蒸气将溴吹出 B、工业制钠:电解饱和NaCl溶液,收集阴极产生的Na C、工业制铝:电解熔融的AlCl3 , 收集阴极产生的Al D、工业制硫酸:在沸腾炉中煅烧硫铁矿,吸收塔中浓硫酸充分吸收煅烧生成的SO3气体11. FeS2具有良好的半导体性能,如图给出了立方FeS2晶胞中的Fe2+和位于晶胞体心的(晶胞中的其他已省略)。下列叙述正确的是( ) A、Fe2+的最高能层的电子排布式为3d6 B、基态Fe2+共有24种不同空间运动状态的电子 C、FeS2晶胞中距离每个最近的S有8个 D、晶胞中Fe2+位于所形成的正八面体的体心12. 下列实验装置(夹持装置已省略)能达到实验目的的是( )
A、Fe2+的最高能层的电子排布式为3d6 B、基态Fe2+共有24种不同空间运动状态的电子 C、FeS2晶胞中距离每个最近的S有8个 D、晶胞中Fe2+位于所形成的正八面体的体心12. 下列实验装置(夹持装置已省略)能达到实验目的的是( ) A、利用A装置进行的干燥、收集及尾气处理 B、试管中可长时间观察到白色沉淀 C、试管中充满溶液,说明通入氧气的体积为体积的 D、利用D装置比较与的热稳定性13. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和、、的混合气体,这些气体与(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入氢氧化钠溶液至恰好完全沉淀,则消耗溶液的体积是( )A、 B、 C、 D、14. 有前景的下一代储能铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如图:
A、利用A装置进行的干燥、收集及尾气处理 B、试管中可长时间观察到白色沉淀 C、试管中充满溶液,说明通入氧气的体积为体积的 D、利用D装置比较与的热稳定性13. 足量铜与一定量浓硝酸反应,得到硝酸铜溶液和、、的混合气体,这些气体与(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入氢氧化钠溶液至恰好完全沉淀,则消耗溶液的体积是( )A、 B、 C、 D、14. 有前景的下一代储能铝离子电池一般采用离子液体作为电解质,几种离子液体的结构如图:
下列说法不正确的是( )
A、化合物I、II、III均熔点低、难挥发 B、化合物III中O、F、S电负性顺序:F>O>S C、化合物I中阴离子的空间构型为正四面体 D、化合物II中C、N原子的杂化轨道类型不同15. 多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅芯片的主要原料。已知第三代工业制取多晶硅流程如图所示:
下列说法错误的是( )
A、Y、Z分别为H2、Cl2 B、制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1∶1 C、SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+4 D、Y与SiHCl3制备多晶硅的反应属于置换反应二、填空题(本题包含4道大题,共55分)
-
16. 溴乙烷是一种重要的有机化工原料,其沸点为38.4℃,制备溴乙烷的一种方法是乙醇与氢溴酸反应。实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图。

实验操作步骤如下:
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%浓硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
请回答下列问题:
(1)、乙醇与氢溴酸反应的化学方程式是。(2)、装置A的作用是。(3)、步骤②中在圆底烧瓶中加入95%乙醇、80%浓硫酸,两种试剂加入的顺序是____(填写正确选项的字母)。A、先加浓硫酸再加乙醇 B、先加乙醇再加浓硫酸 C、两者不分先后(4)、反应时若温度过高,观察到还有一种红棕色气体(Br2)产生,反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的____(填写正确选项的字母)。A、碳酸钠溶液 B、乙醇 C、四氯化碳 D、Na2SO3溶液(5)、要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水CaCl2 , 过滤。然后进行的实验操作是____(填写正确选项的字母)。A、分液 B、蒸馏 C、萃取(6)、为了检验溴乙烷中含有溴元素,通常采用的方法是。17. 五氧化二钒()广泛用于冶金、化工等行业,用作合金添加剂、生产硫酸或石油精炼用的催化剂等。从废钒催化剂(含有、、、、、等)中回收钒,既能避免对环境的污染,又能节约宝贵的资源,回收工艺流程如下: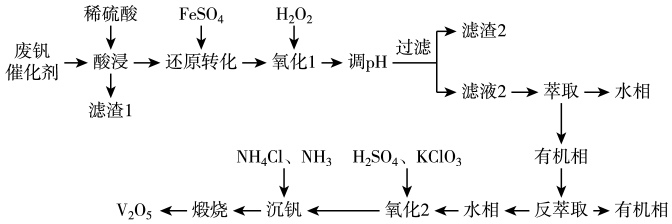
已知:
①“酸浸”时和与稀硫酸反应分别生成和。
②溶液中与可相互转化: , 且为沉淀。
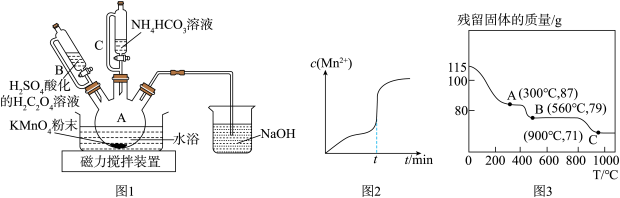
(1)、“酸浸”前,需对废钒催化剂进行粉碎预处理,其目的是。(2)、“还原转化”中加入的目的是将转化为 , 写出反应的离子方程式:。(3)、加入的目的是将过量的转化为。“氧化1”后,溶液中含有的金属阳离子主要有、、 , 调节使离子沉淀,若溶液中 , 则调节溶液的最小值为可使沉淀完全(离子浓度≤时沉淀完全),此时(填“有”或“无”)沉淀生成。{假设溶液体积不变, , , }(4)、“氧化2”过程中发生反应的离子方程式为。(5)、“沉钒”时,通入氨气的作用是。(6)、若该废钒催化剂中的含量为10%(原料中所有的钒已换算成)。取100g待处理样品,按照上述流程进行实验。当加入溶液时,溶液中的钒元素恰好完全反应,则该工艺中钒的回收率是%(假设与反应后的操作步骤中钒元素无损失)。18. 碳酸锰(MnCO3)是制造高性能磁性材料的主要原料。实验室以KMnO4为原料制备少量MnCO3并研究其性质,制备MnCO3的装置如图1所示。已知: MnCO3难溶于水、乙醇,100℃开始分解。 请回答下列问题:
 (1)、仪器B的名称为。(2)、在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的化学方程式为 , 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则tmin时, c(Mn2+)迅速增大的原因是。(3)、反应一段时间后, 当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3。生成MnCO3的离子方程式为。(4)、实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再 , 即 得到干燥的MnCO3固体。用乙醇洗涤的优点是 。(5)、在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为(填化学式),B→C反应的化学方程式为。19. A为重要的有机化工原料,B分子的核磁共振氢谱图中只有一个吸收峰,下列是合成防火材料聚碳酸酯(PC)和有广泛用途的内酯E的路线:
(1)、仪器B的名称为。(2)、在烧瓶中加入一定量的KMnO4固体,滴加硫酸酸化的H2C2O4溶液,其反应的化学方程式为 , 反应过程中c(Mn2+)随时间的变化曲线如图2所示,则tmin时, c(Mn2+)迅速增大的原因是。(3)、反应一段时间后, 当装置A中的溶液由紫色变为无色,再滴加NH4HCO3溶液充分反应生成MnCO3。生成MnCO3的离子方程式为。(4)、实验结束后,将装置A中的混合物过滤,用乙醇洗涤滤渣,再 , 即 得到干燥的MnCO3固体。用乙醇洗涤的优点是 。(5)、在空气中加热MnCO3固体,随着温度的升高,残留固体的质量变化如图3所示。则A点的成分为(填化学式),B→C反应的化学方程式为。19. A为重要的有机化工原料,B分子的核磁共振氢谱图中只有一个吸收峰,下列是合成防火材料聚碳酸酯(PC)和有广泛用途的内酯E的路线:
已知:i.
 +
+
 (R、R′、R′′氢原子或烃基)
(R、R′、R′′氢原子或烃基)ii.RCOOR′+R′′OHRCOOR′′+R′OH(R、R′、R′′代表烃基)
请回答下列问题:
(1)、A的名称为 , 反应①的反应类型为。(2)、化合物甲的分子式为。(3)、E分子内含有六元环,可发生水解反应,其结构简式是。(4)、反应③的方程式为。(5)、有机物H是C的同分异构体,符合下列条件的H有种。①能与新制Cu(OH)2反应,生成砖红色沉淀 ②不含醚键
其中可发生水解反应,核磁共振氢谱显示4组峰,且峰面积之比为3∶2∶2∶1的结构简式为:。