广西钦州市浦北县2023-2024学年高二上学期10月月考化学试卷
试卷更新日期:2023-11-07 类型:月考试卷
一、单选题(每题4分,共14题)
-
1. 下列有关热化学方程式书写及对应表述均正确的是( )。A、已知2C(s)+O2(g)=2CO(g)△H=-221kJ/mol,则可知C的燃烧热△H=-110.5kJ/mol B、稀醋酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol C、已知1mol氢气完全燃烧生成液态水所放出的热量为285.5kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol D、密闭容器中,16g硫粉与足量铁粉混合加热生成硫化亚铁时,放出47.8kJ热量。则Fe(s)+S(s)=FeS(s)△H=-95.6kJ/mol2. 已知可逆反应A2(g)+B2(g) 2AB(g)的能量变化如图所示,则下列叙述中不正确的是( )。
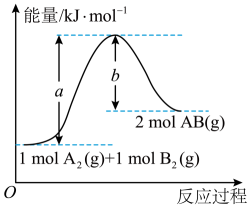 A、该反应的活化能为a kJ·mol-1 B、该反应的逆反应的活化能为b kJ·mol-1 C、该反应的ΔH=+(a-b) kJ·mol-1 D、使用催化剂,a的数值减小,ΔH也减小3. 下列有关热化学方程式的叙述正确的是( )。A、在稀溶液中,H+(aq)+OH-(aq)=H2O(1) ∆H=-57.3kJ/mol,若将1mol NaOH固体的加入1L 1mo/L的稀盐酸溶液中,放出的热量大于57.3kJ B、已知:2H2(g)+O2(g)=2H2O(g) ∆H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol C、已知:S(g)+O2(g)=SO2(g) ∆H1;S(s)+O2(g)=SO2(g) ∆H2 , 则∆H1>∆H2 D、已知:N2(g)+3H2(g)⇌2NH3(g) ∆H=-92kJ/mol,增加氮气和氢气的用量,则∆H变大4. 用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:
A、该反应的活化能为a kJ·mol-1 B、该反应的逆反应的活化能为b kJ·mol-1 C、该反应的ΔH=+(a-b) kJ·mol-1 D、使用催化剂,a的数值减小,ΔH也减小3. 下列有关热化学方程式的叙述正确的是( )。A、在稀溶液中,H+(aq)+OH-(aq)=H2O(1) ∆H=-57.3kJ/mol,若将1mol NaOH固体的加入1L 1mo/L的稀盐酸溶液中,放出的热量大于57.3kJ B、已知:2H2(g)+O2(g)=2H2O(g) ∆H=-483.6kJ/mol,则氢气的燃烧热为241.8kJ/mol C、已知:S(g)+O2(g)=SO2(g) ∆H1;S(s)+O2(g)=SO2(g) ∆H2 , 则∆H1>∆H2 D、已知:N2(g)+3H2(g)⇌2NH3(g) ∆H=-92kJ/mol,增加氮气和氢气的用量,则∆H变大4. 用H2O2和H2SO4的混合溶液可溶出废旧印刷电路板上的铜。已知:①Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) △H1=+64.3kJ·mol-1
②2H2O2(l)=2H2O(l)+O2(g) △H2= —196.1kJ·mol-1
③H2(g)+O2(g)=H2O(l) △H3= —285.8kJ·mol-1
在H2SO4溶液中,1molCu(s)与H2O2(l)反应生成Cu2+(aq)和H2O(l)的反应热△H等于( )
A、+546.7kJ·mol-1 B、-17.9kJ·mol-1 C、-118.5kJ·mol-1 D、-319.55kJ·mol-15. 将锌片、铜片、盐桥、导线、电流计和ZnSO4溶液、CuSO4溶液连接成下图装置,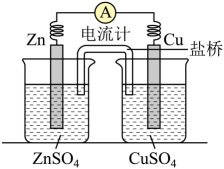
下列各项叙述中正确的是( )。
A、构成原电池,锌片作正极 B、锌片上有铜析出,铜片上没有 C、铜片附近Cu2+离子浓度减小 D、导线中电流的方向是由锌片流向铜片6. 下列四个装置中都用到了金属铜,下列有关说法正确的是( ) A、用图甲装置可在铁件上镀铜 B、用图乙装置可证明活泼性: C、用图丙装置可实现牺牲Cu电极保护钢铁设施 D、用图丁装置可实现化学能向电能的转化,且C极的电极反应式是7. 反应A(s)+B(g) 2C(g)+3D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.6 mol,则反应的速率可表示为( )。A、v(A)=0.04 mol·L-1·s-1 B、v(B)=2.4 mol·L-1·min-1 C、v(C)=0.02 mol·L-1·s-1 D、v(D)=0.12 mol·L-1·min-18. 把0.6mol气体X和0.4mol气体Y混合于2.0L的密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),测得5min末生成0.2molW,又知以Z表示的平均反应速率为0.01mol•L-1•min-1 , 则n值是( )。A、1 B、2 C、3 D、49. 下列说法错误的是( )。
A、用图甲装置可在铁件上镀铜 B、用图乙装置可证明活泼性: C、用图丙装置可实现牺牲Cu电极保护钢铁设施 D、用图丁装置可实现化学能向电能的转化,且C极的电极反应式是7. 反应A(s)+B(g) 2C(g)+3D(g)在0.5 L密闭容器中进行,0.5 min后,A减少了0.6 mol,则反应的速率可表示为( )。A、v(A)=0.04 mol·L-1·s-1 B、v(B)=2.4 mol·L-1·min-1 C、v(C)=0.02 mol·L-1·s-1 D、v(D)=0.12 mol·L-1·min-18. 把0.6mol气体X和0.4mol气体Y混合于2.0L的密闭容器中,发生如下反应:3X(g)+Y(g)nZ(g)+2W(g),测得5min末生成0.2molW,又知以Z表示的平均反应速率为0.01mol•L-1•min-1 , 则n值是( )。A、1 B、2 C、3 D、49. 下列说法错误的是( )。①当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
②发生有效碰撞的分子一定是活化分子
③活化分子间的碰撞一定是有效碰撞
④活化分子间每次碰撞都发生化学反应
⑤能发生有效碰撞的分子必须具有相当高的能量
A、①④ B、③④ C、④⑤ D、②⑤10. 关于有效碰撞理论,下列说法不正确的是( )。A、相同条件下活化分子百分数越多,有效碰撞次数越多,反应速率越快 B、一般情况下,正、逆反应的活化能越小反应速率越快 C、增大压强提高活化分子百分数,反应速率增大 D、催化剂降低反应所需活化能,提高活化分子百分数反应速率增大11. 已知凡气体分子总数增多的反应一定是熵增大的反应。一定条件下,下列反应不能自发进行的是( )A、3O2(g)=2O3(g) △H>0 B、2C(s)+O2(g)=2CO(g) △H<0 C、N2(g)+3H2(g)2NH3(g) △H<0 D、CaCO3(s)=CaO(s)+CO2(g) △H>012. 已知“凡气体分子总数增加的反应都是熵增大的反应”。下列反应在任何温度下都不自发进行的是( )A、2O3(g)=3O2(g) △H<0 B、2CO(g)=2C(s)+O2(g) △H>0 C、N2(g)+3H2(g)=2NH3(g ) △H<0 D、CaCO3(s)=CaO(s)+CO2(g) △H>013. 在一定温度下的密闭容器中,不能说明可逆反应H2(g)+I2(g)=2HI(g)已经达到平衡的标志是( )。A、HI的生成速率与HI的分解速率相等 B、HI的生成速率与H2的生成速率之比是2∶1 C、单位时间内一个H−H键断裂的同时有两个H−I键断裂 D、单位时间里断裂2n mol HI的同时生成nmol I214. 一定温度下,在容积恒定的密闭容器中进行反应A(s)+2B(g) C(g)+D(g),下列叙述能表明该反应已达到平衡状态的是( )。①混合气体的密度不变
②容器内气体的压强不变
③混合气体的总物质的量不变
④B的物质的量浓度不变
⑤v正(C)=v逆(D)
A、①④⑤ B、②③ C、②④⑤ D、只有④二、填空题(最后一空4分,其余各2分,共44分)
-
15.(1)、I.一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。
从反应开始到10s时,用Z表示的反应速率为。 (2)、该反应的化学方程式为。(3)、II.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的反应速率之比等于化学计量数之比。
(2)、该反应的化学方程式为。(3)、II.在恒温恒容的密闭容器中,当下列物理量不再发生变化时:①混合气体的压强;②混合气体的密度;③混合气体的总物质的量;④混合气体的平均相对分子质量;⑤混合气体的颜色;⑥各反应物或生成物的反应速率之比等于化学计量数之比。
一定能证明达到平衡状态的是(填序号,下同)。(4)、一定能证明达到平衡状态的是。16. 相关规律(1)、ΔH0,ΔS0的反应,任何温度下都能自发进行。(2)、ΔH0,ΔS0的反应任何温度下都不能自发进行。(3)、ΔH和ΔS的作用相反,且相差不大时,对反应的方向起决定性作用。①当ΔH<0,ΔS<0时,下反应能自发进行。
②当ΔH>0,ΔS>0时,下反应能自发进行。
(4)、当反应的焓变和熵变的影响相反时,且大小相差悬殊时,某一因素可能占主导地位。①常温下的放热反应,对反应方向起决定性作用。
②常温下的吸热反应,对反应方向起决定性作用。
17. 电池的发明和应用是化学家们对人类社会的重要贡献之一。每一次化学电池技术的突破,都带来了电子设备革命性的发展。最近,我国在甲烷燃料电池的相关技术上获得了新突破,原理如下图所示。
 (1)、甲烷燃料应从口通入(图1),发生的电极反应式 。(2)、以石墨做电极电解饱和食盐水,如图2所示。电解开始后在的周围(填“阴极”或“阳极”)先出现红色,该极的电极反应式为。.(3)、以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是。
(1)、甲烷燃料应从口通入(图1),发生的电极反应式 。(2)、以石墨做电极电解饱和食盐水,如图2所示。电解开始后在的周围(填“阴极”或“阳极”)先出现红色,该极的电极反应式为。.(3)、以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是。a.利用阳极泥可回收Ag、Pt、Au等金属
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.电能全部转化为化学能
(4)、人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图。
①电源的正极为(填“A”或“B”)。
②电解结束后,阴极室溶液的pH与电解前相比将(填“增大”、“减小”、“不变”);若两极共收集到气体6.72 L(标准状况),则除去的尿素为g(忽略气体的溶解)。