贵州省贵阳市2023-2024学年高三上学期开学考试化学试题
试卷更新日期:2023-11-07 类型:开学考试
一、选择题(14小题,每题3分,共42分。每题只有一个选项最符合题意,请将正确选项的序号填入答题卡相应的位置)。
-
1. 我国正式提出将在2030年前实现碳达峰、2060年前实现碳中和的目标。下列做法有利于实现此目标的是( )A、充分利用新能源 B、推广使用一次性餐具 C、鼓励使用私家车出行 D、向燃煤中加入适量碳酸钙2. 下列化学用语正确的是( )A、软脂酸的化学式: B、的VSEPR模型:
 C、溴化钠的电子式:
C、溴化钠的电子式: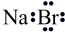 D、基态氮原子的轨道表示式:
D、基态氮原子的轨道表示式: 3. 下列有关物质的性质与用途不具有对应关系的是( )A、干冰升华时吸热,可用作人工降雨 B、维生素C具有还原性,可用作食品抗氧化剂 C、溶液显酸性,可蚀刻印刷电路板上的Cu D、固体受热分解产生 , 可用作膨松剂4. 下列装置能分离苯和溴苯的是( )A、
3. 下列有关物质的性质与用途不具有对应关系的是( )A、干冰升华时吸热,可用作人工降雨 B、维生素C具有还原性,可用作食品抗氧化剂 C、溶液显酸性,可蚀刻印刷电路板上的Cu D、固体受热分解产生 , 可用作膨松剂4. 下列装置能分离苯和溴苯的是( )A、 B、
B、 C、
C、 D、
D、 5. 柳胺酚是一种常见的利胆药,结构如图。下列说法不正确的是( )
5. 柳胺酚是一种常见的利胆药,结构如图。下列说法不正确的是( )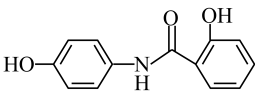 A、分子式为 B、分子中所有原子可能共面 C、能使酸性溶液褪色 D、1mol柳胺酚最多能与3molNaOH反应6. X、Y、Z、W为原子序数依次增大的四种短周期主族元素。X的某种同位素可以用于测定文物年代,Y与X同周期,Y的第一电离能高于同周期的相邻元素,Z是同周期中常见离子半径最小的元素,四种元素的最外层电子数之和为19。下列叙述正确的是( )A、电负性X<Y B、X的氢化物常温下均是气态 C、含Z的盐溶液只显酸性 D、氧化物对应的水化物的酸性:W>Y7. 配合物可用于检验。下列说法正确的是( )A、铁原子的2p和3p轨道的形状、能量均相同 B、基态的未成对电子数为5 C、中提供孤电子对的是 D、1mol配合物中所含的π键数目为8. 下列有关实验的现象叙述正确的是( )A、向硫酸四氨合铜溶液中加入适量95%的乙醇会析出深蓝色晶体 B、向碘的溶液中加入KI溶液并振荡,下层溶液颜色加深 C、向酸性高锰酸钾溶液中通入足量乙烯,溶液褪色并分为两层 D、向蔗糖与稀硫酸加热所得的混合液中加入银氨溶液,能观察到银镜9. 为阿伏加德罗常数的值。下列说法正确的是( )A、28g单晶硅中所含的Si-Si键的数目为 B、溶液中含有的数目为 C、0.3mol苯甲酸完全燃烧生成
A、分子式为 B、分子中所有原子可能共面 C、能使酸性溶液褪色 D、1mol柳胺酚最多能与3molNaOH反应6. X、Y、Z、W为原子序数依次增大的四种短周期主族元素。X的某种同位素可以用于测定文物年代,Y与X同周期,Y的第一电离能高于同周期的相邻元素,Z是同周期中常见离子半径最小的元素,四种元素的最外层电子数之和为19。下列叙述正确的是( )A、电负性X<Y B、X的氢化物常温下均是气态 C、含Z的盐溶液只显酸性 D、氧化物对应的水化物的酸性:W>Y7. 配合物可用于检验。下列说法正确的是( )A、铁原子的2p和3p轨道的形状、能量均相同 B、基态的未成对电子数为5 C、中提供孤电子对的是 D、1mol配合物中所含的π键数目为8. 下列有关实验的现象叙述正确的是( )A、向硫酸四氨合铜溶液中加入适量95%的乙醇会析出深蓝色晶体 B、向碘的溶液中加入KI溶液并振荡,下层溶液颜色加深 C、向酸性高锰酸钾溶液中通入足量乙烯,溶液褪色并分为两层 D、向蔗糖与稀硫酸加热所得的混合液中加入银氨溶液,能观察到银镜9. 为阿伏加德罗常数的值。下列说法正确的是( )A、28g单晶硅中所含的Si-Si键的数目为 B、溶液中含有的数目为 C、0.3mol苯甲酸完全燃烧生成 数目为
D、标准状况下,22.4LHF中含有的氟原子数目为
10. 下列原理对应离子方程式书写正确的是( )A、碳酸钠溶液呈碱性: B、“84”消毒液和洁厕灵不能混用: C、用食醋处理保温瓶中的水垢: D、用稀硝酸洗涤试管内壁的银镜:11. 科学家用X射线激光技术观察到吸附在催化剂表面的CO与O形成化学键的过程,反应过程能量变化及历程如图所示,下列说法正确的是( )
数目为
D、标准状况下,22.4LHF中含有的氟原子数目为
10. 下列原理对应离子方程式书写正确的是( )A、碳酸钠溶液呈碱性: B、“84”消毒液和洁厕灵不能混用: C、用食醋处理保温瓶中的水垢: D、用稀硝酸洗涤试管内壁的银镜:11. 科学家用X射线激光技术观察到吸附在催化剂表面的CO与O形成化学键的过程,反应过程能量变化及历程如图所示,下列说法正确的是( ) AIA、CO和O生成是吸热过程 B、状态Ⅰ→Ⅱ吸收能量用于断裂化学键 C、状态Ⅰ→Ⅲ表示的是CO与反应的过程 D、CO和中C与O之间化学键并不相同12. 是一种高效水处理剂,可用稀盐酸和为原料制备,反应原理如下:。下列判断正确的是( )A、是还原产物 B、HCl发生氧化反应 C、n(氧化剂):n(还原剂)=5:4 D、生成10molNaCl,转移8mol电子13. 电解催化还原为乙烯能缓解碳排放引发的温室效应,还将成为获得重要化工原料的补充形式,原理如图所示(a、b均为惰性电极)。下列说法正确的是( )
AIA、CO和O生成是吸热过程 B、状态Ⅰ→Ⅱ吸收能量用于断裂化学键 C、状态Ⅰ→Ⅲ表示的是CO与反应的过程 D、CO和中C与O之间化学键并不相同12. 是一种高效水处理剂,可用稀盐酸和为原料制备,反应原理如下:。下列判断正确的是( )A、是还原产物 B、HCl发生氧化反应 C、n(氧化剂):n(还原剂)=5:4 D、生成10molNaCl,转移8mol电子13. 电解催化还原为乙烯能缓解碳排放引发的温室效应,还将成为获得重要化工原料的补充形式,原理如图所示(a、b均为惰性电极)。下列说法正确的是( ) A、B为电源负极 B、从左边透过阳离子交换膜到右边 C、电解一段时间后,阳极区溶液的增大 D、阴极反应为14. 易被氧化成 , 为验证该事实,某实验小组利用数字化实验设备,从贴有“ , ”标签的溶液中取50.00mL样品,逐滴加入溶液,得到的pH-V(NaOH溶液)曲线如图所示。关于该实验,下列说法错误的是( )
A、B为电源负极 B、从左边透过阳离子交换膜到右边 C、电解一段时间后,阳极区溶液的增大 D、阴极反应为14. 易被氧化成 , 为验证该事实,某实验小组利用数字化实验设备,从贴有“ , ”标签的溶液中取50.00mL样品,逐滴加入溶液,得到的pH-V(NaOH溶液)曲线如图所示。关于该实验,下列说法错误的是( )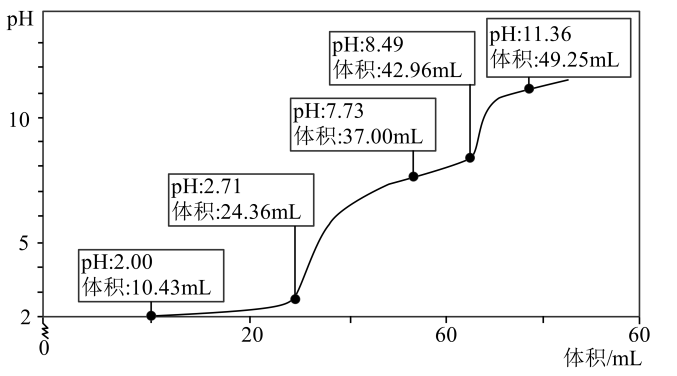
已知: ,
A、使产生沉淀的pH范围为7.73~8.49 B、pH=2.00~2.71时,产生红褐色沉淀现象 C、pH=8.00时,溶液中 D、pH=2.50时,溶液二、非选择题(4小题,共58分)。
-
15. 某化学小组为探究的制备、性质及检验等相关问题,进行如下实验:(1)、Ⅰ.制备并收集纯净干燥的
实验室可供选择的试剂:C(s)、Cu(s)、饱和溶液、75%浓。
①实验所需装置的连接顺序是:a→→d→e(按气流方向用小写字母标号表示)。
②该实验中制备的反应方程式为。
(2)、Ⅱ.探究的性质将收集到的持续通入如图装置进行实验:

①装置E中出现现象时可验证具有氧化性。
②装置F用于验证的还原性,为实现这一目的,需进一步采取的实验操作是。
③从硫元素间的相互转化所得的规律判断下列物质中既有氧化性,又有还原性的是(填字母序号)。
a.Na b. c. d. e.
(3)、Ⅲ.葡萄酒中抗氧化剂残留量(以游离计算)的测定准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为标准溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。(已知滴定过程中所发生的反应是)。
滴定前需排放装有溶液的滴定管尖嘴处的气泡,其正确的图示为____(填字母)。A、 B、
B、 C、
C、 D、
D、 (4)、判断达到滴定终点的依据是;所测100.00mL葡萄酒样品中抗氧化剂的残留量(以游离计算)为。16. 废旧钴酸锂电池的正极材料主要含有难溶于水的及少量Al、Fe、炭黑等,常用如图所示的一种工艺分离并回收其中的金属钴和锂。
(4)、判断达到滴定终点的依据是;所测100.00mL葡萄酒样品中抗氧化剂的残留量(以游离计算)为。16. 废旧钴酸锂电池的正极材料主要含有难溶于水的及少量Al、Fe、炭黑等,常用如图所示的一种工艺分离并回收其中的金属钴和锂。
已知:①;
②相关金属离子形成氢氧化物沉淀的pH如下表:
金属阳离子
开始沉淀的pH
4.2
2.7
7.6
沉淀完全的pH
5.2
3.7
9.6
回答下列问题:
(1)、中元素Co的化合价为。(2)、为提高碱浸率,可采取的措施有(任写一种)。(3)、在浸出液中通入过量发生反应的离子方程式有和。(4)、浸出渣中加入稀硫酸和的主要目的是;废渣的主要成分是。(5)、加氨水控制沉钴的pH,当a≥时,此时溶液中c(Co2+)≤10-5mol/L,即认为“沉钴”完全。(6)、钴的氢氧化物加热至290℃时可以完全脱水,所得产物可用于合成钛酸钴。钛酸钴的晶胞结构如图所示,则该晶体化学式为;该晶体的密度为(用代表阿伏加德罗常数)。 AI17. 一种在常温、常压下催化电解实现工业合成氨反应的工艺为: , , 该反应可分两步完成:
AI17. 一种在常温、常压下催化电解实现工业合成氨反应的工艺为: , , 该反应可分两步完成:反应Ⅰ:
反应Ⅱ:
请回答下列问题:
(1)、。(2)、将和充入到3L的恒容密闭容器中模拟反应Ⅰ:①该反应中物质浓度随时间变化的曲线如图甲所示,0~10min内,。
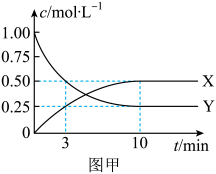
②不同温度和压强下测得平衡时混合物中氨的体积分数与温度的关系如图乙所示,则B、C两点的平衡常数(填“>”、“<”、“=”或“不确定”);B点时的转化率=(保留2位有效数字)。
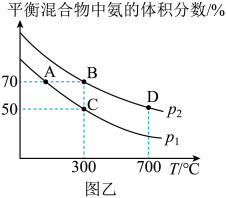 (3)、从图乙中获知反应Ⅰ存在着高温降低平衡产率与低温降低反应速率等调控矛盾。在提高合成氨的产率的工业生产中,通常从以下多个视角来综合考虑合理的工业生产条件:
(3)、从图乙中获知反应Ⅰ存在着高温降低平衡产率与低温降低反应速率等调控矛盾。在提高合成氨的产率的工业生产中,通常从以下多个视角来综合考虑合理的工业生产条件:反应速率的视角:①加入催化剂;②提高温度(控制在催化剂的活性温度内)
平衡移动和原料的转化率的视角:③ , ④。
(4)、科学家为避免直接破坏键而消耗大量热能,通过新型催化剂降低了反应路径中决速步的能垒,使该反应在常温、常压下采用电化学方法也能实现,反应装置如图所示: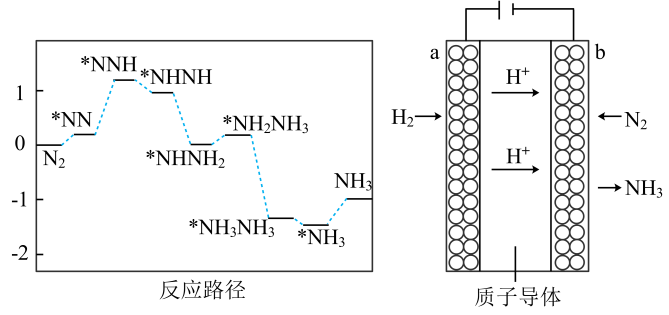
①反应路径中的决速步为 (填写“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”) 。
②阴极上的电极反应式为。
18. 小分子药物高分子化是改进现有药物的重要方法之一,下图是一种制备中间体M对药物进行高分子化改进的路线:
已知:气态烃A是石油裂解的产物,;
回答下列问题:
(1)、B的结构简式是;E的名称是。(2)、D→E时,苯环侧链上碳原子的杂化轨道类型由变为。(3)、F中含有的官能团名称是。(4)、写出G→K的化学方程式。(5)、将布洛芬嫁接到高分子基体M上(M→缓释布洛芬)的反应类型是。(6)、化合物F的同系物N比F的相对分子质量大14,N的同分异构体中同时满足下列条件的共有种(不考虑立体异构);其中核磁共振氢谱图有六组吸收峰,且峰面积比为3:2:2:1:1:1的化合物的结构简式为(任写一种)。①含有碳碳双键;②可与新制的共热生成红色沉淀;③苯环上有两个取代基