浙江省台州市温岭名校2023-2024学年高一上学期学生学科素养开学测试化学试题
试卷更新日期:2023-11-06 类型:开学考试
一、单选题(本题共20小题,共40分)
-
1. 下列生产生活的事例不涉及氧化还原反应的是( )A、发射火箭时燃料的燃烧 B、高炉炼铁
C、食物的腐败 D、豆浆变豆腐2. 下列关于物质分类的组合正确的是( )选项
碱
酸
盐
碱性氧化物
酸性氧化物
A
硫酸
小苏打
干冰
B
烧碱
盐酸
氯化钠
氧化钠
一氧化碳
C
石灰水
冰醋酸()
胆矾()
氧化钠
二氧化硫
D
NaOH 碳酸钙
氧化铁
A、A B、B C、C D、D3. 下列物质既能导电又属于电解质的是( )A、镁 B、酒精
C、熔融的硫酸钠 D、晶体4. 模型认知是简洁揭示化学本质的一种方法,如图为氯化钠固体溶于水的微观模型,下列说法正确的是( )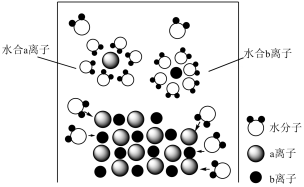 A、固体中存在自由移动的和
A、固体中存在自由移动的和
B、该电离过程可以表示为
C、水合氯离子中中的最靠近
D、溶液是电解质5. 下列五种物质中均含有碳元素,它们是按碳元素的化合价由低到高的顺序排列的:①甲烷();②甲醇();③;④甲醛()根据规律,可能是( )
A、草酸() B、四氯化碳()
C、乙炔() D、甲酸()6. 氧化还原反应与四种基本反应类型的关系如图所示,则下列反应属于阴影部分的是( ) A、
A、
B、
C、
D、7. 已知常温下在溶液中可发生如下两个离子反应:、
由此可以确定、、三种离子的还原性由强到弱的顺序( )
A、、、 B、、、 C、、、 D、、、8. 下列反应的离子方程式书写正确的是( )A、稀硫酸滴到铜片上:
B、稀盐酸和碳酸氢钠反应:
C、氯化镁溶液和氢氧化钡溶液混合:
D、少量的通入澄清石灰水中:9. 下列叙述不正确的是( )A、胶体是一种分散质粒子的直径在间的分散系
B、氢氧化铁胶体能吸附水中的悬浮颗粒并沉降,因而能净水
C、有色玻璃是由某些胶态金属氧化物分散于玻璃中制成的
D、用一束光线照射硫酸铜溶液,在垂直于光线的方向可看到一条光亮通路10. 下列关于氢氧化铁胶体制备的说法正确的是( )A、将氯化铁稀溶液慢慢滴入沸腾的自来水中,继续加热煮沸
B、将饱和氯化铁溶液慢慢滴入沸腾的蒸馏水中,并用玻璃棒搅拌
C、将氢氧化钠溶液慢慢滴入饱和氯化铁溶液中
D、在沸腾的蒸馏水中慢慢滴入饱和氯化铁溶液,继续煮沸至液体呈红褐色11. 从金属材料的发展历史来看,先是青铜时代,而后是铁器时代,铝的利用是近百年的事,这个先后顺序跟下列哪些性质有关( )①金属活动顺序;②地壳中金属元素的含量;③金属的延展性;④金属的导电性;⑤金属的冶炼难易程度
A、①④ B、①⑤ C、②③ D、④⑤12. 小明将未经砂布打磨的铝条放入盛有稀盐酸的密闭容器中,用压强传感器测得容器内气体压强和反应时间的变化曲线如图所示,下列分析中不正确的是( ) A、段的化学反应是:
A、段的化学反应是:
B、点盐酸浓度最低点盐酸浓度最高
C、段压强变化的主要影响因素是气体温度
D、、两点处的气体压强相等13. 下列关于氯气的叙述不正确的是( )A、密度比空气大
B、氯气可以用于自来水的杀菌、消毒
C、纯净的氢气可以在氯气中安静地燃烧,发出黄色火焰
D、干燥氯气可以漂白鲜花14. 下列关于氯水的叙述中,正确的是( )A、新制氯水中只含和分子
B、光照氯水,有气体逸出,该气体为
C、新制氯水可使蓝色石蕊试纸先变红后褪色
D、氯水密封放置数天后将变大15. 现有硫酸、氢氧化钡、碳酸钠和氯水四种溶液,有如图所示的相互关系,图中每条线段两端的物质可以发生化学反应。下列推断合理的是( ) A、一定是氢氧化钡溶液 B、可能是氯水
A、一定是氢氧化钡溶液 B、可能是氯水
C、一定是碳酸钠溶液 D、可能是硫酸溶液16. 溴化碘()的化学性质与卤素单质相似,能跟大多数金属反应生成金属卤化物,能跟水反应。下列有关叙述中不正确的是( )A、是双原子分子
B、与溶液能反应
C、在很多化学反应中作氧化剂
D、与水反应时,既是氧化剂又是还原剂17. 在某酸性溶液中,能大量共存的离子组是( )A、、、、 B、、、、
C、、、、 D、、、、18. 规范的操作是确保实验成功的关键。下列所示的操作正确的是( )A、测物体质量 B、闻气体
B、闻气体 C、测液体体积
C、测液体体积 D、检查装置气密性
D、检查装置气密性 19. 实验室制取某些气体的装置如下图。下列说法不正确的是( )
19. 实验室制取某些气体的装置如下图。下列说法不正确的是( ) A、为了防止漏气,使用装置②时,长颈漏斗下端需伸入液面以下
A、为了防止漏气,使用装置②时,长颈漏斗下端需伸入液面以下
B、用装置组合①④或②③均可以制取氧气
C、用装置③收集氧气时,一般用带火星的木条来验满
D、用装置组合⑥⑤组合可以制取氢气,还可以控制反应的发生与停止20. 如图:在托盘天平两边各放一烧杯,调节至平衡,向两边烧杯中分别注入质量相等,溶质质量分数相同的稀盐酸,再向两烧杯中分别投入质量相等的锌粒和镁条,待反应停止后,天平指针的可能指向是:①刻度盘上偏向放锌粒的一方;②刻度盘的中央;③刻度盘上偏向放镁条的一方,其中正确的是( ) A、①②③ B、仅③ C、①② D、②③
A、①②③ B、仅③ C、①② D、②③二、填空题(本题共5小题,共60分)
-
21. 水是生命之源,水在工业、农业和日常生活中均发挥着重要作用。(1)、下列关于水的说法,正确的是____。A、水的摩尔质量是 B、水中含有10个电子 C、水中含氢 D、一个水分子的质量约是(2)、为增强水的导电性,通常向纯水中加入适量的(不参加反应)。
①某电解水实验开始时,向纯水中溶解了。此时溶液中和水分子的个数比是。
②当实验进行到一段时间,两个石墨电极共收集到的气体质量为。计算此时被电解的水的物质的量是。
(3)、目前,很多自来水厂用氯气杀菌、消毒。仔细观察下图的微观反应过程,写出该化学反应方程式。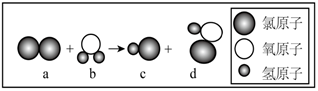 22. 粗食盐水中常含有少量、、 , 实验室提纯粗食盐水制取食盐的流程如下。
22. 粗食盐水中常含有少量、、 , 实验室提纯粗食盐水制取食盐的流程如下。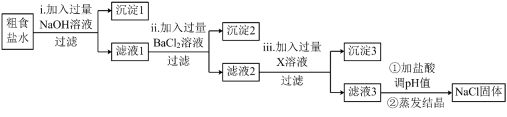 (1)、流程中,其中操作顺序可以互换的步骤是和(填ⅰ、ⅱ、ⅲ)。(2)、过程ⅱ的目的是 , 发生的离子方程式为。(3)、过程ⅲ中加入的试剂为。(4)、沉淀3的成分是。23. 从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。(1)、下图为氯及其化合物的“价类”二维图。图中的类别为;的名称为。
(1)、流程中,其中操作顺序可以互换的步骤是和(填ⅰ、ⅱ、ⅲ)。(2)、过程ⅱ的目的是 , 发生的离子方程式为。(3)、过程ⅲ中加入的试剂为。(4)、沉淀3的成分是。23. 从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。(1)、下图为氯及其化合物的“价类”二维图。图中的类别为;的名称为。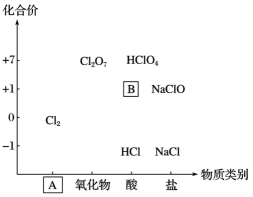 (2)、已知高氯酸()是一元强酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式。(3)、某同学研究性质,进行如下预测:
(2)、已知高氯酸()是一元强酸,写出高氯酸溶液与氢氧化钠溶液反应的离子方程式。(3)、某同学研究性质,进行如下预测:①从物质类别上看,属于酸,能与大理石反应,相应的离子方程式为;
②从化合价角度看,具有性,能与发生反应(填标号)。
A.
B.
C.
D.
(4)、某同学用强光照射氯水,同时使用数据采集器采集数据如图。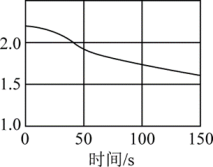
光照新制氯水,发生反应的化学方程式为;该同学采集的数据是(填标号)。
A.氯水的
B.氯离子的浓度
C.溶液的电导率
D.氧气的体积分数
24. 氯气和漂白粉是现代工业和生活中常用的杀菌消毒剂,实验室拟用如下图所示装置制备干燥纯净的氯气,请回答下列问题。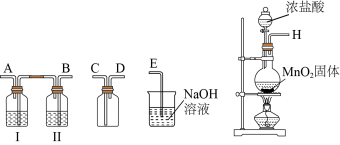 (1)、请按正确的顺序连接装置:、、、;选择最后一个装置的目的是。(2)、Ⅰ中所盛试剂为(填序号,下同),Ⅱ中所盛试剂为。
(1)、请按正确的顺序连接装置:、、、;选择最后一个装置的目的是。(2)、Ⅰ中所盛试剂为(填序号,下同),Ⅱ中所盛试剂为。A.氢氧化钠溶液
B.饱和食盐水
C.浓硫酸
D.硝酸银溶液
(3)、写出实验室制取氯气的离子方程式并用双线桥标出电子转移的方向和数目。(4)、写出工业上用氯气和石灰乳制取漂白粉的化学反应方程式: 1 。25. 酸碱中和反应是一类重要的化学反应。(1)、Ⅰ.某同学利用图1装置研究盐酸与氢氧化钠溶液反应的过程,并用和温度传感器测量反应过程中相关物理量的变化情况,得到图2和图3。
图1仪器中溶液的溶质是(填化学式)。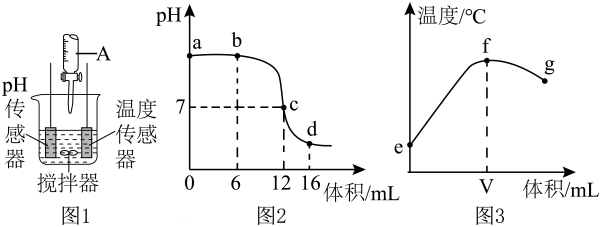 (2)、图3中的数值约为。(3)、下列说法正确的是。
(2)、图3中的数值约为。(3)、下列说法正确的是。A.图2中点所示溶液中的溶质是和
B.取图2中点所示溶液加热蒸干所得固体为纯净物
C.图2中所示溶液中的质量不断增加
D.图3中变化趋势可说明该反应是放热反应
(4)、Ⅱ.若是在溶液中逐滴滴加稀硫酸直至过量,并测得混合溶液的导电性随加入的硫酸的体积变化曲线如图4所示。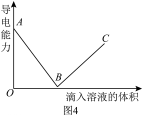
写出溶液与稀硫酸反应的离子方程式。(5)、该小组的同学关于右图的下列说法中,正确的是____。A、段溶液的导电能力不断减弱, 说明生成的不是电解质 B、处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子 C、段溶液的导电能力不断增大,主要是由于过量的电离出的离子导电 D、处溶液与稀硫酸恰好完全中和