广东省肇庆市德庆县2023-2024学年高三上学期9月月考化学试题
试卷更新日期:2023-11-06 类型:月考试卷
一、单项选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。每小题只有一个选项符合题意。
-
1. 我国的航空航天事业取得巨大成就,下列所述物质为金属材料的是( )
航空航天成果




物质
宇航服中的聚酯纤维
C919外壳中的铝锂合金
北斗卫星使用的氮化铝芯片
长征火箭使用的液氢燃料
选项
A
B
C
D
A、A B、B C、C D、D2. 广东的非物质文化遗产丰富多彩,如广东剪纸、粤绣、龙舟制作技艺、广彩瓷器烧制技艺等。下列说法不正确的是( )A、广东剪纸所用纸张的漂白过程涉及化学变化 B、粤绣所用蚕丝绣材含有天然有机高分子 C、绘有金色花纹的广彩瓷器含有硅酸盐 D、龙舟表面所涂红色颜料的成分是氧化亚铁3. 劳动开创未来。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
用石灰乳除去烟气中的SO2
SO2是酸性氧化物
B
利用工业合成氨实现人工固氮
N2具有还原性
C
将锌块镶嵌在轮船底部防腐
锌的金属性比铁强
D
用HNO3除去试管中的银镜
HNO3具有强氧化性
A、A B、B C、C D、D4. 聚乳酸广泛用于制造可降解材料,其生物降解过程如下。下列说法不正确的是( ) A、乳酸分子不含手性碳原子 B、分子含有σ 键和π键 C、乳酸属于烃的衍生物 D、使用聚乳酸材料有利于减少白色污染5. 下列装置用于实验室制取NO并回收 , 不能达到实验目的的是( )
A、乳酸分子不含手性碳原子 B、分子含有σ 键和π键 C、乳酸属于烃的衍生物 D、使用聚乳酸材料有利于减少白色污染5. 下列装置用于实验室制取NO并回收 , 不能达到实验目的的是( ) A、用装置甲制NO气体 B、用装置乙除NO中的少量NO2 C、用装置丙收集NO气体 D、用装置丁蒸干溶液获得Cu(NO3)2固体6. 如图所示的化合物是一种重要的化工原料,X、Y、Z、W、E是原子序数依次增大的短周期主族元素,其中Z、E同族,基态Y原子的核外有3个未成对电子。下列说法正确的是( )
A、用装置甲制NO气体 B、用装置乙除NO中的少量NO2 C、用装置丙收集NO气体 D、用装置丁蒸干溶液获得Cu(NO3)2固体6. 如图所示的化合物是一种重要的化工原料,X、Y、Z、W、E是原子序数依次增大的短周期主族元素,其中Z、E同族,基态Y原子的核外有3个未成对电子。下列说法正确的是( ) A、原子半径: B、W2Z2中只含有离子键 C、电负性: D、Z、W、E组成化合物的水溶液一定显中性7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、24g Mg与稀硫酸完全反应,转移的电子数目为NA B、1mol 含有Si-Cl键的数目为 C、1L 1.0 溶液含有阴离子的总数为2 D、11.2L NO与11.2L O2混合后分子的数目为NA8. 陈述Ⅰ和Ⅱ均正确并具有因果关系的是( )
A、原子半径: B、W2Z2中只含有离子键 C、电负性: D、Z、W、E组成化合物的水溶液一定显中性7. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、24g Mg与稀硫酸完全反应,转移的电子数目为NA B、1mol 含有Si-Cl键的数目为 C、1L 1.0 溶液含有阴离子的总数为2 D、11.2L NO与11.2L O2混合后分子的数目为NA8. 陈述Ⅰ和Ⅱ均正确并具有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
二氧化硅可用于制备光导纤维
二氧化硅是良好的半导体材料
B
Na着火不能用水扑灭
Na可与水反应产生O2
C
用明矾净水
Al(OH)3胶体具有吸附性
D
用84消毒液进行消毒
NaClO溶液呈碱性
A、A B、B C、C D、D9. 二乙胺[]是一种有机弱碱,可与盐酸反应生成盐酸盐(C2H5)2NH2Cl。下列叙述正确的是( )A、(C2H5)2NH2Cl水溶液的pH随温度升高而减小 B、0.01 (C2H5)2NH2Cl水溶液的 C、(C2H5)2NH2Cl水溶液加水稀释,pH降低 D、(C2H5)2NH2Cl水溶液中:10. 硒(Se)是人体必需微量元素之一,已知Se与S同族,一种含硒的功能分子的合成路线如下,下列说法不正确的是( ) A、沸点: B、Ⅲ含有的元素中O的第一电离能最大 C、Ⅱ中含有极性共价键和非极性共价键 D、Ⅰ中S原子的杂化轨道类型为SP311. 下列关于铁及其化合物之间转化反应的方程式书写正确的是( )A、溶液中加入酸性溶液: B、过量铁粉加入稀硝酸中: C、氢氧化铁中加入氢碘酸: D、(g)通过灼热铁粉:12. 汽车尾气中NO产生的反应为 。一定条件下,等物质的量和在恒容密闭容器中反应,曲线a表示该反应在温度T下随时间(t)的变化,曲线b表示该反应在某一起始条件改变时随时间(t)的变化。下列叙述不正确的是( )
A、沸点: B、Ⅲ含有的元素中O的第一电离能最大 C、Ⅱ中含有极性共价键和非极性共价键 D、Ⅰ中S原子的杂化轨道类型为SP311. 下列关于铁及其化合物之间转化反应的方程式书写正确的是( )A、溶液中加入酸性溶液: B、过量铁粉加入稀硝酸中: C、氢氧化铁中加入氢碘酸: D、(g)通过灼热铁粉:12. 汽车尾气中NO产生的反应为 。一定条件下,等物质的量和在恒容密闭容器中反应,曲线a表示该反应在温度T下随时间(t)的变化,曲线b表示该反应在某一起始条件改变时随时间(t)的变化。下列叙述不正确的是( )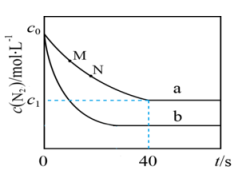 A、温度T下、0-40s内 B、曲线b对应的条件改变可能是充入氧气 C、M点小于N点 D、若曲线b对应的条件改变是升高温度,则13. 打开分液漏斗活塞和玻璃塞,进行如图所示的探究实验,对实验现象分析正确的是( )
A、温度T下、0-40s内 B、曲线b对应的条件改变可能是充入氧气 C、M点小于N点 D、若曲线b对应的条件改变是升高温度,则13. 打开分液漏斗活塞和玻璃塞,进行如图所示的探究实验,对实验现象分析正确的是( ) A、试管中产生大量气泡,说明被氧化产生 B、试管内层溶液褪色,说明具有还原性 C、一段时间后试管内有白色沉淀,说明有生成 D、试管中浸有品红溶液的棉球褪色,说明具有氧化性14. 化学是一门以实验为基础的学科。下列实验操作不能达到目的的是( )
A、试管中产生大量气泡,说明被氧化产生 B、试管内层溶液褪色,说明具有还原性 C、一段时间后试管内有白色沉淀,说明有生成 D、试管中浸有品红溶液的棉球褪色,说明具有氧化性14. 化学是一门以实验为基础的学科。下列实验操作不能达到目的的是( )选项
目的
实验操作
A
制备晶体
向溶液中加入95%的乙醇
B
制备胶体
向沸水中逐滴加入饱和溶液继续煮沸至液体呈红褐色
C
探究温度对化学平衡的影响
加热0.5 溶液
D
配制100mL 0.4的NaOH溶液
称取4.0g固体NaOH于烧杯中,加入蒸馏水溶解,立刻转移至100mL容量瓶中,定容
A、A B、B C、C D、D15. 科学家研发了一种以Al和Pd@石墨烯为电极的Al-电池,电池以-离子液体作电解质,放电时在提供能量的同时实现了人工固氮,示意图如下。下列说法不正确的是( )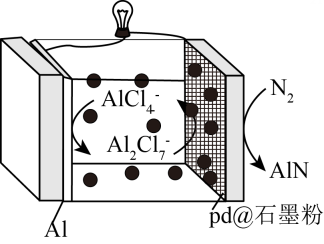 A、放电时离子浓度增大,离子浓度减少 B、充电时Al电极是阴极 C、放电时正极反应为 D、放电时电路中每通过6mol , 电池总质量理论上增加28g16. 常温下,向含有、、的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示或或]。
A、放电时离子浓度增大,离子浓度减少 B、充电时Al电极是阴极 C、放电时正极反应为 D、放电时电路中每通过6mol , 电池总质量理论上增加28g16. 常温下,向含有、、的工业废水中逐滴加入NaOH溶液,pM随pH的变化关系如图所示[pM表示或或]。已知: , 。若溶液中离子浓度小于 , 认为该离子沉淀完全。下列说法不正确的是( )
 A、曲线①表示与pH的关系 B、时, C、时,可认为沉淀完全 D、时,溶液中
A、曲线①表示与pH的关系 B、时, C、时,可认为沉淀完全 D、时,溶液中二、非选择题:共56分。
-
17. 某小组从电极反应的角度研究物质氧化性和还原性的变化规律。(1)、实验室以MnO2和浓盐酸为原料制取氯气的化学方程式为:。该反应的氧化产物是。将该反应设计成原电池,氧化反应为 , 还原反应为。(2)、当氯气不再逸出时,固液混合物A中仍存在MnO2和盐酸。小组同学分析认为随着反应的进行,MnO2的氧化性和Cl-的还原性均减弱,为此进行探究。
实验任务
探究离子浓度对MnO2氧化性的影响
提出猜想
猜想a:随c(H+)减小,MnO2的氧化性减弱。
猜想b:随c(Mn2+)增大,MnO2的氧化性减弱。
查阅资料
电极电势(φ)是表征氧化剂的氧化性(或还原剂的还原性)强弱的物理量。电极电势越大,氧化剂的氧化性越强;电极电势越小,还原剂的还原性越强。
验证猜想
用0.10溶液、0.10溶液和蒸馏水配制混合液(溶液总体积相同),将MnO2电极置于混合液中测定其电极电势φ , 进行表中实验1~3,数据记录。
实验序号
V()/mL
V()/mL
V()/mL
电极电势/V
1
20
20
0
2
m
n
10
3
20
10
10
①根据实验1和2的结果,猜想a成立。补充数据:m= , n=。
②根据实验1和3的结果,猜想b成立。判断依据是(用电极电势关系表示)。
探究结果
固液混合物A中仍存在和盐酸的原因是随着反应进行,溶液中c(H+)减小、c(Mn2+)增大,MnO2氧化性减弱。
③根据上述探究结果,小组同学作出如下推断:随增大,还原性增强。
实验验证:在固液混合物A中加入(填化学式)固体,加热。证明推断正确的实验现象是。
(3)、根据电化学的相关知识,小组同学分别利用电解池(图1)和原电池(图2)装置,成功实现了铜与稀硫酸制氢气。
①图1中阳极的电极反应式为。
②结合(2)的探究结论,图2中试剂X是 , 试剂Y是。
可选试剂:稀硫酸、溶液、NaOH溶液、溶液、溶液(浓度均为1.0)
18. 氮化镓(GaN)具有优异的光电性能。一种利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4、SiO2]制备GaN的工艺流程如下:
已知:①Ga与Al同主族,化学性质相似。
②常温下, , , 。
③Ga3+、Fe3+在该工艺条件下的反萃取率(进入水相中金属离子的百分数)与盐酸浓度的关系见下表。
盐酸浓度/
反萃取率/%
Ga3+
Fe3+
2
86.9
9.4
4
69.1
52.1
6
17.5
71.3
回答下列问题:
(1)、“酸浸”时Ga2(Fe2O4)3发生反应的离子方程式为。“酸溶”所得滤渣的主要成分是(填化学式)。(2)、“酸浸”所得浸出液中、浓度分别为0.21、65。常温下,为尽可能多地提取并确保不混入 , “调pH”时需用CaO调pH至(假设调pH时溶液体积不变)。(3)、“脱铁”和“反萃取”时,所用盐酸的浓度a= , b=(选填上表中盐酸的浓度)。(4)、“沉镓”时,若加入NaOH的量过多,会导致Ga3+的沉淀率降低,原因是(用离子方程式表示)。(5)、利用CVD(化学气相沉积)技术,将热分解得到的Ga2O3与NH3在高温下反应可制得GaN,同时生成另一种产物,该反应化学方程式为。(6)、①GaN的熔点为1700℃,的熔点为77.9℃,它们的晶体类型依次为、。②GaN晶体的一种立方晶胞如图所示。该晶体中与Ga原子距离最近且相等的N原子个数为。该晶体密度为 , GaN的式量为 , 则晶胞边长为nm。(列出计算式,为阿伏加德罗常数的值)
 19. 和重整制取合成气CO和 , 在减少温室气体排放的同时,可充分利用碳资源。该重整工艺主要涉及以下反应:
19. 和重整制取合成气CO和 , 在减少温室气体排放的同时,可充分利用碳资源。该重整工艺主要涉及以下反应:反应a:
反应b:
反应c:
反应d:
(1)、重整时往反应体系中通入一定量的水蒸气,可在消除积碳的同时生成水煤气,反应为 , 该反应的△H=(写出一个代数式)。(2)、关于和重整,下列说法正确的是____(填编号)。A、的物质的量保持不变时,反应体系达到平衡状态 B、恒容时通入增大压强,的平衡转化率减小 C、加入反应c的催化剂,该反应的平衡常数K增大 D、降低反应温度,反应d的(3)、一定压强下,按照投料,和重整反应达到平衡时各组分的物质的量分数随温度的变化如图所示
①图中曲线m、n分别表示物质、的变化(选填“”“CO”或“”)。
②700℃后,C(s)的物质的量分数随温度升高而增大的原因是。
③某温度下体系中不存在积碳,和的物质的量分数分别是0.50、0.04,该温度下甲烷的平衡转化率为 , 反应b的平衡常数K=(列出计算式)。
20. 化合物Ⅷ是一种用于制备神经抑制剂的中间体,其合成路线如下:
回答下列问题:
(1)、化合物I的分子式是。化合物Ⅷ中的含氧官能团的名称是。(2)、化合物I的沸点高于化合物II,其原因是。(3)、反应①是原子利用率100%的反应,则a为。(4)、反应②的反应类型为。(5)、化合物Ⅲ有多种同分异构体,其中含 结构的有种(不计III),其中核磁共振氢谱的峰面积比为6:1:1的结构简式为(写出其中一种)。 (6)、写出以
结构的有种(不计III),其中核磁共振氢谱的峰面积比为6:1:1的结构简式为(写出其中一种)。 (6)、写出以 和乙醇为原料合成化合物
和乙醇为原料合成化合物 的单体的合成路线(无机试剂任用)。
的单体的合成路线(无机试剂任用)。