江苏省苏州市2023-2024学年九年级上学期月考化学试卷(10月份)
试卷更新日期:2023-11-03 类型:月考试卷
一、选择题(每题仅有1个正确选项,每题2分,共24小题,共50分)
-
1. “低碳”生活减少了二氧化碳的排放。下列说法正确的是( )A、实验室用NaCl溶液检验CO2 B、过多排放二氧化碳会造成温室效应 C、燃煤发电比太阳能发电有利于减少二氧化碳的排放 D、CO2通入滴有紫色石蕊试液的蒸馏水中,溶液颜色变蓝2. 我国南海海底含大量的“可燃冰”。“可燃冰”外形似冰、可以燃烧,其中主要含有甲烷水合物。下列说法正确的是( )A、“可燃冰”可作为能源 B、“可燃冰”燃烧时只生成水 C、“可燃冰”燃烧属于物理变化 D、“可燃冰”能燃烧,说明水具有可燃性3. 下列实验操作正确的是( )A、
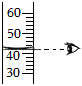 量筒读数
B、
量筒读数
B、 倾倒液体
C、
倾倒液体
C、 收集氧气
D、
收集氧气
D、 熄灭酒精灯
4. 下列有关实验的操作正确的是( )
熄灭酒精灯
4. 下列有关实验的操作正确的是( )选项
实验
操作
A
除去MnO2中少量KMnO4
加热固体混合物
B
实验室制CO2并收集
验满时将燃着的木条伸进集气瓶
C
用排水法收集高锰酸钾分解产生的氧气
先熄灭酒精灯,后移出导管
D
点燃氢气
先检验气体的纯度,后点燃
A、A B、B C、C D、D5. 某同学用如图所示装置测定空气里氧气的含量,实验时,连接好装置并检查不漏气后再进行后续操作( )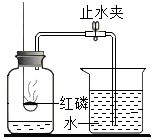 A、所用红磷要过量,以保证集气瓶内空气里的氧气能充分反应 B、在空气里点燃红磷后,应缓慢把燃烧匙伸入瓶内并塞紧橡皮塞 C、仍用本装置,只把红磷换成燃烧的木炭,能够更精确测定空气里氧气的含量 D、红磷燃烧时,要打开止水夹,以免瓶因温度升高,气压较大,造成橡皮塞从瓶口脱落6. 2020年6月23日,我国北斗三号全国卫星导航系统星座部署完美收官。该导航系统应用了星载氢原子钟和铷原子钟。下列有关铷的说法错误的是( )
A、所用红磷要过量,以保证集气瓶内空气里的氧气能充分反应 B、在空气里点燃红磷后,应缓慢把燃烧匙伸入瓶内并塞紧橡皮塞 C、仍用本装置,只把红磷换成燃烧的木炭,能够更精确测定空气里氧气的含量 D、红磷燃烧时,要打开止水夹,以免瓶因温度升高,气压较大,造成橡皮塞从瓶口脱落6. 2020年6月23日,我国北斗三号全国卫星导航系统星座部署完美收官。该导航系统应用了星载氢原子钟和铷原子钟。下列有关铷的说法错误的是( )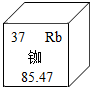 A、属于金属元素 B、元素符号是Rb C、Rb原子的最外层电子数为37 D、相对原子质量为85.477. 已知某氧原子的实际质量为mg,其相对原子质量为16。有一种铕(Eu)原子的相对原子质量为152,铕(Eu)( )A、g B、 C、g D、8. 下列说法正确的是( )A、原子呈电中性是因为原子中质子数与中子数相等 B、原子的质量主要集中在原子核上 C、温度计内汞柱液面上升说明汞原子体积变大 D、相同的原子无法构成不同的分子9. 含磷洗涤剂因含三聚磷酸钠(化学式Na5P3OX),大量使用会造成水体污染.已知三聚磷酸钠中磷元素化合价为+5价,则X值为( )A、10 B、9 C、7 D、510. 某不纯的NH4NO3化肥样品中氮元素的质量分数为38%,则此硝酸铵化肥中混入的一种氮肥可能是下列化肥中的( )A、NH4Cl B、CO(NH2)2 C、NH4HCO3 D、(NH4)2SO411. 元素钴(Co)有多种化合价,将9.3gCo(OH)2在空气中加热至290℃时完全脱水,得到8.3g钴的氧化物,该氧化物的化学式是( )A、CoO B、CoO3 C、Co2O3 D、Co3O412. 已知同温同压下,具有相同体积的任何气体中含有的分子数相同。(完成下面小题)(1)、在一定温度和压强下,10体积气体A2跟30体积气体B2化合生成20体积某气体C,则气体C的化学式为( )A、AB B、A2B C、AB3 D、AB2(2)、常温常压下两个体积相等的容器,一个充满一氧化氮气体,另一个充满氮气和氧气的混合气体,这两个容器内一定具有相同的( )A、原子总数 B、质子总数 C、电子总数 D、质量13. 醋酸又称乙酸,其分子式为CH3COOH。某技术员在分析某醋酸溶液时,测得溶液中氧元素的质量分数为80%,则该溶液中醋酸的质量分数为( )A、5% B、14% C、20% D、25%14. 在新冠疫情防控过程中,人们使用的一种免洗洗手消毒液里含有三氯羟基二苯醚(简称三氯生,化学式为C12H7O2Cl3)。下列表述正确的是( )
A、属于金属元素 B、元素符号是Rb C、Rb原子的最外层电子数为37 D、相对原子质量为85.477. 已知某氧原子的实际质量为mg,其相对原子质量为16。有一种铕(Eu)原子的相对原子质量为152,铕(Eu)( )A、g B、 C、g D、8. 下列说法正确的是( )A、原子呈电中性是因为原子中质子数与中子数相等 B、原子的质量主要集中在原子核上 C、温度计内汞柱液面上升说明汞原子体积变大 D、相同的原子无法构成不同的分子9. 含磷洗涤剂因含三聚磷酸钠(化学式Na5P3OX),大量使用会造成水体污染.已知三聚磷酸钠中磷元素化合价为+5价,则X值为( )A、10 B、9 C、7 D、510. 某不纯的NH4NO3化肥样品中氮元素的质量分数为38%,则此硝酸铵化肥中混入的一种氮肥可能是下列化肥中的( )A、NH4Cl B、CO(NH2)2 C、NH4HCO3 D、(NH4)2SO411. 元素钴(Co)有多种化合价,将9.3gCo(OH)2在空气中加热至290℃时完全脱水,得到8.3g钴的氧化物,该氧化物的化学式是( )A、CoO B、CoO3 C、Co2O3 D、Co3O412. 已知同温同压下,具有相同体积的任何气体中含有的分子数相同。(完成下面小题)(1)、在一定温度和压强下,10体积气体A2跟30体积气体B2化合生成20体积某气体C,则气体C的化学式为( )A、AB B、A2B C、AB3 D、AB2(2)、常温常压下两个体积相等的容器,一个充满一氧化氮气体,另一个充满氮气和氧气的混合气体,这两个容器内一定具有相同的( )A、原子总数 B、质子总数 C、电子总数 D、质量13. 醋酸又称乙酸,其分子式为CH3COOH。某技术员在分析某醋酸溶液时,测得溶液中氧元素的质量分数为80%,则该溶液中醋酸的质量分数为( )A、5% B、14% C、20% D、25%14. 在新冠疫情防控过程中,人们使用的一种免洗洗手消毒液里含有三氯羟基二苯醚(简称三氯生,化学式为C12H7O2Cl3)。下列表述正确的是( ) A、三氯生由碳、氢、氧、氯元素组成 B、一个三氯生分子中含有一个氧分子 C、三氯生的相对分子质量为289.5g D、三氯生中氢、氧元素质量比为7:215. 镁在空气中燃烧不仅生成氧化镁,还有部分镁与氮气化合(生成物中N呈﹣3价)。由此可以推知12克镁在空气中燃烧后所得产物的质量为( )A、等于20克 B、小于20克 C、大于20克 D、以上情况都可能16. 将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:
A、三氯生由碳、氢、氧、氯元素组成 B、一个三氯生分子中含有一个氧分子 C、三氯生的相对分子质量为289.5g D、三氯生中氢、氧元素质量比为7:215. 镁在空气中燃烧不仅生成氧化镁,还有部分镁与氮气化合(生成物中N呈﹣3价)。由此可以推知12克镁在空气中燃烧后所得产物的质量为( )A、等于20克 B、小于20克 C、大于20克 D、以上情况都可能16. 将一定量的乙醇(C2H6O)和氧气置于一个封闭的容器中引燃,测得反应前后各物质的质量如下表:物质
乙醇
氧气
水
二氧化碳
X
反应前质量/g
4.6
8.0
0
0
0
反应后质量/g
0
0
5.4
4.4
a
下列判断正确的是( )
A、表中a的值为2.6 B、X一定是该反应的催化剂 C、X可能含有氢元素 D、若起始时氧气的质量是9.6g,则无X生成17. 下列关于氧气的说法中,正确的是( )A、氧气能支持燃烧,所以氧气可作燃料 B、鱼类能在水中生存,证明氧气易溶于水 C、空气中的氧气主要来自于植物的光合作用 D、工业上分离液态空气的方法制取氧气是分解反应18. 一定质量的CH4可与常见物质M反应,同时放出少量热量;将所得产物Cu2O与O2反应又生成M,同时放出较多热量。其反应原理如图所示。下列说法正确的是( ) A、Cu2O中Cu元素化合价为﹣2价 B、理论上反应每生成44gCO2 , 同时生成18gH2O C、理论上每16gCH4参与反应,最终消耗64gO2 D、M中铜元素的质量分数比Cu2O中的高19. 某种元素化合价在化学反应前后发生了变化,则该反应为氧化还原反应。据此可判断下列化学反应属于氧化还原反应的有( )A、ZnO+H2SO4=ZnSO4+H2O B、3NO2+H2O=2HNO3+NO C、Na2CO3+2HCl=2NaCl+H2O+CO2↑ D、H2O+CO2=H2CO320. 如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子.下列说法错误的是( )
A、Cu2O中Cu元素化合价为﹣2价 B、理论上反应每生成44gCO2 , 同时生成18gH2O C、理论上每16gCH4参与反应,最终消耗64gO2 D、M中铜元素的质量分数比Cu2O中的高19. 某种元素化合价在化学反应前后发生了变化,则该反应为氧化还原反应。据此可判断下列化学反应属于氧化还原反应的有( )A、ZnO+H2SO4=ZnSO4+H2O B、3NO2+H2O=2HNO3+NO C、Na2CO3+2HCl=2NaCl+H2O+CO2↑ D、H2O+CO2=H2CO320. 如图是“尾气催化转换器”将汽车尾气中有毒气体转变为无毒气体的微观示意图,其中不同的圆球代表不同原子.下列说法错误的是( )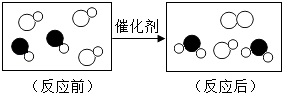 A、此反应有单质生成 B、原子在化学变化中是不可分的 C、图中生成物全部是化合物 D、参加反应的两种分子的个数比为1:121. 下列物质的性质与用途具有对应关系的是( )A、天然气难溶于水,可用作燃料 B、碳酸氢铵受热易分解,可用作化肥 C、石墨有导电性,可用于生产铅笔芯 D、二氧化碳本身不能燃烧,一般也不能帮助燃烧,可用于扑灭火灾22. 以石灰浆[Ca(OH)2、CaCO3]为原料制备超细CaCO3的原理如图。下列说法不正确的是( )
A、此反应有单质生成 B、原子在化学变化中是不可分的 C、图中生成物全部是化合物 D、参加反应的两种分子的个数比为1:121. 下列物质的性质与用途具有对应关系的是( )A、天然气难溶于水,可用作燃料 B、碳酸氢铵受热易分解,可用作化肥 C、石墨有导电性,可用于生产铅笔芯 D、二氧化碳本身不能燃烧,一般也不能帮助燃烧,可用于扑灭火灾22. 以石灰浆[Ca(OH)2、CaCO3]为原料制备超细CaCO3的原理如图。下列说法不正确的是( )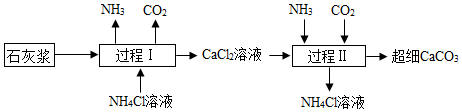 A、过程Ⅰ中产生CO2 , 说明NH4Cl溶液呈酸性 B、过程Ⅱ中NH3需过量,否则会减少超细CaCO3的产率 C、过程Ⅱ中的反应为CaCl2+2NH3+CO2+H2O═CaCO3↓+2NH4Cl D、理论上,生产过程中无须补充CO2和NH4Cl溶液23. 某净水装置如图所示。下列说法正确的是( )
A、过程Ⅰ中产生CO2 , 说明NH4Cl溶液呈酸性 B、过程Ⅱ中NH3需过量,否则会减少超细CaCO3的产率 C、过程Ⅱ中的反应为CaCl2+2NH3+CO2+H2O═CaCO3↓+2NH4Cl D、理论上,生产过程中无须补充CO2和NH4Cl溶液23. 某净水装置如图所示。下列说法正确的是( )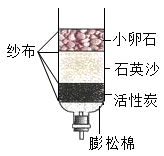 A、硬水经过该装置后可转化为软水 B、该装置能除去水中的颜色和异味 C、该装置能对水进行杀菌消毒 D、自来水经过该装置后可得蒸馏水24. 用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾( )
A、硬水经过该装置后可转化为软水 B、该装置能除去水中的颜色和异味 C、该装置能对水进行杀菌消毒 D、自来水经过该装置后可得蒸馏水24. 用如图所示装置探究CO2能否与H2O反应。滴加盐酸,待试管乙中液体变红后,将其加热至沸腾( )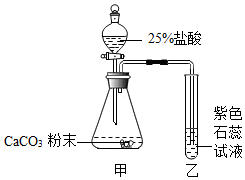 A、甲中逸出的气体只含CO2 B、乙中液体变红,证明CO2能与水反应 C、加热后红色不褪去,说明碳酸受热不分解 D、欲达到实验目的,可将盐酸改为稀硫酸
A、甲中逸出的气体只含CO2 B、乙中液体变红,证明CO2能与水反应 C、加热后红色不褪去,说明碳酸受热不分解 D、欲达到实验目的,可将盐酸改为稀硫酸二、非选择题(共50分)
-
25. 用化学用语填空(1)、2个硫酸根离子:;(2)、烧碱 ;(3)、氯化锌 ;(4)、氦气:;(5)、硝酸镁中镁的化合价 。26. 根据下列反应事实写出相应的化学方程式。(1)、实验室用“固+液→气体”的原理制氧气。(2)、电解水。(3)、用澄清石灰水检验二氧化碳。(4)、鸡蛋壳(主要成分是CaCO3)溶于食醋。(5)、碳酸氢铵受热分解。27. 某化合物在纯氧气中燃烧生成CO2和SO2 , 两者的质量之比11:32,该化合物中一定含有 和 两种元素.若此化合物是一种无色、易挥发的液体,且1个分子中含有3个原子(其中碳为+4价),则此化合物的化学式为 ;此化合物在纯氧气中燃烧的化学方程式为 .28.(1)、许多硝酸盐有受热易分解的性质,比如硝酸钠受热分解为 NaNO2 和 O2 , 硝酸铜受热分解为 CuO,NO2 和 O2 , 试写出硝酸铜分解的化学方程式。(2)、已知带火星的木条可以在 NO2 中复燃,NO2 的复燃能力与氧气相当,试问下列各组气体按体积比 4:1(前者:后者)的比例混合 ,能使带火星的木条复燃的有 ____。A、NO2、O2 B、CO2、NO2 C、O2、NO2 D、N2、NO2(3)、2.8g 纯铁充分反应可制得新型净水剂的主要成分铁酸钠(Na2FeO4)g,该净水剂中铁的化合价为价。29. 张家港市滨临长江,将长江水净化处理可成为居民生活用水。(1)、水净化时先加入絮凝剂,沉降过滤后,通过活性炭。活性炭的作用是 。
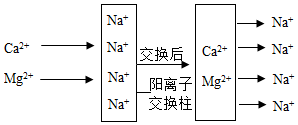 (2)、将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。一个Ca2+可以交换出 个Na+。(3)、二氧化氯(ClO2)可用于饮用水的杀菌消毒。取100mL经ClO2消毒后的饮用水于锥形瓶中,调节溶液至弱碱性,加入足量KI充分反应 , 测得生成I2的质量为0.0254mg。上述过程中发生的反应为2ClO2+2KI═2KClO2+I2 , 其他物质不参与反应。计算该饮用水中ClO2的残留量为 (以mg/L计)。30. 如图是初中化学常用实验装置(夹持装置已省略)。
(2)、将硬水通过如图所示的阳离子交换柱后可变成软水(图中阴离子未画出),交换后的水仍然呈电中性。一个Ca2+可以交换出 个Na+。(3)、二氧化氯(ClO2)可用于饮用水的杀菌消毒。取100mL经ClO2消毒后的饮用水于锥形瓶中,调节溶液至弱碱性,加入足量KI充分反应 , 测得生成I2的质量为0.0254mg。上述过程中发生的反应为2ClO2+2KI═2KClO2+I2 , 其他物质不参与反应。计算该饮用水中ClO2的残留量为 (以mg/L计)。30. 如图是初中化学常用实验装置(夹持装置已省略)。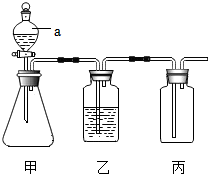 (1)、仪器a的名称是 。(2)、该装置用于实验室制取CO2:装置甲中发生反应的化学方程式为 。(3)、该装置用于实验室制取干燥的O2:乙中应放的试剂为 。检验丙中气体是否收集满的方法是 。(4)、该装置用于实验室制取干燥的H2:对装置丙所作的简单改动可以是 。31. CO2是最主要的温室气体,也是巨大的碳资源。CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
(1)、仪器a的名称是 。(2)、该装置用于实验室制取CO2:装置甲中发生反应的化学方程式为 。(3)、该装置用于实验室制取干燥的O2:乙中应放的试剂为 。检验丙中气体是否收集满的方法是 。(4)、该装置用于实验室制取干燥的H2:对装置丙所作的简单改动可以是 。31. CO2是最主要的温室气体,也是巨大的碳资源。CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。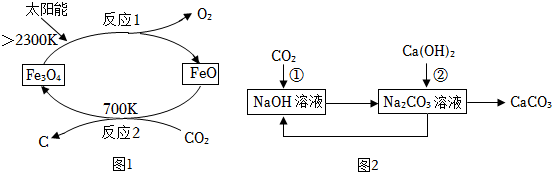 (1)、以CO2为原料制取炭黑的太阳能工艺如图1所示。
(1)、以CO2为原料制取炭黑的太阳能工艺如图1所示。①反应1的基本类型为 。
②反应2中碳元素的化合价 。(填“升高”、“不变”或“降低”)
(2)、高温、高压下以二氧化碳和氨气(NH3)为原料能够合成尿素[CO(NH2)2],同时有水生成,这也是固定和利用二氧化碳的成功范例。写出反应的化学方程式 。(3)、利用NaOH溶液吸收CO2 , 部分转化关系见图2,反应①的化学方程式为 。(4)、利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:2CO2+3H2OC2H5OH+3O2。研究显示,1L“人造树叶”每天能从空气中吸收968gCO2 , 计算1L“人造树叶”工作1天可得到乙醇的质量为 g。(5)、某研究小组设计如图3所示实验,探究CO2和H2在一定条件下反应的产物。查阅资料:
①CO2和H2在合适催化剂和一定温度下反应转化为CO和H2O;
②白色无水硫酸铜吸水后变为蓝色。

实验过程中观察到的主要现象有:B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是 。
②C装置中发生的反应的化学方程式为 。