广东省汕头市重点中学2023-2024学年高三上学期第一次阶段考试化学试题
试卷更新日期:2023-11-02 类型:月考试卷
一、选择题:本题共 16 小题,1-10每小题 2 分,11-16题每小题4分,共44 分。在每小题给出的四个选项中, 只有一项是符合题目要求的。
-
1. “天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )A、煤油是可再生能源 B、 燃烧过程中热能转化为化学能 C、火星陨石中的 质量数为20 D、月壤中的 与地球上的 互为同位素2. 化学与生活密切相关。下列说法错误的是( )A、糖类物质都属于天然高分子化合物 B、合理处理废旧电池有利于保护环境和资源利用 C、食醋可用于除去水显内壁的水垢 D、葡萄酒中添加适量的二氧化硫可防止葡萄酒的一些成分被氧化,起到保质作用3. 下列化学用语书写不正确的是( )A、CO2的结构式是O=C=O B、
 按照系统命名法的名称:2-甲基丁烷
C、中子数为10的氧原子:O
D、CH3COOH的球棍模型:
按照系统命名法的名称:2-甲基丁烷
C、中子数为10的氧原子:O
D、CH3COOH的球棍模型: 4. 用NA 代表阿伏加德罗常数的值,下列说法正确的是( )A、阿伏加德罗常数是6.02×1023 B、标准状况下,11.2LCCl4所含分子数为0.5NA C、1.8g的NH4+中含有的电子数为NA D、0.1mol·L-1的MgCl2溶液中,所含Cl-的数目为0.2NA5. 某有机合成中间体为 , 某同学根据其结构对其性质进行预测,其中错误的是( )
4. 用NA 代表阿伏加德罗常数的值,下列说法正确的是( )A、阿伏加德罗常数是6.02×1023 B、标准状况下,11.2LCCl4所含分子数为0.5NA C、1.8g的NH4+中含有的电子数为NA D、0.1mol·L-1的MgCl2溶液中,所含Cl-的数目为0.2NA5. 某有机合成中间体为 , 某同学根据其结构对其性质进行预测,其中错误的是( )选项
发生反应的原子团
反应试剂
反应类型
A
溶液
复分解反应
B

溴的四氯化碳溶液
加成反应
C

中和反应
D
-CHO
酸性溶液
氧化反应
A、A B、B C、C D、D6. 在有机合成中,常需将官能团消除或增加,下列合成路线不简洁的是( )A、乙烯乙二醇:CH2=CH2
 B、溴乙烷乙醇:CH3CH2Br CH2=CH2CH3CH2OH
C、1-溴丁烷1-丁炔:CH3CH2CH2CH2BrCH3CH2CH=CH2
B、溴乙烷乙醇:CH3CH2Br CH2=CH2CH3CH2OH
C、1-溴丁烷1-丁炔:CH3CH2CH2CH2BrCH3CH2CH=CH2 CH3CH2CCH
D、乙烯乙炔:CH2=CH2
CH3CH2CCH
D、乙烯乙炔:CH2=CH2 CHCH
7. 2022年诺贝尔化学奖授予研究“点击化学”的科学家。右图所示化合物是“点击化学”研究中的常用分子。关于该化合物,说法不正确的是( )
CHCH
7. 2022年诺贝尔化学奖授予研究“点击化学”的科学家。右图所示化合物是“点击化学”研究中的常用分子。关于该化合物,说法不正确的是( ) A、能发生加成反应 B、最多能与等物质的量的NaOH反应 C、能使溴水和酸性KMnO4溶液褪色 D、能与氨基酸和蛋白质中的氨基反应8. 环戊二烯(a)与丙烯醛(b)通过Diels-Alder反应制得双环[2,2,1]-5-庚烯-2-醛(c),反应如图所示。
A、能发生加成反应 B、最多能与等物质的量的NaOH反应 C、能使溴水和酸性KMnO4溶液褪色 D、能与氨基酸和蛋白质中的氨基反应8. 环戊二烯(a)与丙烯醛(b)通过Diels-Alder反应制得双环[2,2,1]-5-庚烯-2-醛(c),反应如图所示。
下列说法正确的是( )
A、a分子所有原子均可共平面 B、a分子通过缩合聚合反应合成有机高分子 C、b分子中的共价键个数N(σ键)∶N(π键)=7:2 D、酸性高锰酸钾溶液能将c分子氧化成 9. 测定浓硫酸试剂中 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取 待测液,用 的 溶液滴定。上述操作中,不需要用到的仪器为( )A、
9. 测定浓硫酸试剂中 含量的主要操作包括:①量取一定量的浓硫酸,稀释;②转移定容得待测液;③移取 待测液,用 的 溶液滴定。上述操作中,不需要用到的仪器为( )A、 B、
B、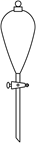 C、
C、 D、
D、
10. 下列实验装置能达到实验目的的是( )



A.混合浓硫酸和乙醇
B.分离苯和溴苯(部分装置略)
C.排空气法收集CH4
D.分离苯萃取碘水后已分层的有机层和水层
A、A B、B C、C D、D11. 下列化学用语正确的是( )A、Fe3+的价层电子排布图为: B、Ca的原子结构示意图为:
B、Ca的原子结构示意图为: C、HClO的结构式为:H-Cl-O
D、2-丁烯的反式结构:
C、HClO的结构式为:H-Cl-O
D、2-丁烯的反式结构: 12. 劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是( )
12. 劳动有利于“知行合一”。下列劳动项目与所述的化学知识没有关联的是( )选项
劳动项目
化学知识
A
帮厨活动:帮食堂师傅煎鸡蛋准备午餐
加热使蛋白质变性
B
环保行动:宣传使用聚乳酸制造的包装材料
聚乳酸在自然界可生物降解
C
家务劳动:擦干已洗净的铁锅,以防生锈
铁丝在中燃烧生成
D
学农活动:利用秸秆、厨余垃圾等生产沼气
沼气中含有的可作燃料
A、A B、B C、C D、D13. 藿香正气软胶囊具有祛湿解表、调气和中和气的功能。可用于感冒、头痛、中暑、消化不良、腹泻、呕吐等疾病,其主要成分广藿香酮的结构简式如图所示。下列关于广藿香酮的叙述正确的是( )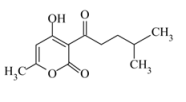 A、该有机物的分子式为C12H18O4 B、该有机物分子中含有4种含氧官能团 C、1mol该有机物与足量的H2发生加成反应最多能消耗3molH2 D、该有机物在酸性的条件下水解可以生成两种有机产物14. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。基于结构视角,下列说法正确的是( )
A、该有机物的分子式为C12H18O4 B、该有机物分子中含有4种含氧官能团 C、1mol该有机物与足量的H2发生加成反应最多能消耗3molH2 D、该有机物在酸性的条件下水解可以生成两种有机产物14. 对乙酰氨基酚是一种用于治疗疼痛与发热的药物,可用于缓解轻度至中度的疼痛,其结构如图所示。基于结构视角,下列说法正确的是( ) A、所有C原子的杂化方式均相同 B、所含元素的第一电离能:O>N>C C、该分子能与水形成分子间氢键 D、O的价层电子轨道表示式:15. 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关葡萄糖(C6H12O6)微生物电池的说法错误的是( )
A、所有C原子的杂化方式均相同 B、所含元素的第一电离能:O>N>C C、该分子能与水形成分子间氢键 D、O的价层电子轨道表示式:15. 微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关葡萄糖(C6H12O6)微生物电池的说法错误的是( ) A、正极反应中有CO2生成 B、微生物促进了反应中电子的转移 C、质子通过交换膜从负极区移向正极区 D、电池总反应为C6H12O6+6O2=6CO2+6H2O16. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的最简单氢化物是碱性气体,Y元素的原子最外层电子排布为 , Z元素的最高正价为+3,W是同周期元素中电负性最大的。下列说法正确的是( )
A、正极反应中有CO2生成 B、微生物促进了反应中电子的转移 C、质子通过交换膜从负极区移向正极区 D、电池总反应为C6H12O6+6O2=6CO2+6H2O16. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的最简单氢化物是碱性气体,Y元素的原子最外层电子排布为 , Z元素的最高正价为+3,W是同周期元素中电负性最大的。下列说法正确的是( )X Z W A、简单离子半径:X<Y B、Y的氢化物为离子化合物 C、X、Z、W三种元素的相对位置如图所示 D、Z、W的简单离子均不影响水的电离平衡二、非选择题:(共 56 分)
-
17. W是一种高分子功能材料,在生产、生活中有广泛应用。一种合成W的路线如图。

已知:

请回答下列问题:
(1)、D的名称是。G中官能团名称是。(2)、已知E的分子式为C8H8O2 , F的结构简式为。(3)、A与新制Cu(OH)2悬浊夜反应的化学方程式为。(4)、M是G的同分异构体,同时满足下列条件的结构有种(不考虑立体异构)。①遇氯化铁溶液能发生显色反应;②能与NaHCO3反应产生气体。
其中核磁共振氢谱上有5组峰且峰的面积比为1∶2∶2∶2∶1的结构简式为。
(5)、设计以2,3-二氯丁烷( )、丙烯醛(CH2=CHCHO)为原料合成苯甲醛的合成路线:(在方框内补上缺少物质)
)、丙烯醛(CH2=CHCHO)为原料合成苯甲醛的合成路线:(在方框内补上缺少物质)
 18. 以A和芳香烃E为原料制备除草剂茚草酮中间体(Ⅰ)的合成路线如下:
18. 以A和芳香烃E为原料制备除草剂茚草酮中间体(Ⅰ)的合成路线如下:
回答下列问题:
(1)、A中所含官能团的名称为。(2)、B→C的反应类型为。(3)、D中碳原子的杂化轨道类型有;其中,电负性最大的元素为。(4)、写出F→G的化学方程式。(5)、B的同分异构体中,满足下列条件的结构有种;其中,核磁共振氢谱有四组峰,且峰面积之比为6∶2∶2∶1的结构简式为。条件:①含有苯环,且只有2个取代基; ②与溶液发生显色反应;
③含有2个甲基,且连在同一个碳原子上。
(6)、利用原子示踪技术追踪G→H的反应过程:
根据上述信息,写出以乙醇和
 为原料合成
为原料合成 的路线(无机试剂任选) 。19. 试运用所学知识,研究CO等气体的性质,请回答:(1)、生产水煤气过程中有以下反应:
的路线(无机试剂任选) 。19. 试运用所学知识,研究CO等气体的性质,请回答:(1)、生产水煤气过程中有以下反应:① C(s)+CO2(g)2CO(g) △H1;
② CO(g)+H2O(g) H2(g)+CO2(g) △H2;
③ C(s)+ H2O(g)CO(g)+ H2(g) △H3;
反应③的平衡常数表达式为K=;
上述反应中△H1、△H2、△H3之间的关系为△H3=。
(2)、在一定体积的密闭容器中,进行反应②: CO(g)+H2O(g) H2(g)+CO2(g),能判断该反应达到化学平衡状态的依据是( )A、容器中压强不变 B、混合气体中 c(CO)不变 C、υ正(H2)=υ逆(H2O) D、c(CO2)=c(CO)(3)、不同温度下反应②的平衡常数如下表所示。则△H2 0(填“<”“>”);温度/℃
400
500
800
平衡常数K
9.94
9
1
在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005mol/L、c(H2)=0.015mo/L,则CO的平衡转化率为。
(4)、对于反应2NO2(g)N2O4(g) △H<0,当温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示。则T1T2(填“>”或“<”);增大压强,平衡向反应方向移动;B、C两点的平衡常数BC(填“>”或“<”)。 20. 硒()是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光()效应以来,在发光材料、生物医学等领域引起广泛关注。一种含的新型分子的合成路线如下:
20. 硒()是人体必需微量元素之一,含硒化合物在材料和药物领域具有重要应用。自我国科学家发现聚集诱导发光()效应以来,在发光材料、生物医学等领域引起广泛关注。一种含的新型分子的合成路线如下: (1)、与S同族,基态硒原子价电子排布式为。(2)、的沸点低于 , 其原因是。(3)、关于I~III三种反应物,下列说法正确的有____。A、I中仅有键 B、I中的键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠()可减轻重金属铊引起的中毒。的立体构型为。(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。
(1)、与S同族,基态硒原子价电子排布式为。(2)、的沸点低于 , 其原因是。(3)、关于I~III三种反应物,下列说法正确的有____。A、I中仅有键 B、I中的键为非极性共价键 C、II易溶于水 D、II中原子的杂化轨道类型只有与 E、I~III含有的元素中,O电负性最大(4)、IV中具有孤对电子的原子有。(5)、硒的两种含氧酸的酸性强弱为(填“>”或“<”)。研究发现,给小鼠喂食适量硒酸钠()可减轻重金属铊引起的中毒。的立体构型为。(6)、我国科学家发展了一种理论计算方法,可利用材料的晶体结构数据预测其热电性能,该方法有助于加速新型热电材料的研发进程。化合物X是通过该方法筛选出的潜在热电材料之一,其晶胞结构如图1,沿x、y、z轴方向的投影均为图2。

①X的化学式为。
②设X的最简式的式量为 , 晶体密度为 , 则X中相邻K之间的最短距离为(列出计算式,为阿伏加德罗常数的值)。