吉林省长春市朝阳区名校2023-2024学年高二上学期开学考试化学试题
试卷更新日期:2023-11-02 类型:开学考试
一、选择题
-
1. 下列有关说法中正确的是( )A、大豆油中含有不饱和脂肪酸甘油酯,可以使高锰酸钾溶液褪色 B、SiO2既能和NaOH反应,又能和HF反应,所以二氧化硅属于两性氧化物 C、水晶、玛瑙、高温结构陶瓷、压电陶瓷均为硅酸盐产品 D、蔗糖、淀粉和纤维素在稀酸的催化下均能发生水解,最终只生成葡萄糖2. 煤和石油综合利用的说法正确的是( )A、煤的气化和液化都是物理变化 B、生石灰和煤混合燃烧可减少SO2排放,CaSO3是最终产物 C、石油通过分馏和裂化都能获得汽油 D、石油分馏产品包括汽油、沥青、焦炭等3. 科技发展迅猛离不开材料的不断更新和优化。下列说法正确的是( )A、“天宫二号”空间实验室的太阳能电池将太阳能直接转换为电能 B、运载火箭使用的碳纤维属于传统无机非金属材料 C、“麒辚990”芯片采用7nm工艺,芯片的主要成分为二氧化硅 D、蛟龙号载人潜水器外壳采用的特殊钠合金材料,其熔点比单质钛的高4. 下列符号表征或说法正确的是( )A、羟基电子式:
 B、CF2Cl2的球棍模型:
B、CF2Cl2的球棍模型: C、丙酸的结构简式:CH3CH2CH2COOH
D、聚乙烯的链节:—CH2-CH2—
5. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、NH3NO2NO B、FeFe3O4Fe C、Al2O3AlAl(OH)3 D、SiO2H2SiO3Na2SiO36. 下列物质有关用途与性质的对应关系错误的是( )
C、丙酸的结构简式:CH3CH2CH2COOH
D、聚乙烯的链节:—CH2-CH2—
5. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、NH3NO2NO B、FeFe3O4Fe C、Al2O3AlAl(OH)3 D、SiO2H2SiO3Na2SiO36. 下列物质有关用途与性质的对应关系错误的是( )物质
用途
性质
A
浓硫酸
实验室干燥气体
浓硫酸具有吸水性
B
金属钠
用于冶炼钛、锆等金属
金属钠有强还原性
C
二氧化硫
常用于漂白秸秆、织物
能跟其中的有色物质结合
D
纯碱
用于清洗餐具
水溶液呈碱性
A、A B、B C、C D、D7. 分枝酸可用于生化研究,其结构简式如图。下列关王分枝酸的叙述正确的是( ) A、该有机物属于芳香族化合物 B、该有机物可发生取代反应、加成反应和氧化反应 C、该有机物的分子式是C10Hl2O6 D、该有机物分子中所有原子可能处于同一平面8. 如图所示四种化学实验操作的名称按①②③④顺序排列分别为( )
A、该有机物属于芳香族化合物 B、该有机物可发生取代反应、加成反应和氧化反应 C、该有机物的分子式是C10Hl2O6 D、该有机物分子中所有原子可能处于同一平面8. 如图所示四种化学实验操作的名称按①②③④顺序排列分别为( ) A、过滤、蒸馏、蒸发、萃取(或分液或萃取分液) B、蒸发、蒸馏、过滤、萃取(或分液或萃取分液) C、萃取(或分液或萃取分液)、过滤、蒸发、蒸馏 D、过滤、蒸发、蒸馏、萃取(或分液或萃取分液)9. 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的( )
A、过滤、蒸馏、蒸发、萃取(或分液或萃取分液) B、蒸发、蒸馏、过滤、萃取(或分液或萃取分液) C、萃取(或分液或萃取分液)、过滤、蒸发、蒸馏 D、过滤、蒸发、蒸馏、萃取(或分液或萃取分液)9. 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的( ) A、亚硫酸钠溶液、二氧化硫 B、氢氧化钠溶液、二氧化氮 C、饱和食盐水、氯气 D、硫酸溶液、氨气10. 海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。下列说法不正确的是( )
A、亚硫酸钠溶液、二氧化硫 B、氢氧化钠溶液、二氧化氮 C、饱和食盐水、氯气 D、硫酸溶液、氨气10. 海洋生物参与氮循环过程如图所示(其它含氮物质不参与反应)。下列说法不正确的是( ) A、以上六种含氮微粒,一共呈现了氮的五种价态 B、反应①~⑤中只有1个非氧化还原反应 C、反应③中若N2H4与O2反应,则N2H4作还原剂 D、反应③和⑤若生成等质量的N2 , 转移的电子数一样多11. 反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),在5L的密闭容器中进行,反应开始时NH3为1mol,半分钟后,NO的物质的量增加了0.30mol。下列叙述正确的是( )A、容器中H2O的物质的量减少了0.45mol B、NH3的平均反应速率是0.010mol/(L·s) C、当容器中NH3、O2、NO、H2O的物质的量之比是4∶5∶4∶6时,说明该反应达到平衡 D、容器中NH3的转化率为30%12. 下列实验操作、现象和得出的结论正确的是( )
A、以上六种含氮微粒,一共呈现了氮的五种价态 B、反应①~⑤中只有1个非氧化还原反应 C、反应③中若N2H4与O2反应,则N2H4作还原剂 D、反应③和⑤若生成等质量的N2 , 转移的电子数一样多11. 反应4NH3(g)+5O2(g)4NO(g)+6H2O(g),在5L的密闭容器中进行,反应开始时NH3为1mol,半分钟后,NO的物质的量增加了0.30mol。下列叙述正确的是( )A、容器中H2O的物质的量减少了0.45mol B、NH3的平均反应速率是0.010mol/(L·s) C、当容器中NH3、O2、NO、H2O的物质的量之比是4∶5∶4∶6时,说明该反应达到平衡 D、容器中NH3的转化率为30%12. 下列实验操作、现象和得出的结论正确的是( )实验操作
现象
结论
A
取少量Fe(NO3)2溶液于试管中,滴入硫酸酸化的H2O2溶液
溶液由浅绿色变为黄色
氧化性:H2O2>Fe3+
B
取2mL0.1mol/LKI溶液于试管中,加入5mL0.1mol/LFeCl3溶液,充分反应后滴入5滴10%KSCN溶液
溶液变血红色
KI与FeCl3反应有一定限度
C
向Na2SiO3溶液中通入CO2气体
有白色沉淀生成
非金属性:C>Si
D
两只试管中均加入2mL0.1mol/L酸性KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/LH2C2O4溶液,比较溶液褪色的时间
加入0.2mol/LH2C2O4溶液的褪色时间更短
其它条件相同时,反应物浓度越大,反应速率越大
A、A B、B C、C D、D13. 根据图示的能量转化关系判断下列说法正确的是( )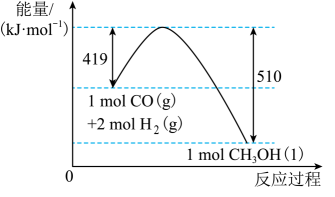 A、与反应生成32 g 吸收91 kJ能量 B、形成2 mol H-H和1 mol C≡O(CO)共吸收419 kJ的能量 C、分子中只含有极性共价键 D、1 mol 具有的能量高于2 mol 和1 mol 具有的能量14. 由一种工业废渣(主要成分为、少量Fe、Al的氧化物,其他杂质酸浸时不反应)为原料制备的实验过程如下。下列说法不正确的是( )
A、与反应生成32 g 吸收91 kJ能量 B、形成2 mol H-H和1 mol C≡O(CO)共吸收419 kJ的能量 C、分子中只含有极性共价键 D、1 mol 具有的能量高于2 mol 和1 mol 具有的能量14. 由一种工业废渣(主要成分为、少量Fe、Al的氧化物,其他杂质酸浸时不反应)为原料制备的实验过程如下。下列说法不正确的是( ) A、将废渣粉碎同时酸浸时不断搅拌可以加快酸浸时反应速率 B、“酸浸”时发生反应的离子方程式为 C、“氧化”后的溶液中存在的阳离子为、、、 D、操作X为萃取分液,使用的玻璃仪器为分液漏斗和烧杯15. 《中国碳中和与清洁空气协同路径(2022)》报告指出,我国要在2030年实现“碳达峰”,2060年前实现“碳中和”。某科研小组用电化学方法将转化为CO实现再利用,转化的基本原理如图所示。下列说法不正确的是( )
A、将废渣粉碎同时酸浸时不断搅拌可以加快酸浸时反应速率 B、“酸浸”时发生反应的离子方程式为 C、“氧化”后的溶液中存在的阳离子为、、、 D、操作X为萃取分液,使用的玻璃仪器为分液漏斗和烧杯15. 《中国碳中和与清洁空气协同路径(2022)》报告指出,我国要在2030年实现“碳达峰”,2060年前实现“碳中和”。某科研小组用电化学方法将转化为CO实现再利用,转化的基本原理如图所示。下列说法不正确的是( ) A、该装置能将化学能转化为电能 B、N极电极反应方程式为 C、工作一段时间后,M电极室中的溶液pH下降 D、外电路中,电流由N极经负载流向M极16. 将铜镁合金完全溶解于某浓度的硝酸中,得到和的混合气体(标准状况),当向反应后的溶液中加入一定浓度溶液时,金属离子全部转化为沉淀,测得沉淀的质量为。和的混合气体中,的体积分数是( )A、 B、 C、 D、
A、该装置能将化学能转化为电能 B、N极电极反应方程式为 C、工作一段时间后,M电极室中的溶液pH下降 D、外电路中,电流由N极经负载流向M极16. 将铜镁合金完全溶解于某浓度的硝酸中,得到和的混合气体(标准状况),当向反应后的溶液中加入一定浓度溶液时,金属离子全部转化为沉淀,测得沉淀的质量为。和的混合气体中,的体积分数是( )A、 B、 C、 D、二、填空题
-
17. 海洋资源的利用具有广阔前景。(1)、下图是从海水中提取粗溴的主要流程

①从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是。
②可用热空气吹出溴是因为溴的(选填编号)
A.熔点较低 B.熔点较高 C.沸点较低 D.沸点较高
(2)、海带灰中富含以形式存在的碘元素。实验室提取的途径如下所示:
①灼烧海带至灰烬时所用的主要仪器名称是。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式。反应结束后,再加入作萃取剂,振荡、静置,该步操作用到的仪器名称为 , 可以观察到层呈色。
18. 化学反应伴随能量变化,获取反应能量变化有多条途径。(1)、下列反应中,属于吸热反应的是____(填字母)。A、Na2O与水反应 B、甲烷的燃烧反应 C、Ba(OH)2·8H2O与氯化铵反应 D、锌与盐酸反应(2)、获取能量变化的途径①通过化学键的键能计算。已知:
化学键种类
H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
247
434
计算可得:H2(g)+Cl2(g)=2HCl(g) △H= kJ·mol-1
②通过盖斯定律可计算。已知在25℃、101 kPa时:
I.2Na(s)+O2(g)=Na2O(s) △H=-414 kJ·mol-1
II.2Na(s)+O2(g)=Na2O2(s) △H=-511 kJ·mol-1
写出Na2O2与Na反应生成Na2O的热化学方程式:。
(3)、以CO2(g)和H2(g)为原料合成甲醇,反应的能量变化如下图所示。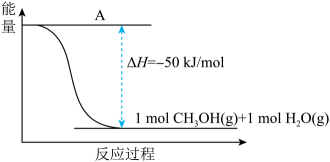
①补全上图:图中A处应填入。
②该反应需要加入铜-锌基催化剂。加入催化剂后,该反应的△H(填“变大”“变小”或“不变”)。
③某研究者分别以甲醇和汽油做燃料,实验测得在发动机高负荷工作情况下,汽车尾气中CO的百分含量与汽车的加速性能的关系如图所示。
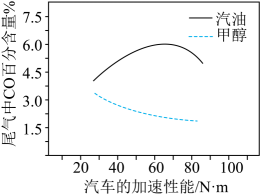
据图信息分析,与汽油相比,甲醇作为燃料的优点是。
19. 某研究性学习小组利用如图装置制备 , 并对的性质进行探究(装置的气密性已检查)。 (1)、Ⅰ.探究与可溶性钡的强酸盐是否反应(接口a接b)
(1)、Ⅰ.探究与可溶性钡的强酸盐是否反应(接口a接b)
滴加浓硫酸之前,打开弹簧夹,通入一段时间 , 再关闭弹簧夹,此操作的目的是。(2)、实验过程中装置B中没有明显变化,装置C中有白色沉淀生成,该沉淀不溶于稀盐酸。据B中现象得出的结论是 , 装置C中反应的离子方程式是。(3)、装置D中全部转化为的离子方程式为:。(4)、Ⅱ.探究亚硫酸与次氯酸的酸性强弱(接口a接c)
将少量装置A中生成的气体直接通入装置G中,不能根据G中现象判断亚硫酸与次氯酸的酸性强弱,理由是(5)、为了验证亚硫酸与次氯酸的酸性强弱,需要制备一种中间酸,装置E中药品是 , 其作用是 , 通过现象即可证明亚硫酸的酸性强于次氯酸。20. 以淀粉为主要原料合成一种具有果香味的物质C和化合物D的合成路线如下图所示。
请回答下列问题:
(1)、反应⑦中物质X的分子式为 , 反应⑧的类型为。(2)、反应③的化学方程式为。(3)、反应⑥用于实验室制乙烯,为除去其中可能混有的SO2应选用的试剂是。(4)、检验反应①进行程度,需要的试剂有____。A、新制的Cu(OH)2悬浊液 B、碘水 C、NaOH溶液 D、FeCl3溶液(5)、乙烯的同系物丙烯(CH2=CH-CH3)可以通过加聚反应生成高分子化合物,其结构简式是。