吉林省吉林市重点中学2023-2024学年高二上学期9月月考化学试题
试卷更新日期:2023-11-02 类型:月考试卷
一、单选题(1-15每题2分,16-25每题3分)
-
1. 下列不属于自发进行的变化是( )A、红墨水加到清水中使整杯水变红 B、冰在室温下融化成水 C、向氢氧化钠溶液中滴加盐酸 D、常温常压下,石墨转化为金刚石2. 已知H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6 kJ·mol-1 , 则反应HCl(g)= H2(g)+Cl2(g)的ΔH为( )A、+184.6 kJ·mol-1 B、-92.3 kJ·mol-1 C、-369.2 kJ·mol-1 D、+92.3 kJ·mol-13. 在反应2A(g)+B(s)=3C(g)+4D(g)中,表示的反应速率最快的是( )A、 B、 C、 D、4. 关于二次电池铅蓄电池的说法中错误的是( )A、在放电时,该电池的负极质量增加 B、在放电时,电池中硫酸的浓度减小 C、当两极物质都转化为PbSO4时,铅蓄电池将停止工作 D、在放电时,正极发生的反应是:Pb+ =PbSO4+2e-5. 某温度下,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数 , 在同一温度下,反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数为( )A、2500 B、50 C、0.02 D、0.056. 对于反应: , 在密闭容器中进行,下列条件能加快反应速率的是( )A、增大体积使压强减小 B、体积不变,充入氦气使压强增大 C、体积不变,充入使压强增大 D、使总压强不变,充入氖气7. 羰基硫(COS)作为一种粮食熏蒸剂广泛应用于农药工业,由和CO合成COS的反应分两步进行,其能量变化如图所示。下列说法正确的是( )
 A、催化剂可以降低反应的焓变 B、①②步反应的焓变和小于总反应的焓变 C、总反应的速率由①步反应决定 D、反应过程中只有化学键的形成,没有化学键的断裂8. 在25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的摩尔燃烧焓依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )A、C(s)+O2(g)=CO(g) ΔH=-393.5 kJ/mol B、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol C、2H2(g)+O2(g)=2H2O(l) ΔH=+571.6 kJ/mol D、C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) ΔH=-1 400 kJ/mol9. 某双液原电池装置如图所示,(盐桥:装有含琼胶的饱和溶液)。下列有关叙述中不正确的是( )
A、催化剂可以降低反应的焓变 B、①②步反应的焓变和小于总反应的焓变 C、总反应的速率由①步反应决定 D、反应过程中只有化学键的形成,没有化学键的断裂8. 在25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的摩尔燃烧焓依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、2 800 kJ/mol,则下列热化学方程式正确的是( )A、C(s)+O2(g)=CO(g) ΔH=-393.5 kJ/mol B、CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ/mol C、2H2(g)+O2(g)=2H2O(l) ΔH=+571.6 kJ/mol D、C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) ΔH=-1 400 kJ/mol9. 某双液原电池装置如图所示,(盐桥:装有含琼胶的饱和溶液)。下列有关叙述中不正确的是( ) A、作负极,发生氧化反应 B、电子流动方向:铁石墨稀硫酸盐桥氯化钠溶液 C、工作一段时间后,左侧烧杯中增大 D、正极反应式:10. 测定稀盐酸和稀NaOH溶液中和反应反应热的实验中没有使用的仪器有( )
A、作负极,发生氧化反应 B、电子流动方向:铁石墨稀硫酸盐桥氯化钠溶液 C、工作一段时间后,左侧烧杯中增大 D、正极反应式:10. 测定稀盐酸和稀NaOH溶液中和反应反应热的实验中没有使用的仪器有( )①漏斗 ②容量瓶 ③量筒 ④搅拌器 ⑤试管 ⑥温度计 ⑦蒸发皿
⑧托盘天平
A、①②⑥⑦ B、②⑤⑦⑧ C、②③⑦⑧ D、③④⑤⑦11. 25℃、1.01×105Pa时,反应2N2O5(g)=4NO2(g)+O2(g) ΔH=+109.8kJ·mol-1 , 该反应能自发进行的原因是( )A、该反应是吸热反应 B、该反应是放热反应 C、该反应是熵减小的反应 D、该反应的熵增大效应大于能量效应12. 把1.2 mol A气体和0.8 mol B气体混合于容积为2 L的容器中,使其发生如下反应:3A(g)+B(g) nC(g)+2D(g),5 min末生成0.4 mol D,若测知以C浓度变化表示的平均反应速率为0.04 mol·L-1·min-1 , 则n的值为( )A、2 B、3 C、4 D、513. 甲醇与水蒸气在催化剂作用下发生如下反应:反应Ⅰ:CH3OH(g) CO (g)+ 2H2(g) ΔH1
反应Ⅱ:CO (g)+ H2O(g) CO2 (g)+ H2(g) ΔH2
根据能量变化示意图,下列说法正确的是( )
 A、E3-E2>E4-E1 B、反应Ⅱ决定整个反应的速率 C、催化剂可以降低总反应的焓变 D、CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=ΔH1-ΔH214. 对可逆反应 , 在一定条件下达到平衡,下列有关叙述正确的是( )A、增大压强,平衡不移动,的浓度不变 B、当体系的平均相对分子质量不变时,反应达到平衡 C、升高温度,化学平衡常数增大 D、减小的浓度,v(正)增大,v(逆)减小,平衡正向移动15. 有平衡体系:N2(g)+3H2(g) 2NH3(g) ΔH<0,为了增加氨气的产量,应采用的正确措施是( )A、高温、高压 B、适宜温度、高压、催化剂 C、低温、低压 D、高温、高压、催化剂16. 肼(N2H4)空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。下列说法中,不正确的是( )A、该电池放电时,通入肼的一极为负极 B、电池每释放1 mol N2转移的电子数为4NA C、通入空气的一极的电极反应式是O2+2H2O+4e-=4OH- D、电池工作一段时间后,电解质溶液的碱性增强17. 对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是( )
A、E3-E2>E4-E1 B、反应Ⅱ决定整个反应的速率 C、催化剂可以降低总反应的焓变 D、CH3OH(g)+H2O(g) CO2(g)+3H2(g) ΔH=ΔH1-ΔH214. 对可逆反应 , 在一定条件下达到平衡,下列有关叙述正确的是( )A、增大压强,平衡不移动,的浓度不变 B、当体系的平均相对分子质量不变时,反应达到平衡 C、升高温度,化学平衡常数增大 D、减小的浓度,v(正)增大,v(逆)减小,平衡正向移动15. 有平衡体系:N2(g)+3H2(g) 2NH3(g) ΔH<0,为了增加氨气的产量,应采用的正确措施是( )A、高温、高压 B、适宜温度、高压、催化剂 C、低温、低压 D、高温、高压、催化剂16. 肼(N2H4)空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。下列说法中,不正确的是( )A、该电池放电时,通入肼的一极为负极 B、电池每释放1 mol N2转移的电子数为4NA C、通入空气的一极的电极反应式是O2+2H2O+4e-=4OH- D、电池工作一段时间后,电解质溶液的碱性增强17. 对于可逆反应N2(g)+3H2(g) 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是( )
 A、①压强对反应的影响 B、②温度对反应的影响 C、③恒容平衡体系增加c(N2)对反应的影响 D、④催化剂对反应的影响18. 2SO2(g)+O2(g)2SO3(g) ΔH=−198 kJ·mol-1 , 在V2O5存在时,该反应的机理为:V2O5+SO22VO2+SO3(快),4VO2+O22V2O5(慢)。下列说法中正确的是( )A、反应速率主要取决于V2O5的质量 B、V2O5是该反应的催化剂 C、其他条件不变时,逆反应的活化能小于198 kJ·mol-1 D、增大SO2的浓度可显著提高反应速率19. 已知 , 蒸发需要吸收的能量为30kJ,其它相关数据如下表,则反应的能量变化为( )
A、①压强对反应的影响 B、②温度对反应的影响 C、③恒容平衡体系增加c(N2)对反应的影响 D、④催化剂对反应的影响18. 2SO2(g)+O2(g)2SO3(g) ΔH=−198 kJ·mol-1 , 在V2O5存在时,该反应的机理为:V2O5+SO22VO2+SO3(快),4VO2+O22V2O5(慢)。下列说法中正确的是( )A、反应速率主要取决于V2O5的质量 B、V2O5是该反应的催化剂 C、其他条件不变时,逆反应的活化能小于198 kJ·mol-1 D、增大SO2的浓度可显著提高反应速率19. 已知 , 蒸发需要吸收的能量为30kJ,其它相关数据如下表,则反应的能量变化为( )1mol分子中的化学键断裂时需要吸收的能量/kJ
436
200
369
A、放出72kJ B、吸收72kJ C、放出102kJ D、吸收102kJ20. 将盛有NH4HCO3粉末的小烧杯放入盛有少量醋酸的大烧杯中。然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固。由此可见( )A、NH4HCO3和盐酸的反应是放热反应 B、该反应中,热能转化为产物内部的能量 C、反应物的总能量高于生成物的总能量 D、反应的热化学方程式为:NH4HCO3+HCl=NH4Cl+CO2↑+H2O ΔH=+Q kJ/mol21. 在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应:CO(g)+H2O(g) CO2(g)+H2(g),达到平衡时测得n(H2)=0.5 mol,下列说法不正确的是( )
A、在该温度下,反应的平衡常数K=1 B、平衡常数与反应温度无关 C、CO的平衡转化率为50% D、平衡时n(H2O)=0.5 mol22. 已知:①Zn(s)+O2(g)= ZnO(s) ΔH1=-351.1 kJ·mol-1②Hg(l)+O2(g)=HgO(s) ΔH2=-90.7 kJ·mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变是( )
A、-441.8 kJ·mol-1 B、-254.6 kJ·mol-1 C、-438.9 kJ·mol-1 D、-260.4 kJ·mol-123. 在一个不传热的固定容积的密闭容器中发生可逆反应:mA(g)+nB(g)⇌pC(g)+qD(g)(m、n、p、q为任意整数)。下列不能作为达到平衡状态的标志的是( )
A、单位时间内有m mol A消耗,同时有p mol C生成 B、体系的温度不再改变 C、各组分的浓度不再改变 D、各组分的质量分数不再改变24. 用CH4和O2组合形成的质子(H+)交换膜燃料电池的结构如图所示,下列说法错误的是( ) A、电流通过外电路从d极流向c极 B、电极c的电极反应式为CH4-8e-+2H2O=CO2+8H+ C、b气体为O2 D、若电路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为22.4L25. 工业合成 , 一般采用左右的温度,其原因是:( )
A、电流通过外电路从d极流向c极 B、电极c的电极反应式为CH4-8e-+2H2O=CO2+8H+ C、b气体为O2 D、若电路中转移2 mol电子,则该燃料电池理论上消耗的O2在标准状况下的体积为22.4L25. 工业合成 , 一般采用左右的温度,其原因是:( )①提高的平衡转化率 ②适当提高氨的合成速率 ③提高氨的产率 ④催化剂在左右时活性最大
A、只有① B、②④ C、②③④ D、①②二、填空题
-
26. 某研究小组探究原电池的原理并进行实验。(1)、下列反应中,可通过原电池装置实现化学能直接转化为电能的是(选填序号)
①1
②③
④(2)、氢氧燃料电池汽车作为上海世博园中的交通工具之一,下列不正确的是____。(单选)A、太阳光催化分解水制氢气比电解水气氢气更为科学 B、氢氧燃料电池作为汽车动力更能保护环境 C、以稀、KOH为介质的氢氧燃料电池的负极电极反应式相同 D、以稀、KOH为介质的氢氧燃料电池的总反应式相同(3)、纯电动车采用了高效耐用的一种新型可充电电池,该电池的总反应式为:①该电池放电时正极反应式为。
②放电时每转移3mol电子,正极有mol被还原。
(4)、铅蓄电池因其电压稳定、使用方便、安全可靠、价格低康,当前在燃油车上应用依然占主导地位,电池反应式为: , 下列有关说法正确的是。(双选)
A.Pb为电池的负极,发生氧化反应,电极方程式为:
B.铅蓄电池放电时,正、负电极质量均增大
C.铅蓄电池放电时,定向移动去极
D.放电过程中,正极区附近pH减小
(5)、如图为甲烷燃料电池的结构示意图,电解质溶液为NaOH溶液,电极材料为疏松多孔的石墨棒。回答下列问题:
①a极通入的物质为(填物质名称),电解质溶液中的OH-移向 (“负”或“正”。
②写出此甲烷燃料电池工作时负极的电极反应:。
27. 根据信息书写热化学方程式 (1)、 化学反应N2+3H22NH3的能量变化如图所示试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:。(2)、 在一定条件下,将2 molSO2和1 mol O2充入一密闭容器中发生反应生成SO3 , 达到平衡时SO2的转化率为25%,放出Q kJ的热量,写出SO2和O2反应的热化学方程式为。(3)、 SiHCl3在催化剂作用下发生反应:
(1)、 化学反应N2+3H22NH3的能量变化如图所示试写出N2(g)和H2(g)反应生成NH3(l)的热化学方程式:。(2)、 在一定条件下,将2 molSO2和1 mol O2充入一密闭容器中发生反应生成SO3 , 达到平衡时SO2的转化率为25%,放出Q kJ的热量,写出SO2和O2反应的热化学方程式为。(3)、 SiHCl3在催化剂作用下发生反应:2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g)ΔH1=+48 kJ·mol-1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g)ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g)=SiH4(g)+3SiCl4(g)的ΔH为kJ·mol-1。
(4)、 某学生通过测定反应过程中所放出的热量来计算中和反应的反应热,将100 mL 0.50 mol·L-1盐酸与100 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应(在稀溶液中,可以近似地认为酸、碱的密度、比热容与水的相等)。回答下列问题:
①从实验装置上看,图中玻璃搅拌器的作用是。
②简易量热计如果不盖杯盖,生成1 mol H2O(l)时所测得中和反应的反应热(ΔH)将(填“偏大”“偏小”或“不变”),判断的理由是。
③若用等体积等物质的量浓度的CH3COOH进行上述实验,生成1 mol H2O(l)时,所测得的中和反应的反应热的绝对值(|ΔH|)将(填“偏大”“偏小”或“无影响“),判断的理由是。
28. 完成下列问题(1)、 一定条件下,在一体积不变的密闭容器中发生反应: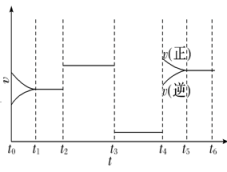
2A(g)+B(g)3C(g) ΔH=a kJ·mol-1。图为反应体系中反应速率随时间变化的情况,且t2、t3、t4各改变一种不同的条件。
①t3时改变的条件为 , t4时改变的条件为。
②a(填“>”或“<”)0。
(2)、已知反应CO(g)+2H2(g)CH3OH(g),在恒容密闭容器中按加入CO和H2合成甲醇,测得起始压强p0=102 kPa。CO的平衡转化率[α(CO)]随温度的变化曲线如图所示,R点时反应的平衡常数Kp=(kPa)-2(用平衡分压代替平衡浓度计算,p分=p总×物质的量分数),R、S两点平衡常数大小:Kp(R)(填“>”“=”或“<”)Kp(S)。
 (3)、CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是。
(3)、CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g) CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图所示。该反应的ΔH0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是。