广东省阳江市2023-2024学年高二上学期10月月考化学试题
试卷更新日期:2023-11-02 类型:月考试卷
一、选择题:本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 岭南文化历史悠久,广东是岭南文化的重要传承地,下列关于岭南文化所涉及物质的主要成分属于有机高分子化合物的是( )
选项
A
B
C
D
地方文化
 顺德木制龙舟
顺德木制龙舟 广州珐琅
广州珐琅 梅州长乐烧酒
梅州长乐烧酒 茂名“岭南圣母”冼太夫人铜像A、A B、B C、C D、D2. 氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br- , 可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO与ClO , 在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是( )A、NaClO3具有氧化性,可用于制取ClO2 B、Cl2有还原性,可用于从海水中提取溴 C、HClO不稳定,可用于棉、麻漂白 D、FeCl3溶液呈酸性,可用于蚀刻印刷电路板3. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向漂白粉水溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2 = CaSO3↓+2HClO B、向饱和碳酸钠溶液中通入足量CO2:2Na++CO+H2O+CO2 = 2NaHCO3↓ C、向Fe2(SO4)3溶液中通入过量H2S:2Fe3+ +H2S = 2Fe2++S↓+ 2H+ D、向澄清石灰水中滴加少量Ca(HCO3)2溶液:Ca2++HCO+OH- = CaCO3↓+ H2O4. 下列实验过程能达到实验目的的是
茂名“岭南圣母”冼太夫人铜像A、A B、B C、C D、D2. 氯及其化合物应用广泛。氯的单质Cl2可由MnO2与浓盐酸共热得到,Cl2能氧化Br- , 可从海水中提取Br2;氯的氧化物ClO2可用于自来水消毒,ClO2是一种黄绿色气体,易溶于水,与碱反应会生成ClO与ClO , 在稀硫酸和NaClO3的混合溶液中通入SO2气体可制得ClO2;漂白液和漂白粉的有效成分是次氯酸盐,可作棉、麻的漂白剂。下列关于氯及其化合物的性质与用途具有对应关系的是( )A、NaClO3具有氧化性,可用于制取ClO2 B、Cl2有还原性,可用于从海水中提取溴 C、HClO不稳定,可用于棉、麻漂白 D、FeCl3溶液呈酸性,可用于蚀刻印刷电路板3. 对于下列实验,不能正确描述其反应的离子方程式是( )A、向漂白粉水溶液中通入少量SO2:Ca2++2ClO-+H2O+SO2 = CaSO3↓+2HClO B、向饱和碳酸钠溶液中通入足量CO2:2Na++CO+H2O+CO2 = 2NaHCO3↓ C、向Fe2(SO4)3溶液中通入过量H2S:2Fe3+ +H2S = 2Fe2++S↓+ 2H+ D、向澄清石灰水中滴加少量Ca(HCO3)2溶液:Ca2++HCO+OH- = CaCO3↓+ H2O4. 下列实验过程能达到实验目的的是选项
实验目的
实验过程
A
检验某铁的氧化物含二价铁
将该氧化物溶于浓盐酸,滴入KMnO4溶液,紫色褪去
B
检验乙醇中含有水
向乙醇中加入一小粒金属钠,产生无色气体
C
证明酸性:H2SO3>HClO
在Ca(ClO)2溶液中通入SO2 , 产生白色沉淀
D
证明:CO2有氧化性
将点燃的镁条,迅速伸入盛满CO2的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生
A、A B、B C、C D、D5. 从电镀污泥(含Ni2+、Ca2+、Fe3+、Al3+等)中提取镍的工艺流程如图所示,下列说法错误的是
已知:丁二酮肟可与Ni2+反应生成易溶于有机溶剂的配合物:Ni2++2C4H8N2ONi(C4H7N2O)2+2H+
A、“氨浸”可除去Ca2+、Fe3+、Al3+等金属阳离子 B、进行操作I时,将有机相从分液漏斗上口倒出 C、操作II为反萃取,试剂X可为盐酸,有机相可返回操作I循环使用 D、操作III可能为过滤、洗涤、干燥、灼烧6. 中国先进研究堆是开展中子物理基础研究与应用、反应堆燃料与材料辐照性能研究,以及放射性同位素辐照研发的重要科学研究和实验应用平台。下列说法不正确的是( )A、中子位于原子核内部,不带电荷 B、与质子数相同、中子数不同 C、钠钾合金可用做反应堆的导热剂、工作时呈液态 D、某元素由放射性同位素转化为稳定同位素的过程,属于化学变化7. 物质的性质决定其用途。下列生产活动与化学原理均正确且有关联的是( )选项
生产活动
化学原理
A
石英坩埚可用于加热固体
熔点高
B
可作食品干燥剂
具有强吸水性
C
可用于抗酸药物
受热易分解
D
钠的化合物可用于制作烟花
钠元素焰色实验显黄色
A、A B、B C、C D、D8. 按图装置进行实验。将稀硫酸全部加入Ⅰ中的试管,关闭活塞。下列说法正确的是( )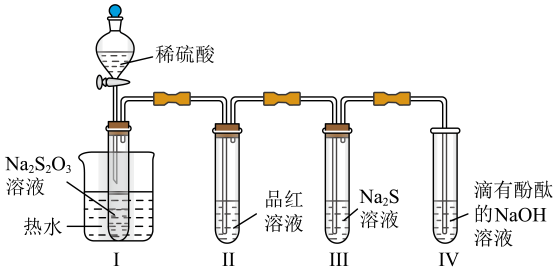 A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去9. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
A、Ⅰ中试管内的反应,体现的氧化性 B、Ⅱ中品红溶液褪色,体现的还原性 C、在Ⅰ和Ⅲ的试管中,都出现了浑浊现象 D、撤掉水浴,重做实验,Ⅳ中红色更快褪去9. 下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )选项
陈述Ⅰ
陈述Ⅱ
A
用KSCN溶液鉴别FeCl2和FeCl3
Fe3+与SCN-发生氧化还原反应
B
合成氨需在高温高压下才能进行反应
该反应为吸热反应
C
冷的浓硫酸可以用铁制容器盛放
浓H2SO4具有强氧化性
D
油脂和汽油都是油
一定条件下都能发生皂化反应
A、A B、B C、C D、D10. 下列实验操作、现象及结论均正确的是( )实验操作
现象
结论
A
向溶液中加入碘水
溶液变为黄色
的氧化性比强
B
将镁与铝用导线连接后放入氢氧化钠溶液中
镁表面产生气泡
通常情况下,镁的金属性比铝强
C
将灼热的木炭加入到浓硝酸中
有红棕色气体产生
木炭在加热时能与浓硝酸发生反应
D
向试管中依次加入乙醇、浓硫酸、乙酸和碎瓷片,加热,用饱和碳酸钠溶液收集
有无色液体产生
实验室可用此方法制备乙酸乙酯
A、A B、B C、C D、D11. 已知:在标准压强下,由最稳定的单质合成物质的反应焓变,叫作物质的标准摩尔生成焓,用表示。部分物质的有如图所示关系。的标准摩尔生成焓为0。下列有关判断正确的是( ) A、的键能小于与的键能之和 B、根据图中信息,可判断热稳定性肼大于氨 C、和合成氨,正反应的活化能一定大于 D、与反应的热化学方程式为:12. 某恒容密闭容器中,只改变温度(T)或压强(p),水蒸气百分含量随时间的变化趋势符合下图所示的反应是( )
A、的键能小于与的键能之和 B、根据图中信息,可判断热稳定性肼大于氨 C、和合成氨,正反应的活化能一定大于 D、与反应的热化学方程式为:12. 某恒容密闭容器中,只改变温度(T)或压强(p),水蒸气百分含量随时间的变化趋势符合下图所示的反应是( ) A、 B、 C、 D、13. 在恒温恒容条件下,发生反应 , 随时间的变化如图中曲线所示,其中表示的初始浓度。下列说法不正确的是( )
A、 B、 C、 D、13. 在恒温恒容条件下,发生反应 , 随时间的变化如图中曲线所示,其中表示的初始浓度。下列说法不正确的是( ) A、a点的瞬时速率大于b点的瞬时速率 B、对应的时间为 C、从a、b两点坐标可求得从到时间间隔内该化学反应的平均速率 D、在不同时刻都存在关系:14. 制备过程中的能量变化如下图所示,下列说法正确的是( )
A、a点的瞬时速率大于b点的瞬时速率 B、对应的时间为 C、从a、b两点坐标可求得从到时间间隔内该化学反应的平均速率 D、在不同时刻都存在关系:14. 制备过程中的能量变化如下图所示,下列说法正确的是( ) A、 , B、中共价键的键能约为 C、 D、很小,说明沸点很高15. 下列表示反应的离子方程式正确的是( )A、向溶液中通入过量的氯气: B、溶液与少量的溶液混合: C、将溶液滴入明矾溶液中至沉淀质量最大: D、用醋酸和淀粉-KI溶液检验加碘盐中的:16. (亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备的流程如图所示,下列说法错误的是( )
A、 , B、中共价键的键能约为 C、 D、很小,说明沸点很高15. 下列表示反应的离子方程式正确的是( )A、向溶液中通入过量的氯气: B、溶液与少量的溶液混合: C、将溶液滴入明矾溶液中至沉淀质量最大: D、用醋酸和淀粉-KI溶液检验加碘盐中的:16. (亚氯酸钠)是造纸工业中常见的漂白剂,与可燃物接触易爆炸。一种制备的流程如图所示,下列说法错误的是( ) A、的漂白原理与相似 B、气体1、气体2分别是、 C、反应3的离子方程式: D、“分离”操作过程包括结晶、过滤、乙醇洗涤等
A、的漂白原理与相似 B、气体1、气体2分别是、 C、反应3的离子方程式: D、“分离”操作过程包括结晶、过滤、乙醇洗涤等二、非选择题:本题共4小题,共56分。
-
17. 某研究性学习小组探究硫的化合物的制备和性质。(1)、Ⅰ.制备二氧化硫
用70%的浓硫酸与固体反应制备气体。
制备气体最合适的发生装置是(填写字母)。 (2)、Ⅱ.制备硫代硫酸钠已知:硫代硫酸钠易与酸反应。反应原理:室温时,往、混合溶液中均匀通入气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入气体。制备反应分三步进行
(2)、Ⅱ.制备硫代硫酸钠已知:硫代硫酸钠易与酸反应。反应原理:室温时,往、混合溶液中均匀通入气体,一段时间后,溶液中有大量黄色浑浊物出现,然后浑浊物开始由黄变浅,当混合溶液pH值接近于7时,停止通入气体。制备反应分三步进行反应i:;
反应ii:;
反应iii的化学方程式为。
(3)、当pH值接近于7时,停止通入的原因是。(4)、Ⅲ.探究浓度对反应速率的影响相同温度下,按下表中的体积将溶液、溶液与蒸馏水温合,并采集反应后浑浊度传感器数据。
通过实验绘制出的浑浊度随时间变化关系如图所示:实验标号 V(蒸馏水)/mL A 1.5 3.5 10 B 2.5 3.5 9 C 3.5 3.5 8 D 3.5 2.5 9 E 3.5 1.5 10 
①实验C、D、E探究溶液浓度对反应速率的影响。②结合图像分析,溶液、溶液二者相比,溶液浓度的改变对化学反应速率的影响更大。
(5)、Ⅳ.探究性质资料:在酸性溶液中氧化 , 反应为:。向某浓度的过量酸性溶液(含淀粉)中通入一定量后,停止通气,刚开始时溶液无明显变化,t秒后溶液突然变蓝。某实验小组提出假设:t秒前生成了 , 但继续与溶液中的反应,且该反应速率较快,故溶液没有立刻变蓝,请写出与反应的离子方程式。18. 氯化氰(CNCl),又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,实验装置如图所示。回答下列问题:
已知:①CNCl的熔点为-6.5℃,沸点为13.1℃,可溶于水并与水反应;NaCN具有较强的还原性。
②合成原理:在-10℃~-5℃条件下,Cl2+NaCN=NaCl+CNCl。
(1)、N2可用装置A制备。盛放饱和NaNO2溶液的仪器名称为 , 写出装置A中发生反应的化学方程式:。(2)、装置F中干冰和丙酮的作用是降低温度,此时干冰(填“升华”或“凝华”);装置G的作用是。(3)、实验中,先向D中通入(填“N2”或“Cl2”),此操作的目的是。(4)、实验中必须保持温度在-10~-5℃,若高于-5℃,CNCl与NaCN反应产生NaCl和与卤素性质相似的气体(填化学式)。(5)、向盛有少量Na2S溶液的试管中通入CNCl,然后向其中滴入一滴FeCl3溶液,溶液显红色,其原因是(用离子方程式说明)。19. 以含钛高炉渣(主要成分为 , 还含有少量CaO、Fe2O3、)为原料生产的工艺流程如下:
已知:
①浸出液的pH小于0.5
②相关金属离子时,形成氢氧化物沉淀的pH范围如下:
金属离子
开始沉淀的pH
0.5
6.3
1.5
沉淀完全的pH
2.5
8.3
2.8
请回答以下问题:
(1)、“浸渣”的主要成分为(填化学式)。(2)、为了提高“酸浸”的浸取率,可采取的措施为(任写一条)。(3)、加入时所发生氧化还原反应的离子方程式为。20. 辉铜矿(主要成分是 Cu2S)含铜量高,是最重要的炼铜矿石。请回答下列问题:(1)、Ⅰ.已知:①2Cu2S(s) + 3O2(g) = 2Cu2O(s) + 2SO2(g) △H= -768.2kJ·mol-1②Cu2S(s) + O2(g)= 2Cu(s) + SO2(g) △H = -217.4kJ·mol-1
Cu2S与Cu2O反应生成Cu和SO2的热化学方程式为 , 该反应中Cu2O作(填"氧化剂”或“还原剂”)。(2)、Ⅱ. Cu2O可催化二甲醚合成乙醇。反应①:CH3OCH3(g) + CO(g)CH3COOCH3(g) △H1反应②:CH3COOCH3(g) + 2H2(g) CH3OH(g) + C2H5OH(g) △H2
压强为p kPa时同一体系中发生反应①和反应②,湿度对二甲醚(CH3OCH3 )和乙酸甲酯(CH3COOCH3 )平衡转化率的影响如图1所示,则△H10 (填“>”或“<”,下同)、△H20,温度对平衡体系中乙酸甲酯的百分含量和乙醇的百分含量的影响如图2所示。在300 - 600K范围内,乙酸甲酯的百分含量逐渐增大,而乙醇的百分含量逐渐减小的原因是。 (3)、若压强为p kPa、温度为800K时向2L恒容密闭容器中充入1mol CH3OCH3和1mol CO发生反应①,2min时达到平衡,该条件下平衡常数K =。
(3)、若压强为p kPa、温度为800K时向2L恒容密闭容器中充入1mol CH3OCH3和1mol CO发生反应①,2min时达到平衡,该条件下平衡常数K =。