浙江省绍兴市上虞区实初教育集团2023-2024学年九年级上册科学第一次阶段性检测试卷
试卷更新日期:2023-11-02 类型:月考试卷
一、选择题(本题共20小题,每小题3分,共60分)
-
1. 青山绿水就是金山银山,捡拾垃圾是有助于减少环境污染的一种简单方法。以下是小敏在江边检拾的垃圾,不属于有机物的是( )A、
 塑料瓶
B、
塑料瓶
B、 泡沫饭盒
C、
泡沫饭盒
C、 易拉罐
D、
易拉罐
D、 垃圾袋
2. 如果发现农田里的作物叶色发黄,并且茎杆软弱容易倒伏,应该施用下列化肥( )A、Ca3(PO4)2 B、KNO3 C、K2CO3 D、NH4H2PO43. 实验室有一瓶保管不当的试剂,其残缺的标签如图,这瓶试剂的溶质可能是( )
垃圾袋
2. 如果发现农田里的作物叶色发黄,并且茎杆软弱容易倒伏,应该施用下列化肥( )A、Ca3(PO4)2 B、KNO3 C、K2CO3 D、NH4H2PO43. 实验室有一瓶保管不当的试剂,其残缺的标签如图,这瓶试剂的溶质可能是( ) A、单质 B、氧化物 C、盐 D、碱4. 下列选项中物质的名称、俗名、化学式完全一致的是()A、氯化钠、食盐、NaCl B、氢氧化钙、熟石灰、CaOH C、氢氧化钠、纯碱、NaOH D、碳酸氢钠、苏打、5. 下列反应中,属于复分解反应的是( )A、H2O+CO2=H2CO3 B、CO2+2NaOH=Na2CO3+H2O C、CuO+2HCl=CuCl2+H2O D、Fe+CuSO4=FeSO4+Cu6. 食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能做成的实验是( )
A、单质 B、氧化物 C、盐 D、碱4. 下列选项中物质的名称、俗名、化学式完全一致的是()A、氯化钠、食盐、NaCl B、氢氧化钙、熟石灰、CaOH C、氢氧化钠、纯碱、NaOH D、碳酸氢钠、苏打、5. 下列反应中,属于复分解反应的是( )A、H2O+CO2=H2CO3 B、CO2+2NaOH=Na2CO3+H2O C、CuO+2HCl=CuCl2+H2O D、Fe+CuSO4=FeSO4+Cu6. 食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能做成的实验是( )①检验自来水中是否含有氯离子②鉴别食盐和纯碱
③检验鸡蛋壳能否溶于酸④除去热水瓶中的水垢
A、①②③④ B、①③ C、②④ D、②③④7. 下列物质敞口放置在空气中,溶质发生变质且溶液质量增加的是( )A、石灰水 B、氢氧化钠溶液 C、浓盐酸 D、浓硫酸8. 下列试剂中,能把NaOH溶液、稀硫酸、BaCl2溶液一次鉴别出来的是( )
A、KCl溶液 B、K2CO3溶液 C、NaNO3溶液 D、稀盐酸9. 下列各组离子在pH=1的溶液中都能大量共存,且溶液呈无色的是( )A、Ba2+、K+、NO3-、Cl- B、Fe3+、Ca2+、NO3-、Cl- C、Na+、K+、CO32-、SO42- D、Cu2+、Mg2+、NO3-、SO42-10. 据图示判断X、Y、Z三种金属与氢的活动性由强到弱的顺序是( )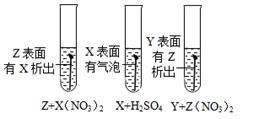 A、X>H>Y>Z B、Y>Z>X>H C、Z>Y>X>H D、X>H>Z>Y11. 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。加入稀硫酸的质量与有关量的变化关系图像正确的是( )A、
A、X>H>Y>Z B、Y>Z>X>H C、Z>Y>X>H D、X>H>Z>Y11. 取一定质量的锌粒和铜片于同一敞口容器中,再逐渐加入稀硫酸。加入稀硫酸的质量与有关量的变化关系图像正确的是( )A、 B、
B、 C、
C、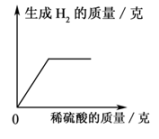 D、
D、 12. 现有a.MgSO4;b.NaOH;c.CuSO4;d.NaCl四种溶液,不用外加试剂,用最简便的方法鉴别,正确顺序是( )A、abed B、bcda C、cbad D、cadb13. 通过观察和实验等方法,人们找到物质变化的证据。下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是( )A、
12. 现有a.MgSO4;b.NaOH;c.CuSO4;d.NaCl四种溶液,不用外加试剂,用最简便的方法鉴别,正确顺序是( )A、abed B、bcda C、cbad D、cadb13. 通过观察和实验等方法,人们找到物质变化的证据。下列四组研究化学反应快慢的对比实验中,各组所用溶液浓度相同且适宜、所用固体表面积相同,其中现象最不明显的一组是( )A、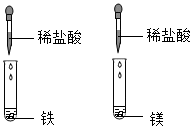 B、
B、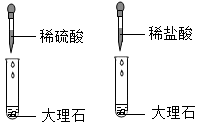 C、
C、 D、
D、 14. 在氢氧化钠溶液中加入一定量的稀硫酸后,下列实验能证明两者恰好完全中和的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、滴入适量BaCl2溶液和稀硝酸,观察到有白色沉淀 D、测得反应后溶液中Na+与SO2-个数比为2:115. 除去下列物质中混有的少量杂质,下列方案不可行的是( )
14. 在氢氧化钠溶液中加入一定量的稀硫酸后,下列实验能证明两者恰好完全中和的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、滴入适量BaCl2溶液和稀硝酸,观察到有白色沉淀 D、测得反应后溶液中Na+与SO2-个数比为2:115. 除去下列物质中混有的少量杂质,下列方案不可行的是( )选项
物质
杂质
方案
A
Cu粉
Zn粉
加入足量CuCl2溶液后过滤、洗涤、干燥
B
CO气体
CO2气体
通过足量的氢氧化钠溶液后干燥
C
NaCl固体
Na2CO3固体
加入足量的稀硫酸后蒸发
D
BaCO3固体
BaCl2固体
加水溶解后过滤
A、A B、B C、C D、D16. 为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液。下列操作顺序中最合适的是( )A、①④②⑤③ B、④①②⑤③ C、②⑤④①③ D、⑤②④③①17. 向一定质量的FeSO4和CuSO4的混合溶液中加入一定质量锌粉,充分反应后过滤,得滤液M和滤渣N。向滤渣N中加入稀盐酸,有气泡产生根据实验现象分析判断下列说法,不正确的是( )A、滤液M中一定存在Zn2+ , 可能含有Fe2+ B、滤液M的颜色呈蓝色 C、滤渣N中一定含有Fe和Cu D、滤渣N的质量小于加入锌粉的质量18. 为研究碱的化学性质,小明进行了如下实验,其中实验现象描述错误的是( )A、 溶液呈红色
B、
溶液呈红色
B、 有白色沉淀生成
C、
有白色沉淀生成
C、 无明显变化
D、
无明显变化
D、 有蓝色沉淀生成
19. 二氧化硫是有刺激性的有毒的气体,其水溶液叫亚硫酸(H2SO3),硫化氢(H2S)是一种具有剧毒的臭鸡蛋气味的气体,其水溶液叫氢硫酸(H2S).又知相同条件下H2S的酸性小于H2SO3 , 现在室温下向饱和H2SO3溶液通入过量H2S气体,反应方程式为:2H2S+H2SO3═3S↓+3H2O,则溶液的pH随通入H2S体积的变化曲线正确的是( )A、
有蓝色沉淀生成
19. 二氧化硫是有刺激性的有毒的气体,其水溶液叫亚硫酸(H2SO3),硫化氢(H2S)是一种具有剧毒的臭鸡蛋气味的气体,其水溶液叫氢硫酸(H2S).又知相同条件下H2S的酸性小于H2SO3 , 现在室温下向饱和H2SO3溶液通入过量H2S气体,反应方程式为:2H2S+H2SO3═3S↓+3H2O,则溶液的pH随通入H2S体积的变化曲线正确的是( )A、 B、
B、 C、
C、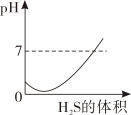 D、
D、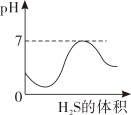 20. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )
20. 某锥形瓶内盛有盐酸和氯化铜的混合溶液100g,向其中加入溶质质量分数为10%的氢氧化钠溶液,锥形瓶内溶液质量m1与加入的氢氧化钠溶液质量m2的变化关系如图所示。下列说法错误的是( )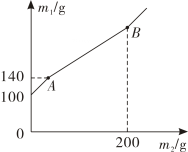 A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g
A、反应至A点时,所加NaOH溶液的质量为40g B、反应至A点时,溶液中的溶质有CuCl2和NaCl C、反应至B点时,锥形瓶内溶液的质量为280.4g D、反应至B点时,锥形瓶内溶液中NaCl的质量为23.4g二、填空题(本题共6小题,每空2分,共32分)
-
21. 石油是经济发展、国防建设的重要资源。从石油炼制的产品中可以获得一系列与甲烷结构相似的化合物,如乙烷[C2H6]、丁烷[C4H10]等。(1)、甲烷是①一种无色无味的气体 , ②难溶于水 , ③在1500℃以上的高温下能分解为碳和氢气 , ④充分燃烧后生成二氧化碳和水。属于甲烷物理性质的是(选填序号)。(2)、请参照甲烷在氧气中充分燃烧的情况,写出丁烷在氧气中充分燃烧的化学方程式:。22. 归纳总结是学习化学的重要方法,小莉同学总结了盐酸与其他物质反应的五条化学性质(如图所示)。
 (1)、利用如图盐酸性质(填序号)可除去铁表面的铁锈,该反应的化学方程式为。(2)、图中⑤所表示的物质类别是。(3)、下列物质可以利用盐酸的性质③制得的是( )A、CuCl2 B、AgCl C、FeCl3 D、ZnCl223. 有一包固体粉末,可能由BaCl2、FeCl3、KCl、CaCO3、Na2SO4等物质中的一种或几种组成。为证实其组成,做了以下实验:
(1)、利用如图盐酸性质(填序号)可除去铁表面的铁锈,该反应的化学方程式为。(2)、图中⑤所表示的物质类别是。(3)、下列物质可以利用盐酸的性质③制得的是( )A、CuCl2 B、AgCl C、FeCl3 D、ZnCl223. 有一包固体粉末,可能由BaCl2、FeCl3、KCl、CaCO3、Na2SO4等物质中的一种或几种组成。为证实其组成,做了以下实验: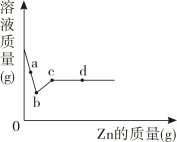
⑴将这包固体粉末加入水中,充分搅拌,过滤,得白色沉淀,上层清液为无色。
⑵向(1)所得的白色沉淀加入盐酸,沉淀部分溶解,放出的无色气体能使澄清石灰水变浑浊。根据上述实验判断,该粉末中一定含有 , 一定不含有 , 可能含有。
24. 向一定质量AgNO3和Cu(NO3)2的混合溶液中加入Zn,溶液质量与加入Zn的质量关系如图所示,根据图回答下列问题:
a点溶液中的溶质有。取d点的固体,加入稀盐酸,可观察到的实验现象是。
25. 氢氧化钠是一种重要的化工产品。(1)、使用氢氧化钠时要特别小心,因为它具有强烈的性。(2)、氢氧化钠溶液常用来洗涤石油产品中的残余硫酸,其化学方程式为。(3)、实验室有一瓶瓶盖已损坏的氢氧化钠固体,为了检验它的成分,某学习小组取少量该固体样品进行以下实验.已知:CaCl2溶液呈中性。
根据实验现象判断,固体样品中含有的物质是。
26. 我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其主要化学原理:等。回答下列问题:
①X的化学式为。
②将碳酸钠和碳酸氢钠的混合物10g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为。
三、探究题(本题共5小题,27每空1分,其余每空2分,共33分)
-
27. 思维模型是依据事物发展内在规律建立的解决问题的基本框架,能引导有序思维、增进深度理解,促进问题解决。小科建构了“物质除杂”的思维模型(如图)。
 (1)、铜粉中混有少量铁粉,用磁铁吸引除去,该方法属于上述模型中的(填“分离转移”或”反应转化”);(2)、根据“性质差异”,铜粉中混有少量氧化铜用足量稀盐酸除去,原因是能与稀盐酸反应;(3)、上述模型中“不增不减”是除杂原则,“不增”是指不增加新杂质,“不减”是指不减少目标物质质量。除去氯化钠中的杂质氯化钡,小科采用反应转化的方法,原理是BaCl2+K2SO4=BaSO4↓+2KCl。从反应的生成物有KCl可知,这种方法是不正确的,原因是不符合除杂中的原则(填“不增”或“不减”)。28. 小明为了探究过氧化钠(Na202)和CO2的反应相关特点,设计了如图实验装置,同时也查阅了相关资料:
(1)、铜粉中混有少量铁粉,用磁铁吸引除去,该方法属于上述模型中的(填“分离转移”或”反应转化”);(2)、根据“性质差异”,铜粉中混有少量氧化铜用足量稀盐酸除去,原因是能与稀盐酸反应;(3)、上述模型中“不增不减”是除杂原则,“不增”是指不增加新杂质,“不减”是指不减少目标物质质量。除去氯化钠中的杂质氯化钡,小科采用反应转化的方法,原理是BaCl2+K2SO4=BaSO4↓+2KCl。从反应的生成物有KCl可知,这种方法是不正确的,原因是不符合除杂中的原则(填“不增”或“不减”)。28. 小明为了探究过氧化钠(Na202)和CO2的反应相关特点,设计了如图实验装置,同时也查阅了相关资料:资料一:过氧化钠与二氧化碳和水都能发生反应,且都放出热量。化学方程式分别为:2Na2O2+2CO2=2Na2CO3+O2↑ 2Na2O2+2H2O=4NaOH+O2↑
资料二:氢氧化钙的溶解度随着温度的升高而降低。
 (1)、在实验过程中注射器的作用相当于____。A、长颈漏斗 B、分液漏斗(2)、此实验中水蒸汽被装置B完全吸收的证据是:。(3)、解释D装置中澄清石灰水变浑浊的原因:。29. 小敏为探究铁制品锈蚀的条件,并进行如下实验:
(1)、在实验过程中注射器的作用相当于____。A、长颈漏斗 B、分液漏斗(2)、此实验中水蒸汽被装置B完全吸收的证据是:。(3)、解释D装置中澄清石灰水变浑浊的原因:。29. 小敏为探究铁制品锈蚀的条件,并进行如下实验:

步骤1:利用图甲所示装置,将干燥的氧气从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满氧气后,在导管b处连接一活塞推至底部的注射器,收集20mL氧气后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形管内的铁丝,其现象如下表所示:
观察对象
①干燥的普通铁丝
②潮湿的普通铁丝
③潮湿的纯铁丝
现象
没有明显变化
较多红褐色锈斑
没有明显变化
(1)、铁制品锈蚀的条件之一是需要氧气,此实验中能支持此条件的现象。(2)、通过对比的实验现象,可以得出铁制品锈蚀与水有关;通过对比②③的实验现象还可得出铁制品锈蚀与金属的有关。(3)、小敏还发现切过咸菜的铁质菜刀更容易生锈,他猜测可能是咸菜中的盐水加快了铁的锈蚀,于是他又设计了如图丙所示的实验。一段时间后,若观察到(填实验现象),则可证明他的猜测是正确的。30. 在研究酸和碱的化学性质时,某化学兴趣小组同学想证明稀盐酸与氢氧化钠溶液混合后,虽然无明显现象,但确实发生了化学反应,试与他们一起完成实验方案的设计,实施和评价,并得出有关结论。(1)、探究稀盐酸与氢氧化钠溶液的反应:如图。
当滴入几滴酚酞试液后,溶液由无色变为 , 根据上述实验中颜色变化,可确定稀盐酸与氢氧化钠溶液发生了化学变化。
(2)、探究上述稀盐酸与氢氧化钠溶液反应后烧杯中的盐酸是否过量:根据上述反应过程中溶液变成无色,不能确定稀盐酸是否过量,同学们又分别选取硝酸银溶液、碳酸钠溶液设计实验方案,请你判断并分析:实验方案
实验步骤
实验现象
实验结论
方案一
取样,滴入适量的硝酸银溶液
出现白色沉淀
稀盐酸过量
方案二
取样,滴入适量的碳酸钠溶液
稀盐酸过量
①请对实验方案一的结论进行评价。
②表格空白处的实验现象是:。
(3)、为确定稀盐酸是否过量,还可以选择的试剂有____。A、紫色石蕊试液 B、铜片 C、铁锈31. 化学兴趣小组在完成实验室制取二氧化碳的实验后,欲对剩余废液的组成进行探究,并制定回收CaCl2的方案。用图1装置进行实验,将80mL一定质量分数的碳酸钠溶液逐滴加入到废液中,测得数据如图2。(1)、该废液中的溶质的组成为。 (2)、b点发生反应的化学方程式为:。(3)、c点对应溶液中溶质的化学式为:。(4)、甲组同学提出直接蒸发溶剂可从剩余废液中回收纯净CaCl2 , 乙组同学认为此方法会对空气造成污染。在不借助其它试剂和仪器的情况下,除去废液中对空气造成污染的物质,建议最好先在废液中加入下面(填选项序号)试剂____。A、CaO B、Ca(OH)2 C、CaCO3
(2)、b点发生反应的化学方程式为:。(3)、c点对应溶液中溶质的化学式为:。(4)、甲组同学提出直接蒸发溶剂可从剩余废液中回收纯净CaCl2 , 乙组同学认为此方法会对空气造成污染。在不借助其它试剂和仪器的情况下,除去废液中对空气造成污染的物质,建议最好先在废液中加入下面(填选项序号)试剂____。A、CaO B、Ca(OH)2 C、CaCO3四、解答题(本题有5小题,32题4分,33题、34题8分,35题6分,36题9分,共35分)
-
32. 在相同条件下,取质量相等的块状CaCO3和粉末状Na2CO3 , 分别与足量等质量分数的稀盐酸充分反应。根据实验测定:其中粉末状Na2CO3与稀盐酸反应产生CO2的质量随反应时间变化曲线如图所示。请在图中画出块状CaCO3与稀盐酸反应产生CO2的质量随反应时间变化大致曲线,并用科学原理加以解释。
 33. 小科在某次家庭劳动实践时发现,厕所污垢通常用洁厕灵进行清洗,他对家里某品牌洁厕灵的有效成分及其含量进行实验研究。
33. 小科在某次家庭劳动实践时发现,厕所污垢通常用洁厕灵进行清洗,他对家里某品牌洁厕灵的有效成分及其含量进行实验研究。查阅资料可知洁厕灵的有效成分是HCl,HCl的含量可利用NaHCO3溶液来测定,反应的化学方程式为HCl+NaHCO3═NaCl+H2O+CO2↑。洁厕灵其他成分均不参加反应。
向一锥形瓶中加入100克该品牌洁厕灵,再逐次加入一定质量分数的NaHCO3溶液,测出每次锥形瓶中充分反应后溶液的总质量,数据记录如表:
第一次
第二次
第三次
加入NaHCO3溶液的质量/克
100
100
100
反应后溶液的总质量/克
197.8
295.6
395.6
(1)、该洁厕灵呈(填“酸性”或“碱性”)。(2)、第一次实验产生的气体质量为克。求该品牌洁厕灵中HCl的质量分数。(3)、下列关于家庭小实验活动的说法中,你认为合理的有____。A、开展家庭小实验活动时,需要规范操作 B、明白实验原理和安全事项后,有安全保障才开展实验 C、只要网上能买到的,可随意购买药品或器材进行各类实验34. Cu与Zn的合金称为黄铜,有优良的导热性和耐腐蚀性,可用作各种仪器零件。某化学兴趣小组的同学为了测定某黄铜的组成,取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入相同溶质质量分数的稀硫酸,充分反应后用天平称量,几次实验数据如下:实验次数
第1次
第2次
第3次
第4次
所取样品的质量/g
50.0
50.0
50.0
50.0
加入稀硫酸的质量/g
20.0
40.0
60.0
80.0
生成气体的质量/g
0.2
0.4
0.5
0.5
试回答下列问题:
(1)、经分析,第1次实验结束后,反应物完全反应完了。(2)、50.0g样品与足量稀硫酸反应最多能生成气体g。(3)、黄铜样品中锌的质量分数为。(4)、计算所用稀硫酸的溶质质量分数。35. 兴趣小组欲测定某未知浓度Ba(OH)2溶液的溶质质量分数,请你一起完成实验并回答有关问题:(1)、配制30g10%的Na2CO3溶液。步骤为:计算、称取、量取、溶解、转移。量取水时应选用规格为ml(填“10”、“50”或“100”)的量筒。最后将碳酸钠溶液转移到试剂瓶中,贴上标签备用,在标签上可以不必注明的是(填字母编号)。
A. 30g B. 10% C.Na2CO3溶液(2)、测定未知浓度Ba(OH)2溶液的溶质质量分数。取50gBa(OH)2溶液,在逐滴滴加上述Na2CO3溶液的过程中,测得产生沉淀与加入Na2CO3溶液的质量关系如图所示。

①恰好完全反应时,消耗Na2CO3的溶质质量为g。
②请通过计算确定Ba(OH)2溶液的溶质质量分数。
36. 现有Na2CO3和NaCl的混合物样品22.3g,将其放入干净的烧杯中,加一定量的水使其完全溶解。向所得的溶液中逐滴加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与滴入稀盐酸的质量关系曲线如图所示。试回答下列问题: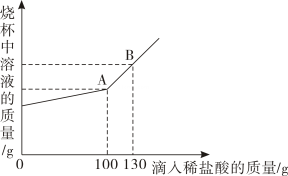 (1)、当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为(填写化学式)。(2)、在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为g。(3)、实验结束后,生成的气体质量为g。(4)、当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质质量。
(1)、当滴入上述稀盐酸至图中B点时,烧杯中溶液里的溶质为(填写化学式)。(2)、在Na2CO3和NaCl的混合物样品中,含Na2CO3的质量为g。(3)、实验结束后,生成的气体质量为g。(4)、当滴入上述稀盐酸至图中A点时,试通过计算,求此温度时所得不饱和溶液中溶质质量。