“高效课堂”2.5 物质的转化(提升版)--2023-2024学年浙教版科学九年级上册
试卷更新日期:2023-11-01 类型:同步测试
一、选择题
-
1. 如图所示为小嘉构建的甲、乙、丙、丁四种不同物质的关系图,”-”表示相邻的两种物质能发生反应。若甲为铁,乙、丙、丁分别是稀H2SO4、CuCl2溶液、NaOH溶液中的任意一种,则下列判断错误的是( )
 A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO42. 为了探究实验室中久置的生石灰样品变质情况,同学们进行如图所示的实验.下列分析和结论不正确的是( )
A、乙可能是CuCl2溶液 B、丙一定是NaOH溶液 C、丁一定是稀H2SO4 D、丙不可能是稀H2SO42. 为了探究实验室中久置的生石灰样品变质情况,同学们进行如图所示的实验.下列分析和结论不正确的是( )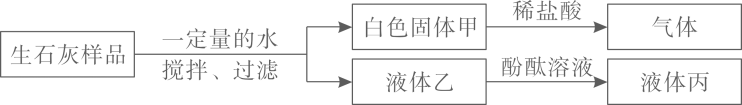 A、该样品已完全变质 B、液体丙呈红色或无色 C、该样品中一定含有碳酸钙 D、白色固体甲可能为Ca(OH)2和CaCO3的混合物3. 向一定质量的Na2CO3溶液中滴加一定质量的Ba(OH)2溶液,反应一段时间后改为滴加Ca(OH)2溶液,当恰好不再产生沉淀时,再滴加稀盐酸至沉淀消失。反应过程中产生沉淀的质量与加入物质的质量关系如图所示。下列说法错误的是( )
A、该样品已完全变质 B、液体丙呈红色或无色 C、该样品中一定含有碳酸钙 D、白色固体甲可能为Ca(OH)2和CaCO3的混合物3. 向一定质量的Na2CO3溶液中滴加一定质量的Ba(OH)2溶液,反应一段时间后改为滴加Ca(OH)2溶液,当恰好不再产生沉淀时,再滴加稀盐酸至沉淀消失。反应过程中产生沉淀的质量与加入物质的质量关系如图所示。下列说法错误的是( ) A、a点溶液中溶质只有NaOH B、c﹣d段发生反应的化学方程式为NaOH+HCl═NaCl+H2O C、整个过程溶液中的溶质种类最多含有3种 D、d﹣e段有气泡产生4. 有一包固体样品,可能含氯化铁、硫酸钠、氢氧化钡、氢氧化钠中的一种或几种。小宁进行了如下实验.根据实验现象,下列判断错误的是( )
A、a点溶液中溶质只有NaOH B、c﹣d段发生反应的化学方程式为NaOH+HCl═NaCl+H2O C、整个过程溶液中的溶质种类最多含有3种 D、d﹣e段有气泡产生4. 有一包固体样品,可能含氯化铁、硫酸钠、氢氧化钡、氢氧化钠中的一种或几种。小宁进行了如下实验.根据实验现象,下列判断错误的是( )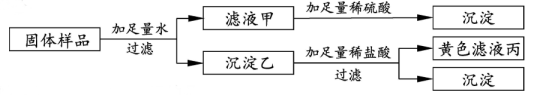 A、滤液丙中含有氯化铁 B、沉淀乙为氢氧化铁、硫酸钡 C、滤液甲中一定不存在氢氧化钠 D、样品中一定有氯化铁、硫酸钠、氢氧化钡5. 某物质充分燃烧的产物是CO2和H2O,为了确定该物质的组成,某小组设计了如图3-12-7所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。称取0.84g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g。则下列推断正确的是( )
A、滤液丙中含有氯化铁 B、沉淀乙为氢氧化铁、硫酸钡 C、滤液甲中一定不存在氢氧化钠 D、样品中一定有氯化铁、硫酸钠、氢氧化钡5. 某物质充分燃烧的产物是CO2和H2O,为了确定该物质的组成,某小组设计了如图3-12-7所示实验(其中浓硫酸、无水CaCl2均为常用干燥剂,部分固定装置省略)。称取0.84g待测物完全燃烧后,称得D装置增重1.08g,E装置增重2.64g。则下列推断正确的是( ) A、该物质一定含有C,H元素,没有氧元素 B、该物质一定含有C,H,O元素 C、用空气球代替装置A,B更有利于实验的进行 D、B装置的有无对实验结果没有影响6. 如图为CO还原CuO“微型”实验装置(夹持仪器等略),已知:HCOOH H2O+CO↑,下列说法错误的是( )
A、该物质一定含有C,H元素,没有氧元素 B、该物质一定含有C,H,O元素 C、用空气球代替装置A,B更有利于实验的进行 D、B装置的有无对实验结果没有影响6. 如图为CO还原CuO“微型”实验装置(夹持仪器等略),已知:HCOOH H2O+CO↑,下列说法错误的是( ) A、实验中所需CO可现制现用 B、“微型”装置可节约用品,污染小,现象明显 C、“微型”装置内空间较小,空气易排空,危险系数小 D、该实验中所涉及反应的基本类型有分解反应和置换反应7. 总结归纳是学习科学的一种重要方法。如图,小宁归纳了初中物质之间的部分转化关系。下列说法中正确的是()
A、实验中所需CO可现制现用 B、“微型”装置可节约用品,污染小,现象明显 C、“微型”装置内空间较小,空气易排空,危险系数小 D、该实验中所涉及反应的基本类型有分解反应和置换反应7. 总结归纳是学习科学的一种重要方法。如图,小宁归纳了初中物质之间的部分转化关系。下列说法中正确的是() A、符合转化规律②的一个化学反应可以表示为:CuO+ H2O=Cu(OH)2 B、根据转化规律⑦和⑧,部分金属能够转化成盐,但盐都能转化成金属 C、根据转化规律④,实验室可用熟石灰和纯碱反应制取苛性钠 D、在湿法炼铜中,将铁放入硫酸铜溶液中把铜置换出来是应用转化规律⑥8. 某化学小组进行金属与酸的反应后,想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计了如图所示方案。针对该方案过程,分析正确的是( )
A、符合转化规律②的一个化学反应可以表示为:CuO+ H2O=Cu(OH)2 B、根据转化规律⑦和⑧,部分金属能够转化成盐,但盐都能转化成金属 C、根据转化规律④,实验室可用熟石灰和纯碱反应制取苛性钠 D、在湿法炼铜中,将铁放入硫酸铜溶液中把铜置换出来是应用转化规律⑥8. 某化学小组进行金属与酸的反应后,想从含有Al2(SO4)3、CuSO4的废液中回收金属铜,设计了如图所示方案。针对该方案过程,分析正确的是( ) A、操作a,操作b均为过滤 B、滤液B中可能含有Al3+ C、过程Ⅱ的现象是溶液由无色变为蓝色 D、最终回收到的铜质量大于固体A中的铜9. 取少量铁粉和硫粉混合均匀后加热。小科对产物进行如下实验(FeS+H2SO4=H2S↑+FeSO4 , H2S气体能被氢氧化钠溶液吸收,Fe3+遇硫氰化钾KSCN溶液显红色,Fe2+遇KSCN溶液不显红色)。若溶液E不显红色,则下列说法错误的是( )
A、操作a,操作b均为过滤 B、滤液B中可能含有Al3+ C、过程Ⅱ的现象是溶液由无色变为蓝色 D、最终回收到的铜质量大于固体A中的铜9. 取少量铁粉和硫粉混合均匀后加热。小科对产物进行如下实验(FeS+H2SO4=H2S↑+FeSO4 , H2S气体能被氢氧化钠溶液吸收,Fe3+遇硫氰化钾KSCN溶液显红色,Fe2+遇KSCN溶液不显红色)。若溶液E不显红色,则下列说法错误的是( ) A、刺激性气体A为SO2 B、黑色固体B为FeS C、溶液F中的溶质为Na2S、NaOH D、气体G为H210. 如图是自然界中碳、氧循环简图(X为H2CO3 , Y为C6H12O6)。下列说法不正确的是( )
A、刺激性气体A为SO2 B、黑色固体B为FeS C、溶液F中的溶质为Na2S、NaOH D、气体G为H210. 如图是自然界中碳、氧循环简图(X为H2CO3 , Y为C6H12O6)。下列说法不正确的是( ) A、图一中的转化1是酸雨形成的主要原因 B、图二中可实现有机物与无机物的相互转化 C、绿色植物通过光合作用,将太阳能转化成化学能 D、碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
A、图一中的转化1是酸雨形成的主要原因 B、图二中可实现有机物与无机物的相互转化 C、绿色植物通过光合作用,将太阳能转化成化学能 D、碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定二、填空题
-
11. 有一白色粉末A,由Na2SO4、Na2CO3、BaCl2、NaCI中的三种物质混合而成。把A加入到适量水中后,可得到白色沉淀B和溶液C,则:(1)、若B能全部溶于稀硝酸时,A的成分为;(2)、若B只能部分溶于稀硝酸时,A的成分为;(3)、若B不能溶于稀硝酸时,A的成分为;(4)、溶液C中一定存在的溶质是。12. 下列框图中的物质均为初中化学常见的物质,其中A是建筑材料的主要成分,B属于氧化物,右上图是它们之间的相互转化关系。请回答下列问题。
 (1)、写出C物质的化学式。(2)、得到F溶液的操作I的名称为。(3)、若I是红褐色沉淀,请写出G+F→I的化学方程式。13. 《天工开物》记载的“生铁、熟铁连续生成工艺”,处于当时世界领先地位,是现代冶金工艺的雏形。其流程图如下所示:
(1)、写出C物质的化学式。(2)、得到F溶液的操作I的名称为。(3)、若I是红褐色沉淀,请写出G+F→I的化学方程式。13. 《天工开物》记载的“生铁、熟铁连续生成工艺”,处于当时世界领先地位,是现代冶金工艺的雏形。其流程图如下所示: (1)、熔炼过程中,氧化铁与一氧化碳在高温下反应的化学方程式为。(2)、通过搅拌向生铁中“充氧”可降低生铁的含碳量,此过程体现了氧气的(选填“氧化性”或“还原性”)。“黑色湿泥”(有效成分为磷酸铁FePO4)作为熔剂可加快反应,磷酸铁属于类物质(选填“酸”“碱”或“盐”)。14. 从盐湖中提取的某种矿物主要含有KCl,还有少量MgSO4、CaCl2及不溶性杂质SiO2.从该矿物中提取KCl的流程如图:回答下列问题:
(1)、熔炼过程中,氧化铁与一氧化碳在高温下反应的化学方程式为。(2)、通过搅拌向生铁中“充氧”可降低生铁的含碳量,此过程体现了氧气的(选填“氧化性”或“还原性”)。“黑色湿泥”(有效成分为磷酸铁FePO4)作为熔剂可加快反应,磷酸铁属于类物质(选填“酸”“碱”或“盐”)。14. 从盐湖中提取的某种矿物主要含有KCl,还有少量MgSO4、CaCl2及不溶性杂质SiO2.从该矿物中提取KCl的流程如图:回答下列问题: (1)、滤渣Ⅰ的主要成分是。(2)、Y溶液中溶质的化学式为。(3)、向滤液Ⅱ中加入过量盐酸的目的是。15. 下列两种方案体现了物质除杂的不同思路:思路一:将杂质直接转化为所需物质;
(1)、滤渣Ⅰ的主要成分是。(2)、Y溶液中溶质的化学式为。(3)、向滤液Ⅱ中加入过量盐酸的目的是。15. 下列两种方案体现了物质除杂的不同思路:思路一:将杂质直接转化为所需物质;思路二:将所需物质转化为中间物质,再将中间物质转化为所需物质。
 (1)、运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。(2)、运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。根据流程回答以下问题。步骤②中加入的甲溶液是(填化学式)溶液。
(1)、运用思路一:除去氯化镁粉末中混有的少量氯化钡,先加足量的水溶解,再向溶液中加入适量的溶液,过滤、蒸发,即得氯化镁固体。(2)、运用思路二:除去氯化镁粉末中混有的少量氯化钡、氯化钠和硫酸钾。根据流程回答以下问题。步骤②中加入的甲溶液是(填化学式)溶液。三、实验探究题
-
16. 碳酸钠是玻璃、造纸、肥皂、洗涤剂、纺织、制革等工业的重要原料。我国化学家侯德榜对制碱工业有重大贡献,他发明的制碱方法,被誉为“侯氏制碱法”,其生产工艺流程示意图如下:整个过程中涉及的主要反应有:

①NH3+H2O+CO2=NH4HCO3
②NH4HCO3+NaCl=NH4Cl +NaHCO3(晶体)
③2NaHCO3Na2CO3+H2O+CO2↑
请问答下列问题:
(1)、碳酸钠属于(填“酸"、“碱”或盐”)。(2)、X遇碱溶液会生成刺激性气味的气体,此气体可使紫色石蕊试液变色。若要通过实验区分X和另一种氮肥硝酸铵,常用的试剂是溶液。(3)、X是滤液中最主要的成分,X与Ca(OH)2反应的产物之一可用于该生产工艺流程的循环使用,该产物的名称为。17. 探究盐酸的化学性质,某化学小组做了如下实验:
将反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到烧杯中先有气泡产生,后有白色沉淀出现。将烧杯中的混合物过滤,得到白色沉淀和无色滤液。同学们对滤液中溶质成分进行探究:(提出问题)滤液中溶质的成分是什么?(作出猜想)
猜想一:NaCl
猜想二:NaCl和CaCl2
猜想三:
猜想四:NaCl、Ca(OH)2和HCl
同学们马上否定了猜想四,请问他们否定的理由是什么?
(设计实验)请完成实验报告。
实验步骤
实验现象
实验结论
取少量滤液于试管中,滴加适量的碳酸钠溶液。
①
猜想二不成立
取少量滤液于试管中,滴加②_(填名称)。
产生气泡
猜想三成立
18. 如图所示是木炭还原氧化铜的实验,小科对碳与氧化铜反应生成的气体成分进行探究。[提出问题]碳燃烧时可能生成CO2 , 也可能生成CO,那么碳与氧化铜反应生成的气体是否也有多种可能?
[作出猜想]
猜想①:CO;猜想②:CO2;
猜想③:CO和CO2。
[设计方案]打开K,缓缓通入干燥的氮气一段时间,关闭K,点燃酒精喷灯和酒精灯,充分反应后,熄灭酒精喷灯和酒精灯,打开K,再通一段时间氮气。
方案一:从定性观察角度判断
(1)、若观察到B中澄清石灰水变浑浊,则可排除猜想。(2)、实验结束后,需要先熄灭(选填“A”或“D”)酒精灯。(3)、方案二:从定量计算角度判断取一定量炭粉和4g氧化铜的混合物进行实验,并测定表格中的四个数据:反应前的质量
反应后的质量
A(玻璃管+固)
m1
m2
B+C+(广口瓶+混合液)
m3
m4
若猜想②成立,则理论上(m4-m3)(m1-m2)(填“>”“=”或“<”)。
(4)、若猜想③成立且CuO全部转化成Cu,则参加反应碳的质量m的取值范围是。四、解答题
-
19. A、B、C为常见的三种无机物,它们之间有如图所示的转化关系(“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去)。请回答:
 (1)、若C是气体,它能使澄清石灰水变浑浊,B、C所属的物质类别和组成元素都相同,则B转变成C与图示微观变化相符的反应是____(填序号);
(1)、若C是气体,它能使澄清石灰水变浑浊,B、C所属的物质类别和组成元素都相同,则B转变成C与图示微观变化相符的反应是____(填序号); A、CO+CuOCu+CO2 B、H2CO3H2O+CO2↑ C、2CO+O22CO2 D、CaCO3+2HCl=CaCl2+H2O+CO2↑(2)、A为光合作用的原料之一,A与B属于不同物质类别,B和C属于同种物质类别,A、B、C三种物质中都含有相同的两种元素,则C可能的物质类别是。20. 实验室可用如图装置模拟工业炼铁。
A、CO+CuOCu+CO2 B、H2CO3H2O+CO2↑ C、2CO+O22CO2 D、CaCO3+2HCl=CaCl2+H2O+CO2↑(2)、A为光合作用的原料之一,A与B属于不同物质类别,B和C属于同种物质类别,A、B、C三种物质中都含有相同的两种元素,则C可能的物质类别是。20. 实验室可用如图装置模拟工业炼铁。 (1)、实验前先通入CO的目的是 , 试管中出现的现象是。(2)、装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是。(3)、若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨? (计算结果 保留一位小数)
(1)、实验前先通入CO的目的是 , 试管中出现的现象是。(2)、装置图末端的导气管口放一盏燃着的酒精灯,这样做的目的是。(3)、若工厂用100吨含Fe2O3的质量分数为80 %的铁矿石炼铁,可提炼出含铁的质量分数为96 %的生铁多少吨? (计算结果 保留一位小数)