广东省揭阳市普宁市重点中学2023-2024学年高三上学期9月月考化学试题
试卷更新日期:2023-11-01 类型:月考试卷
一、选择题:本题共16小题,1-10每小题2分,11-16每题4分,每小题只有一个选项符合题目要求。
-
1. 古“丝绸之路”让古代中国商品名扬海外。下列“丝绸之路博物馆”展出的文物中,主要由硅酸盐材料制成的是( )
文物




选项
A.蚕桑丝绸
B.西汉古茶
C.陶瓷碎片
D.铜镜
A、A B、B C、C D、D2. 我国的深空探测、激光晶体、量子通信、深海探测等技术世界领先。下列说法正确的是( )A、空间站宇航员若用激光笔照射太空,可在太空中看到一条光亮的通路 B、普通玻璃是非晶体,可用X射线衍射实验区分激光晶体和普通玻璃 C、量子通信所用磁性材料的主要成分是Fe2O3 D、海水中重水(2H2O)总储量巨大,2H2O和1H2O互为同位素3. 下列化学用语或图示表达正确的是( )A、、、都是碱性氧化物 B、顺-2-丁烯的结构简式: C、中子数为10的氧原子:
D、基态Cu+的价层电子的轨道表示式:
C、中子数为10的氧原子:
D、基态Cu+的价层电子的轨道表示式: 4. 化学处处呈现美。下列说法正确的是( )A、杜甫诗中“迟日江山丽,春风花草香”,体现了分子是运动的 B、春节绚丽多彩的烟花,是电子由基态跃迁到激发态时,能量以光的形式释放出来 C、将铜片和锌片放入稀盐酸中,用导线连接铜片→氖灯→锌片,氖灯发出美丽的亮光,稀盐酸是电解质 D、氯化铵固体受热神奇消失,该过程是升华现象5. 我国科学家在实验室中首次实现用二氧化碳合成淀粉,成为当今世界的一项颠覆性技术。下列相关说法正确的是( )A、淀粉在人体内代谢后转化成果糖 B、这种合成淀粉和天然形成的淀粉化学性质不同 C、此项技术可能有助于我国在未来实现“碳中和” D、淀粉与纤维素均可用(C6H10O5)n来表示,二者互为同分异构体6. 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。自2023年8月1日起正式实施。下列说法不正确的是( )
4. 化学处处呈现美。下列说法正确的是( )A、杜甫诗中“迟日江山丽,春风花草香”,体现了分子是运动的 B、春节绚丽多彩的烟花,是电子由基态跃迁到激发态时,能量以光的形式释放出来 C、将铜片和锌片放入稀盐酸中,用导线连接铜片→氖灯→锌片,氖灯发出美丽的亮光,稀盐酸是电解质 D、氯化铵固体受热神奇消失,该过程是升华现象5. 我国科学家在实验室中首次实现用二氧化碳合成淀粉,成为当今世界的一项颠覆性技术。下列相关说法正确的是( )A、淀粉在人体内代谢后转化成果糖 B、这种合成淀粉和天然形成的淀粉化学性质不同 C、此项技术可能有助于我国在未来实现“碳中和” D、淀粉与纤维素均可用(C6H10O5)n来表示,二者互为同分异构体6. 为维护国家安全和利益,经国务院批准,决定对镓、锗相关物项实施出口管制。自2023年8月1日起正式实施。下列说法不正确的是( ) A、镓的核电荷数为31 B、锗元素的相对原子质量为72.63 C、镓、锗位于周期表p区 D、镓、锗是稀土元素7. 负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是( )
A、镓的核电荷数为31 B、锗元素的相对原子质量为72.63 C、镓、锗位于周期表p区 D、镓、锗是稀土元素7. 负载有和的活性炭,可选择性去除实现废酸的纯化,其工作原理如图。下列说法正确的是( )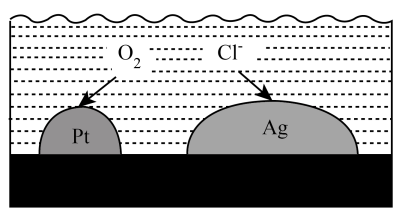 A、作原电池正极 B、电子由经活性炭流向 C、表面发生的电极反应: D、每消耗标准状况下的 , 最多去除8. 设NA为阿伏加德罗常数的值,硫酸工业涉及S→SO2→SO3→H2SO4的转化过程。下列说法正确的是( )A、标准状况下,含NA个硫原子的硫单质体积为22.4L B、将2 mol SO2和1molO2混合于密闭容器中,充分反应后,转移的电子数为4NA C、1 mol SO2和SO3混合气体通入过量NaOH溶液,所得溶液中SO32-和SO42-离子总数为NA D、1mol/L的H2SO4溶液中:c(H+)>2c(SO42-)9. 一种麻醉剂的分子结构式如图所示。其中,的原子核只有1个质子;元素、、原子序数依次增大,且均位于的下一周期;元素的原子比原子多8个电子。下列说法不正确的是( )
A、作原电池正极 B、电子由经活性炭流向 C、表面发生的电极反应: D、每消耗标准状况下的 , 最多去除8. 设NA为阿伏加德罗常数的值,硫酸工业涉及S→SO2→SO3→H2SO4的转化过程。下列说法正确的是( )A、标准状况下,含NA个硫原子的硫单质体积为22.4L B、将2 mol SO2和1molO2混合于密闭容器中,充分反应后,转移的电子数为4NA C、1 mol SO2和SO3混合气体通入过量NaOH溶液,所得溶液中SO32-和SO42-离子总数为NA D、1mol/L的H2SO4溶液中:c(H+)>2c(SO42-)9. 一种麻醉剂的分子结构式如图所示。其中,的原子核只有1个质子;元素、、原子序数依次增大,且均位于的下一周期;元素的原子比原子多8个电子。下列说法不正确的是( ) A、是一种强酸 B、电负性: C、原子半径: D、中,中心原子是SP3杂化10. 下列离子方程式不正确的是( )A、实验室盛放NaOH溶液的试剂瓶用磨砂玻璃塞,可能发生:SiO2+2OH-=SiO+H2O B、用铜和氯化铁溶液反应可以雕刻印刷电路板:Cu+2Fe3+=Cu2++2Fe2+ C、验证“84”消毒液与洁厕剂不能混合的原因:2H++Cl- +ClO-=Cl2↑+H2O D、氯化铝溶液与浓氨水混合:Al3++4NH3·H2O=+4+2H2O11. 下列陈述I和陈述Ⅱ均正确且具有因果关系的是( )
A、是一种强酸 B、电负性: C、原子半径: D、中,中心原子是SP3杂化10. 下列离子方程式不正确的是( )A、实验室盛放NaOH溶液的试剂瓶用磨砂玻璃塞,可能发生:SiO2+2OH-=SiO+H2O B、用铜和氯化铁溶液反应可以雕刻印刷电路板:Cu+2Fe3+=Cu2++2Fe2+ C、验证“84”消毒液与洁厕剂不能混合的原因:2H++Cl- +ClO-=Cl2↑+H2O D、氯化铝溶液与浓氨水混合:Al3++4NH3·H2O=+4+2H2O11. 下列陈述I和陈述Ⅱ均正确且具有因果关系的是( )选项
陈述
陈述
A
工业上电解熔融AlCl3冶炼铝
AlCl3熔点比Al2O3低
B
试管中盛有蓝色硫酸铜晶体,加入浓硫酸后晶体变白
浓硫酸有脱水性
C
常温下,Fe遇浓硝酸产生红棕色气体,遇稀硝酸产生无色气体
浓度越大,反应速率越快
D
除去乙炔中的H2S用CuSO4溶液,不用FeSO4溶液
CuS在水中的溶解度小于FeS
A、A B、B C、C D、D12. 用下列实验装置进行相应实验,能达到实验目的的是( ) A、用图1所示装置验证浓硫酸具有强氧化性 B、用图2所示装置制取并收集乙烯 C、用图3所示装置制取干燥的NH3 D、用图4所示装置制取Cl213. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是( )
A、用图1所示装置验证浓硫酸具有强氧化性 B、用图2所示装置制取并收集乙烯 C、用图3所示装置制取干燥的NH3 D、用图4所示装置制取Cl213. 中科院院士研究发现,纤维素可在低温下溶于NaOH溶液,恢复至室温后不稳定,加入尿素可得到室温下稳定的溶液,为纤维素绿色再生利用提供了新的解决方案。下列说法错误的是( ) A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低纤维素在NaOH溶液中的溶解性14. 硒能增强人体免疫功能,抗氧化,延缓衰老,有效抑制肿瘤生长。实验室模拟工业上由含硒废料(主要含、、、、、等)制取硒的流程如下:
A、纤维素是自然界分布广泛的一种多糖 B、纤维素难溶于水主要原因是其链间有多个氢键 C、NaOH提供破坏纤维素链之间的氢键 D、低温降低纤维素在NaOH溶液中的溶解性14. 硒能增强人体免疫功能,抗氧化,延缓衰老,有效抑制肿瘤生长。实验室模拟工业上由含硒废料(主要含、、、、、等)制取硒的流程如下:
下列有关说法正确的是( )
A、“分离”前,将废料粉碎可以提高活化分子百分数,加快分离速率 B、“分离”、“酸溶”、“浸取”时都需要用到的玻璃仪器有:烧杯、玻璃棒、分液漏斗 C、“酸化”过程中发生的离子反应为 D、若向“酸溶”所得的滤液中滴入少量KSCN溶液,无明显现象15. 近期科技工作者开发了一套CO和甘油(C3H8O3)的共电解装置,如下图所示。下列说法正确的是( )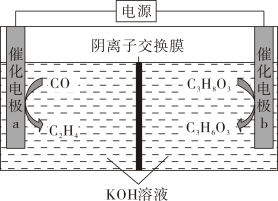 A、催化电极b连接电源的负极 B、电解过程中K+从阳极区移向阴极区 C、阴极区的电极反应为2CO+8e- +6H2O=C2H4+ 8OH- D、电解前后溶液的pH不变16. 已知。室温下,向一元弱酸溶液中逐滴滴加溶液,溶液的随的变化关系如图所示。下列说法正确的是( )
A、催化电极b连接电源的负极 B、电解过程中K+从阳极区移向阴极区 C、阴极区的电极反应为2CO+8e- +6H2O=C2H4+ 8OH- D、电解前后溶液的pH不变16. 已知。室温下,向一元弱酸溶液中逐滴滴加溶液,溶液的随的变化关系如图所示。下列说法正确的是( ) A、当时,溶液中 B、当时,加入的溶液体积大于 C、当加入溶液时,溶液中 D、、、三点对应溶液中水电离出来的浓度:点点点
A、当时,溶液中 B、当时,加入的溶液体积大于 C、当加入溶液时,溶液中 D、、、三点对应溶液中水电离出来的浓度:点点点二、非选择题:本题共4个小题,共56分。
-
17. 磺酰氯( SO2Cl2 )可用于制造锂电池正极活性物质。实验室可利用SO2和Cl2在活性炭催化下反应制取少量SO2Cl2 , 装置如图(部分夹持装置已省略)。

已知:①SO2(g) +Cl2(g)=SO2Cl2(1) △H = -97.3 kJ/mol;
②SO2Cl2熔点为-54.1℃ ,沸点为69.1℃,常温较稳定,遇水剧烈水解,100℃以上易分解。
回答下列问题:
(1)、仪器A的名称是 , 装置丙中橡胶管的作用是。(2)、装置丙中发生反应的离子方程式为 ,上述仪器的正确连接顺序是e →g,h←←f(填仪器接口字母编号,仪器可重复使用)。
(3)、仪器F的作用是。(4)、装置丁中三颈烧瓶需置于冷水浴中,其原因是。(5)、某实验小组利用该装置消耗氯气1120 mL(标准状况下,SO2足量) ,最后得到纯净的磺酰氯4.0 g,则磺酰氯的产率为(结果精确到0.01%)。18. 过氧化氢(H2O2)是一种绿色氧化剂。为了方便贮存、运输,工业上将其转化为固态过碳酸钠(2Na2CO3·3H2O2)。该物质具有Na2CO3与H2O2的双重性质,可用作无毒漂白剂和供氧剂。制备过碳酸钠的工艺流程如下图所示:
回答下列问题:
(1)、H2O2电子式为。(2)、"滤液”中的溶质可作氮肥的是。(3)、“反应II”的化学方程式为。(4)、加入NaCl的作用是。(5)、得到过碳酸钠粗品,经过滤、洗涤、干燥得到产品,证明产品洗涤干净的操作是。(6)、为测定产品纯度,称量m g产品并配制成250mL溶液,量取25.00mL该溶液于锥形瓶中,用0.100mol/L的酸性KMnO4溶液滴定,重复三次实验,平均消耗V mL酸性KMnO4溶液,则产品纯度为(用m、V表示)(7)、过硼酸钠晶体(NaBO3·4H2O)也可用作无毒漂白剂,加热至70℃以上会逐步失去结晶水。实验测得过硼酸钠晶体的质量随温度变化的曲线如下图所示,则T2~ T3所对应的化学方程式为。 (8)、与同周期,、、可形成一种具有特殊导电性的晶体(化学式为 , 、为整数),其立方晶胞如图所示,与最小间距大于与最小间距。
(8)、与同周期,、、可形成一种具有特殊导电性的晶体(化学式为 , 、为整数),其立方晶胞如图所示,与最小间距大于与最小间距。①该晶体中,1个周围与其最近的的个数为。
②若与最小间距为 , 阿伏加德罗常数为 , 则该晶体的密度为。
 19. 含氮化合物在生产、生活中有着广泛的用途。回答下列问题:
19. 含氮化合物在生产、生活中有着广泛的用途。回答下列问题:已知:Ⅰ.
Ⅱ.
Ⅲ.
(1)、若反应Ⅲ的逆反应活化能为 , 则正反应活化能为(用含的式子表示)。(2)、在恒容密闭容器中按投料比发生反应Ⅲ,不同催化剂条件下,反应相同时间时,测得转化率与温度的关系如图所示。①下列能够说明反应Ⅲ在某种条件下已达到化学平衡状态的是(填标号)。
A. B.混合气体的密度不再变化
C.200℃时,容器内气体总压强不再变化
D.混合气体的平均相对分子质量不再变化

②使用催化剂乙,温度高于350℃时,转化率降低,原因可能是。
③研究表明该反应速率 , 其中为速率常数,与温度、活化能有关。℃的初始速率为 , 当转化率为50%时,反应速率为 , 由此可知。
(3)、工业上常利用反应 合成氨气,在、不同物质的量分数(75%的和25%的;67.5%的、22.5%的和10%的惰性气体)条件下进行实验,测得平衡时体积分数与温度的关系如图所示。
①物质的量分数为75%的和25%的所对应的曲线是(填“a”或“b”)。
②点时,的转化率为。点对应温度下,反应的压强平衡常数(用平衡分压代替平衡浓度,分压=总压×物质的量分数。保留两位有效数字)。
20. 氧氮杂环是新药研制过程中发现的一类重要活性物质,有抗肿瘤功效。下面是某研究团队提出的一种氧氮杂环类化合物F的合成路线:
已知:
 +
+
 (1)、A的名称是 , B中含氧官能团的名称是羧基、 , E中手性碳原子的数目为。(2)、根据C的结构特征,分析预测其可能的化学性质,完成下表。
(1)、A的名称是 , B中含氧官能团的名称是羧基、 , E中手性碳原子的数目为。(2)、根据C的结构特征,分析预测其可能的化学性质,完成下表。序号
结构特征
反应的试剂、条件
反应形成的新结构或产物
反应类型
①

、

还原反应
②
M的结构简式
D
反应
(3)、B有多种同分异构体,满足以下条件的同分异构体有种。①仅含苯环一个环状结构,且苯环上仅有2个取代基
②仅含2种官能团且能发生银镜反应
③不含 , 不含
 .
.其中核磁共振氢谱有三组吸收峰,峰面积之比为3∶2∶2的一种同分异构体结构简式。
(4)、参照上述合成路线和信息,写出由 和
和  为原料合成
为原料合成 的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选) 。
的路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选) 。