“高效课堂”1.4.2Ca(OH)2的性质(提升版)--2023-2024学年浙教版科学九年级上册
试卷更新日期:2023-11-01 类型:同步测试
一、单选题
-
1. 下列各组物质的名称、俗称、化学式表示同一物质的是( )A、氢氧化钠,纯碱,NaOH B、氮化钠,食盐,KCl C、氢氧化钙,消石灰,Ca(OH)2 D、碳酸钙,生石灰,CaCO32. 如图所示。室温下有两杯氢氧化钙溶液,其中乙杯底部有少量氢氧化钙固体沉淀,室温下久置后,沉淀数量无变化。将它们混合在第三只烧杯中。可形成氢氧化钙的丙溶液。则下列说法成立的是( )
 A、甲溶液的溶质质量分数一定小于乙 B、升温可能使乙中未溶解的氢氧化钙溶解 C、搅拌可能使乙中未溶解的氢氧化钙溶解 D、混合后丙溶液的溶质质量分数可能等于甲或等于乙3. 氢氧化钙(俗名熟石灰)在不同温度时的溶解度如下表:
A、甲溶液的溶质质量分数一定小于乙 B、升温可能使乙中未溶解的氢氧化钙溶解 C、搅拌可能使乙中未溶解的氢氧化钙溶解 D、混合后丙溶液的溶质质量分数可能等于甲或等于乙3. 氢氧化钙(俗名熟石灰)在不同温度时的溶解度如下表:温度/℃
0
20
40
60
80
溶解度/g
0.18
0.16
0.14
0.11
0.09
根据表中信息,判断下列说法不正确的是( )
A、氢氧化钙在水中的溶解性是微溶 B、20℃时,氢氧化钙的溶解度为 0.16g C、40℃时,降低氢氧化钙饱和溶液温度会析出溶质 D、60℃时,向 50g 水中加入 0.05g 氢氧化钙充分搅拌,固体完全溶解4. 为了研究氢氧化钙的性质,教材中设计了如图所示实验。关于图中物质反应的相关说法错误的是( ) A、与稀硫酸反应,是因为它能电离出氢氧根离子 B、与稀盐酸反应产生不溶于水的氯化钙,体现了碱的通性 C、与碳酸钠溶液反应,是因为它能电离出钙离子 D、与氯化铁反应生成氢氧化铁和氯化钙,体现了碱的通性5. 现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“-”表示物质间可以发生化学友应,“→”表示物质间存在相应的转化关系)。下列判断合理的是( )
A、与稀硫酸反应,是因为它能电离出氢氧根离子 B、与稀盐酸反应产生不溶于水的氯化钙,体现了碱的通性 C、与碳酸钠溶液反应,是因为它能电离出钙离子 D、与氯化铁反应生成氢氧化铁和氯化钙,体现了碱的通性5. 现有铁、氧化铁、稀硫酸、氢氧化钙溶液、碳酸钠溶液等五种物质,存在着如图所示的相互反应或转化关系(图中“-”表示物质间可以发生化学友应,“→”表示物质间存在相应的转化关系)。下列判断合理的是( ) A、丙可能是碳酸钠溶液 B、丁可能是氢氧化钙溶液 C、乙必须通过置换反应转化为铁 D、甲和丁的反应一定是中和反应6. 氢氧化钡(Ba(OH)2)与氢氧化钙的化学性质相似。实验小组为了验证氢氧化钡的某些化学性质,设计如图所示实验,其中不能达到实验目的的是( )
A、丙可能是碳酸钠溶液 B、丁可能是氢氧化钙溶液 C、乙必须通过置换反应转化为铁 D、甲和丁的反应一定是中和反应6. 氢氧化钡(Ba(OH)2)与氢氧化钙的化学性质相似。实验小组为了验证氢氧化钡的某些化学性质,设计如图所示实验,其中不能达到实验目的的是( ) A、利用实验①验证氢氧化钡溶液显碱性 B、利用实验②验证氢氧化钡能与酸反应 C、利用实验③验证氢氧化钡能与某些盐反应 D、利用实验④验证氢氧化钡能与某些非金属氧化物反应7. 有一包固体样品,可能含氯化铁、硫酸钠、氢氧化钡、氢氧化钠中的一种或几种。小宁进行了如下实验.根据实验现象,下列判断错误的是( )
A、利用实验①验证氢氧化钡溶液显碱性 B、利用实验②验证氢氧化钡能与酸反应 C、利用实验③验证氢氧化钡能与某些盐反应 D、利用实验④验证氢氧化钡能与某些非金属氧化物反应7. 有一包固体样品,可能含氯化铁、硫酸钠、氢氧化钡、氢氧化钠中的一种或几种。小宁进行了如下实验.根据实验现象,下列判断错误的是( )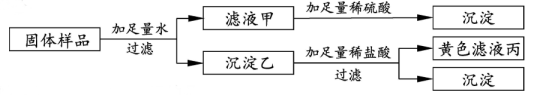 A、滤液丙中含有氯化铁 B、沉淀乙为氢氧化铁、硫酸钡 C、滤液甲中一定不存在氢氧化钠 D、样品中一定有氯化铁、硫酸钠、氢氧化钡8. 下表为硝酸钾和氢氧化钙在不同温度下的溶解度。如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中的固体增加,则加入的物质可能是( ) 。
A、滤液丙中含有氯化铁 B、沉淀乙为氢氧化铁、硫酸钡 C、滤液甲中一定不存在氢氧化钠 D、样品中一定有氯化铁、硫酸钠、氢氧化钡8. 下表为硝酸钾和氢氧化钙在不同温度下的溶解度。如图所示,甲、乙试管分别盛有20℃时硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。现向烧杯内的水中加入某物质后,甲试管中固体消失,乙试管中的固体增加,则加入的物质可能是( ) 。
温度(℃)
10
20
40
60
80
氢氧化钙的质量(克)
0.173
0.165
0.121
0.120
0.095
硝酸钾的质量(克)
13.3
31.6
63.9
110
169
A、硝酸铵 B、氢氧化钠 C、蔗糖 D、氯化钠9. 实验桌上有三瓶白色固体,只知其为氯化钠、氢氧化钠和硝酸钾,但因标签脱落,难以分辨。某同学进行了以下实验:从三瓶白色固体中各取出少许,分别加入甲、乙、丙三支试管中,往试管中依次加入适量的蒸馏水、无色酚酞溶液和硝酸银溶液,振荡,观察现象并记录,加入试剂后所观察到的现象如下表所示:试剂
试管甲
试管乙
试管丙
加蒸馏水/现象
无色澄清
无色澄清
无色澄清
加无色酚酞溶液/现象
无明显变化
无明显变化
溶液变红色
加入硝酸银溶液/现象
无明显变化
白色沉淀
/
根据上述实验现象判断(表格中“/”表示没有加入),甲、乙、丙试管所加入的白色固体物质依
次是( )
A、氯化钠、氢氧化钠、硝酸钾 B、硝酸钾、氯化钠、氢氧化钠 C、氢氧化钠、硝酸钾、氯化钠 D、氯化钠、硝酸钾、氢氧化钠二、填空题
-
10. 对知识的归纳和总结是学好科学的重要方法.在学习了碱的性质后,小红同学总结了氢氧化钙的四条化学性质(如图),即氢氧化钙与图中四类物质能够发生化学反应。
 (1)、为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成 色。(2)、如图中
(1)、为了验证氢氧化钙与酸碱指示剂反应,小红将无色酚酞试液滴入氢氧化钙溶液中,溶液由无色变成 色。(2)、如图中 是 。 (3)、利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式 。11. 小明研究氢氧化钙化学性质,进行了如下两个实验。
是 。 (3)、利用氢氧化钙与盐反应的性质,可以除去氢氧化钠溶液中少量的氢氧化钙杂质,请写出该化学反应的方程式 。11. 小明研究氢氧化钙化学性质,进行了如下两个实验。
 (1)、实验过程中能观察到有白色沉淀生成的是实验。(填写图中的序号)(2)、图乙表示实验③过程中溶液中离子种类在反应前后的变化,★表示的离子是。(3)、实验结束后,将实验②和③试管中的废液倒入同一个烧杯中,发现沉淀消失,其原因是。12. 氯化钠、硝酸钾、氢氧化钙三种物质的溶解度曲线如图一与图二所示。请回答:
(1)、实验过程中能观察到有白色沉淀生成的是实验。(填写图中的序号)(2)、图乙表示实验③过程中溶液中离子种类在反应前后的变化,★表示的离子是。(3)、实验结束后,将实验②和③试管中的废液倒入同一个烧杯中,发现沉淀消失,其原因是。12. 氯化钠、硝酸钾、氢氧化钙三种物质的溶解度曲线如图一与图二所示。请回答: (1)、要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用方法;(2)、在不改变溶质质量分数的情况下,把不饱和的氢氧化钙溶液变成饱和溶液的方法:;(3)、50℃时,分别向盛有10g水的两支试管中,加入等质量的氯化钠、硝酸钾两种固体物质,使其充分溶解,可观察到如图三所示的现象。A试管中溶解的物质是。若将温度都降到20℃,硝酸钾溶液中溶质的质量分数(填“>”、“<”或“=”)氯化钠溶液中溶质的质量分数。13. 下图是小科鉴别盐酸、硫酸、氢氧化钙三瓶溶液的实验过程和现象,请据图分析回答。
(1)、要从含有少量硝酸钾的氯化钠溶液中,得到较纯净的氯化钠固体,可采用方法;(2)、在不改变溶质质量分数的情况下,把不饱和的氢氧化钙溶液变成饱和溶液的方法:;(3)、50℃时,分别向盛有10g水的两支试管中,加入等质量的氯化钠、硝酸钾两种固体物质,使其充分溶解,可观察到如图三所示的现象。A试管中溶解的物质是。若将温度都降到20℃,硝酸钾溶液中溶质的质量分数(填“>”、“<”或“=”)氯化钠溶液中溶质的质量分数。13. 下图是小科鉴别盐酸、硫酸、氢氧化钙三瓶溶液的实验过程和现象,请据图分析回答。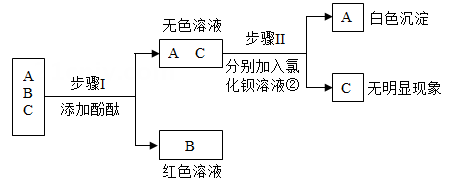 (1)、B物质是 ;(2)、写出A和氯化钡反应的化学方程式。
(1)、B物质是 ;(2)、写出A和氯化钡反应的化学方程式。三、实验探究题
-
14. 某某实验小组的同学利用氢氧化钙溶液和稀盐酸进行酸碱中和反应的实验时,他们在向盛有氢氧化钙溶液的烧杯中滴加一定量的稀盐酸后,才发现忘记滴加了酸碱指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中所含溶质的成分进行探究.(1)、【提出猜想】
猜想一:溶质是CaCl2和Ca(OH)2
猜想二:溶质是CaCl2
猜想三:溶质是CaCl2和 .
(2)、【查阅资料】①CaCl2溶液呈中性;②有关的化学反应:
a.氢氧化钙溶液和稀盐酸进行中和反应的化学方程式为:Ca(OH)2+2HCl=CaCl2+2H2O
b.碳酸钠溶液和稀盐酸反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O
c.碳酸钠溶液和氯化钙溶液反应的化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl
【实验设计与验证】
小猛同学设计用无色酚酞溶液验证“猜想一”是否成立.取少量上述实验中烧杯里的溶液于试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到溶液不变色.于是可以确定“猜想一”(填“成立”或“不成立”),其理由是 .
(3)、小华同学设计用碳酸钠溶液验证“猜想二”和“猜想三”是否成立.取少量上述实验中烧杯里的溶液于试管中,并向试管中逐滴加入过量的碳酸钠溶液,观察到的现象是:先出现气泡,后有生成.于是可以确定成立.(4)、【交流与反思】经过同学们讨论和交流,发现只需用下列一种物质就能验证得出以上三种猜想中的哪一种猜想成立,请在下列物质的选项中选择出你认为合理的物质是________ (填序号).
A、锌粒 B、紫色石蕊溶液 C、二氧化碳.15. 某化学实验小组欲探究盐酸、氢氧化钙的化学性质,取8支试管分别用A﹣H编号后,做如下实验. (1)、实验中有沉淀生成的试管是 , 发生中和反应的试管是。(2)、写出实验中无明显现象产生的试管中发生的化学方程式。(3)、实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,一段时间后有气泡冒出,则该滤液中的溶质是。16. 化学兴趣小组的同学在帮助老师整理实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钙粉末.于是对该粉末进行了如下探究.
(1)、实验中有沉淀生成的试管是 , 发生中和反应的试管是。(2)、写出实验中无明显现象产生的试管中发生的化学方程式。(3)、实验后某试管的底部有白色固体,过滤后向滤液中滴加盐酸,一段时间后有气泡冒出,则该滤液中的溶质是。16. 化学兴趣小组的同学在帮助老师整理实验室时,意外地发现实验桌上有一瓶敞口放置的氢氧化钙粉末.于是对该粉末进行了如下探究.【提出问题】该瓶粉末的成分是什么?
(1)、【猜想与假设】猜想一:该瓶粉末的成分可能为氢氧化钙猜想二:该瓶粉末的成分可能为氢氧化钙和碳酸钙
猜想三:该瓶粉末的成分可能为 , 做出猜想三的理由是 .
(2)、【实验验证】请你参与探究,完成下面的实验报告.实验步骤
实验现象
实验结论
猜想二正确
⑴取少量样品于小烧杯中,加入适量水,充分搅拌,过滤,取少量滤渣于试管中,加入 .
有大量气泡产生
说明含有
⑵取步骤⑴中的于试管中,滴加无色酚酞溶液.
说明含有
(3)、【联想与启示】氢氧化钙露置在空气中会发生变质,变质的原因是 (用化学方程式表示),因此,必须保存.17. 在研究碱的性质时,向充满二氧化碳的矿泉水瓶里加入少量氢氧化钙溶液,拧紧瓶盖并振荡,瓶变瘪,但溶液中并未出现浑浊,那么氢氧化钙溶液是否与二氧化碳反应呢?于是同学们进行了猜想和实验:猜想一:氢氧化钙溶液与二氧化碳不反应,是二氧化碳溶于水导致瓶内气压变小而变瘪。
猜想二:氢氧化钙溶液与二氧化碳反应,生成了可溶性物质。
实验
步骤与操作
出实验现象与结果
结论
一
1.取2个相同的软塑料瓶,分别集满二氧化碳气体,编号为A、B。
两瓶内气体无色透明,瓶子形状正常
氢氧化钙溶液与二氧化碳发生了化学反应
分别向A、B两瓶中加入等量的饱和氢氧化钙溶液和 ? , 立即拧紧瓶盖并振荡。
两瓶内液体未出现浑浊,两瓶均变瘪,A瓶变瘪程度更大。
二
测出反应前氢氧化钙溶液的酸碱度。
偏碱性。
测出反应后A瓶内液体的酸碱度。
偏酸性。
(1)、将表中“?”处的内容补充完整:。目的是。(2)、能判断“氢氧化钙溶液与二氧化碳发生化学反应”的依据:。(3)、查阅资料得知:A瓶中未出现浑浊是因为过量的二氧化碳与水和碳酸钙反应生成可溶性的碳酸氢钙。有人提出,只要利用现有装置和试剂,对实验一稍作补充或改进就能观察到浑浊现象,请简要说明你的做法:。四、解答题
-
18. 兴趣小组的同学在实验室中发现了一瓶敞口放置的氢氧化钙粉末状试剂。他们对该试剂进行了定量:实验分析:称取试剂20克放入锥形瓶中,加30克的水,充分振荡,再向锥形瓶中依次滴加25克盐酸充分反应,测得部分数据与图象如下。请根据有关信息回答问题:
实验次数
第1次
第2次
第3次
第4次
第5次
第6次
稀硫酸的用量/克
25
25
25
25
25
25
剩余固体的质量/克
75
100
125
150
172.8
197.8
 (1)、兴趣小组的同学分析实验数据和图象,得出该试剂已部分变质的结论,其依据是。(2)、b的数值为。(3)、计算该氢氧化钙粉末状试剂中氢氧化钙的质量分数。19. 设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究。
(1)、兴趣小组的同学分析实验数据和图象,得出该试剂已部分变质的结论,其依据是。(2)、b的数值为。(3)、计算该氢氧化钙粉末状试剂中氢氧化钙的质量分数。19. 设计方案是实验探究的保证,感悟方法是探究的根本目的。某合作学习小组开展了如下探究。【实验目的】检验氢氧化钠溶液中是否含有氢氧化钙。
(1)、【分析】从组成上看,氢氧化钙和氢氧化钠都属于碱,所以具有相似的化学性质。如果在它们的水溶液中滴加酚酞溶液,都能看到的现象是;但由于电离出的Na+和Ca2+不同,所以性质也有不同。设计实验时可加入能电离出CO32﹣的试剂,利用CO32﹣与Ca2+结合产生白色沉淀这一特殊现象予以检验。实验操作
现象
结论
方案一
取少量待测溶液于试管中,通入CO2
出现白色沉淀
氢氧化钠溶液中含有氢氧化钙
方案二
取少量待测溶液于试管中,滴加Na2CO3溶液
出现白色沉淀
(2)、【设计方案并实验】写出方案二中出现白色沉淀反应的化学方程式。【方法感悟】在检验物质时,要分析物质的组成和性质,据此选择加入恰当的试剂,最后根据不同现象得出结论。
(3)、【定量研究】某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,称取10g该样品,加入54g水完全溶解后,缓慢加入稀盐酸,同时测定溶液的pH,当pH=7时,刚好用去10%的稀盐酸73g。计算:①将200g质量分数为38%的浓盐酸稀释成10%的稀盐酸,需要加水多少?
②样品中氢氧化钠的质量分数。
(4)、反应后所得溶液中溶质的质量分数。