广东省东莞市名校2023-2024学年高三上学期第二次月考化学试题
试卷更新日期:2023-10-28 类型:月考试卷
一、选择题:(本题共16小题,共44分。第1~10小题,每小题2分;第11~16小题,每小题4分。在每小题给出的四个选项中,只有一项是符合题目要求的。)
-
1. 中华文明源远流长,在世界文明中独树一帜,汉字居功至伟。随着时代发展,汉字被不断赋予新的文化内涵,其载体也发生相应变化。下列汉字载体主要由合金材料制成的是( )
汉字载体




选项
A.兽骨
B.青铜器
C.纸张
D.液晶显示屏
A、A B、B C、C D、D2. 劳动开创未来。下列劳动项目与所述化学知识没有关联的是( )选项
劳动项目
化学知识
A
面包师用小苏打作发泡剂烘焙面包
可与酸反应
B
环保工程师用熟石灰处理酸性废水
熟石灰具有碱性
C
工人将模具干燥后再注入熔融钢水
铁与高温下会反应
D
技术人员开发高端耐腐蚀镀铝钢板
铝能形成致密氧化膜
A、A B、B C、C D、D3. 要除去下列选项中括号内的杂质,所选试剂和方法正确的是( )A、CuSO4(H2SO4):NaOH,加热浓缩 B、MgO(Al2O3):NaOH,过滤 C、Cl2(HCl):饱和NaHCO3 , 洗气 D、Fe2O3(FeO):O2 , 加热4. 甲、乙、丙、丁四种元素均为短周期元素,在周期表中的位置如图所示,已知四种元素中至少有一种金属元素。下列说法错误的是( )甲
乙
丙
丁
A、原子半径:丙>丁>乙 B、丙的最高价氧化物对应的水化物一定能与强酸反应 C、丙单质与反应的产物一定只含离子键 D、若甲、乙、丁均为非金属,则乙的非金属性最强5. 下列关于 的化合物之间转化反应的离子方程式书写正确的是( )A、碱转化为酸式盐: B、碱转化为两种盐: C、过氧化物转化为碱: D、盐转化为另一种盐:6. 为检验牺牲阳极的阴极保护法对钢铁防腐的效果,将镀层有破损的镀锌铁片放入酸化的 溶液中。一段时间后,取溶液分别实验,能说明铁片没有被腐蚀的是( )A、加入 溶液产生沉淀 B、加入淀粉碘化钾溶液无蓝色出现 C、加入 溶液无红色出现 D、加入 溶液无蓝色沉淀生成7. 实验室有一包白色固体由Na2CO3、Na2SO4、NaCl、CuSO4 中的一种或几种组成,实验记录如下:① 取该样品溶于水,得到无色溶液;
② 取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,过滤;
③ 向步骤②所得沉淀中加入过量的HNO3 , 沉淀全部消失并产生气泡。
下列分析中正确的是( )
A、原固体中一定含有Na2CO3 , 可能含有CuSO4和NaCl B、原固体中一定不含Na2SO4和CuSO4 , 可能含有NaCl C、原固体中一定含有Na2CO3和Na2SO4 , 一定不含CuSO4 D、若在步骤②所得滤液中滴入AgNO3溶液,出现白色沉淀,则原固体中一定含有NaCl8. 为阿伏加德罗常数的值,下列说法正确的是( )A、25℃,下,氢气中质子的数目为 B、溶液中,的数目为 C、苯甲酸完全燃烧,生成的数目为 D、电解熔融 , 阴极增重 , 外电路中通过电子的数目为9. 下列反应的离子方程式不正确的是( )A、通入氢氧化钠溶液: B、氧化铝溶于氢氧化钠溶液: C、过量通入饱和碳酸钠溶液: D、溶液中滴入氯化钙溶液:10. 硫酸铜应用广泛,下列说法不正确的是( )A、元素位于周期表p区 B、硫酸铜属于强电解质 C、硫酸铜溶液呈酸性 D、硫酸铜能使蛋白质变性11. 一种分解氯化铵实现产物分离的物质转化关系如下,其中代表或中的一种。下列说法正确的是( )
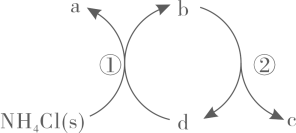 A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热12. 一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是
A、、分别是 B、既可以是 , 也可以是 C、已知为副产物,则通入水蒸气可减少的产生 D、等压条件下,反应、的反应热之和,小于氯化铵直接分解的反应热12. 一些化学试剂久置后易发生化学变化。下列化学方程式可正确解释相应变化的是A
硫酸亚铁溶液出现棕黄色沉淀
B
硫化钠溶液出现浑浊颜色变深
C
溴水颜色逐渐褪去
D
胆矾表面出现白色粉末
A、A B、B C、C D、D13. 离子化合物和与水的反应分别为;。下列说法正确的是( )A、中均有非极性共价键 B、中水发生氧化反应,中水发生还原反应 C、中阴、阳离子个数比为 , 中阴、阳离子个数比为 D、当反应和中转移的电子数相同时,产生的和的物质的量相同14. 探究铁及其化合物的性质,下列方案设计、现象和结论都正确的是实验方案
现象
结论
A
往溶液中加入片
短时间内无明显现象
的氧化能力比弱
B
往溶液中滴加溶液,再加入少量固体
溶液先变成血红色后无明显变化
与的反应不可逆
C
将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加溶液
溶液呈浅绿色
食品脱氧剂样品中没有价铁
D
向沸水中逐滴加5~6滴饱和溶液,持续煮沸
溶液先变成红褐色再析出沉淀
先水解得再聚集成沉淀
A、A B、B C、C D、D15. 氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗,下列说法不正确的是( ) A、电极A接电源正极,发生氧化反应 B、电极B的电极反应式为: C、应选用阳离子交换膜,在右室获得浓度较高
A、电极A接电源正极,发生氧化反应 B、电极B的电极反应式为: C、应选用阳离子交换膜,在右室获得浓度较高 溶液
D、改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
16. 探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )
溶液
D、改进设计中通过提高电极B上反应物的氧化性来降低电解电压,减少能耗
16. 探究卤族元素单质及其化合物的性质,下列方案设计、现象和结论都正确的是( )实验方案
现象
结论
A
往碘的溶液中加入等体积浓溶液,振荡
分层,下层由紫红色变为浅粉红色,上层呈棕黄色
碘在浓溶液中的溶解能力大于在中的溶解能力
B
用玻璃棒蘸取次氯酸钠溶液点在试纸上
试纸变白
次氯酸钠溶液呈中性
C
向溶液中先滴加4滴溶液,再滴加4滴溶液
先产生白色沉淀,再产生黄色沉淀
转化 , 溶解度小于溶解度
D
取两份新制氯水,分别滴加溶液和淀粉溶液
前者有白色沉淀,后者溶液变蓝色
氯气与水反应存在限度
A、A B、B C、C D、D二、非选择题:本小题共4小题,共56分。
-
17. 元素分析是有机化合物的表征手段之一。按下图实验装置(部分装置略)对有机化合物进行C、H元素分析。
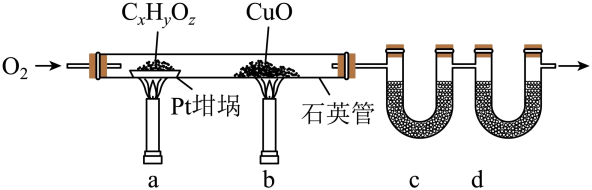
回答下列问题:
(1)、将装有样品的Pt坩埚和CuO放入石英管中,先 , 而后将已称重的U型管c、d与石英管连接,检查。依次点燃煤气灯 , 进行实验。(2)、O2的作用有。CuO的作用是(举1例,用化学方程式表示)。(3)、c和d中的试剂分别是、(填标号)。c和d中的试剂不可调换,理由是。A.CaCl2 B.NaCl C.碱石灰(CaO+NaOH) D.Na2SO3
(4)、Pt坩埚中样品CxHyOz反应完全后,应进行操作:。取下c和d管称重。(5)、若样品CxHyOz为0.0236g,实验结束后,c管增重0.0108g,d管增重0.0352g。质谱测得该有机物的相对分子量为118,其分子式为。18. 已知浓盐酸与高锰酸钾固体混合反应能生成Cl2、KCl和MnCl2等,实验小组在实验室设计如图装置制备纯净、干燥的Cl2并检验其性质,请回答:(1)、Ⅰ.制备氯气和金属氯化物
装置A中发生反应的离子方程式为 。 (2)、已知镓(Ga)是一种“类铝”金属,能与氯气反应生成(填化学式),该生成物具有很强的吸湿性,在空气中易吸收水蒸气而冒烟。为保证实验顺利进行,装置B的溶液选择、装置C的溶液选择。装置E的作用是 。(3)、Ⅱ.检验氯气的性质:
(2)、已知镓(Ga)是一种“类铝”金属,能与氯气反应生成(填化学式),该生成物具有很强的吸湿性,在空气中易吸收水蒸气而冒烟。为保证实验顺利进行,装置B的溶液选择、装置C的溶液选择。装置E的作用是 。(3)、Ⅱ.检验氯气的性质:
装置甲的实验目的是验证氯气是否具有漂白性,则甲中Ⅰ、Ⅱ、Ⅲ应依次放 (填字母)。选项
Ⅰ
Ⅱ
Ⅲ
a
干燥的有色布条
生石灰
湿润的有色布条
b
湿润的有色布条
无水氯化钙
干燥的有色布条
c
湿润的有色布条
浓硫酸
干燥的有色布条
(4)、装置乙中盛有NaBr溶液,观察到的实验现象是 。该现象说明 。(5)、装置丙中盛有NaOH溶液,试管口内部放置湿润淀粉﹣KI试纸的主要目的是 。19. 铍是原子能、火箭、导弹、航空以及冶金工业中不可缺少的宝贵材料。以绿柱石[Be3Al2(SiO3)6]为原料制备两性金属铍的工艺如图:
回答下列问题:
(1)、绿柱石写成氧化物的形式为。(2)、750℃烧结时,Na3FeF6仅与绿柱石中BeO作用生成易溶于水的Na2BeF4 , 滤渣的主要成分是Fe2O3和。(3)、“水浸”时“产物压碎磨细”的目的是 , 为检验“过滤1”的滤液中是否含有Na+ , 可选用的方法是(填方法名称)。(4)、“沉氟”的化学方程式为。(5)、镍坩埚作阴极、石墨作阳极,350~400℃电解NaCl-BeCl2熔融混合物得到金属铍,阳极反应式为;不能用该电解槽电解熔融氯化铍制金属铍的原因可能是。20. 是制造电信器材软磁铁氧体,合成二氧化锰和制造其他锰盐的原料。用粉与矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备的工艺如下图所示: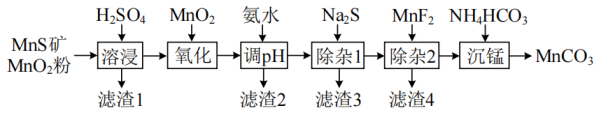
相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子
开始沉淀的pH
8.1
6.3
1.5
3.4
8.9
6.2
6.9
沉淀完全的pH
10.1
8.3
2.8
4.7
10.9
8.2
8.9
(1)、已知“滤渣1”含有S和 , 写出“溶浸”中生成S的化学方程式。(2)、加入氧化的是哪种离子?(3)、“调pH”控制的pH为4.7~6.0之间,写出“滤渣2”的化学式。(4)、“除杂1”的目的是加入除去和 , 分析该步骤不能通过调节pH除杂的原因。(5)、写出“沉锰”的离子方程式。(6)、在空气中加热易转化为不同价态的锰的氧化物,某小组称取一定质量的固体在空气中加热,测得固体质量的残留率随着温度的变化如图所示。
①写出从开始加热到A点过程中发生反应的化学方程式。
②若D点对应的固体残留率为64.52%,写出D点残留固体的成分及物质的量之比。