“高效课堂”1.5 物质的溶解(提升版)--2023-2024学年浙教版科学八年级上册
试卷更新日期:2023-10-25 类型:同步测试
一、选择题
-
1. 20℃时,四个实验小组分别取不同质的NaCl,逐渐加入各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量,记录数据如下表:
实验小组
第一组
张二组
第三组
第四组
水的质量/g
50
50
50
50
所取NaCl的质量/g
15
20
25
30
剩余NaCl的质量/g
0
2
7
12
下列说法错误的是( )
A、 相同温度下,NaCl在水里的溶解度与水的质量无关 B、用蒸发的方法可以使不饱和溶液变成饱和溶液 C、第二组所得溶液的溶质与溶剂的质比为9:25 D、20℃时,50gNaCl饱和溶液中含有18gNaCl2. 甲是60℃的蔗糖溶液,按如图所示进行操作。以下分析错误的是( ) A、甲一定是不饱和溶液 B、丙和丁一定是饱和溶液 C、乙的溶质质量分数一定比甲大 D、甲和丙的溶质质量分数一定不相等3. 固体甲、乙、丙在不同温度下的溶解度如表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )
A、甲一定是不饱和溶液 B、丙和丁一定是饱和溶液 C、乙的溶质质量分数一定比甲大 D、甲和丙的溶质质量分数一定不相等3. 固体甲、乙、丙在不同温度下的溶解度如表所示,甲、乙、丙从溶液中析出的晶体不含结晶水。下列说法正确的是( )温度/℃
0
20
40
60
80
溶解度/g
甲
0.18
0.16
0.14
0.12
0.09
乙
35.7
36.0
36.6
37.3
38.4
丙
13.3
31.6
63.9
110
169
A、固体甲的溶解度随温度的升高而增大 B、20℃时,丙溶液中溶质和溶剂质量比为31.6: 100 C、分别将等质量的乙、丙饱和溶液由60℃降温到20℃,溶液中溶质质量大小:丙>乙. D、分别将等质量的甲、丙饱和溶液由60℃降温到20℃,溶液中溶剂质量大小:甲>丙4. 我们会接触到各种各样的“液体”,下列对这些“液体”的认识,正确的是( )A、盐溶解在水中形成盐水,盐水是均一、稳定、透明的纯净物 B、用汽油去除油污,汽油相当于溶剂,油污相当于溶质 C、汽水倒入杯中会有大量气泡逸出,说明气体不能溶于水 D、一杯盐水敞开放置较长时间会有晶体析出,可判断它原先是饱和溶液5. 已知硫酸溶液密度大于1,且浓度越大、密度越大。某硫酸的质量分数为W,取等量的两份硫酸溶液分别进行下列操作:⑴蒸发溶液后恢复至室温,溶液质量减为原来一半,此时溶液的质量分数为W1
⑵蒸发溶液后恢复至室温,溶液体积减为原来一半,此时溶液的质量分数为W2
则下列关系正确的是( )
A、W1﹥W2 B、W1﹤W2 C、W1=W2 D、W2﹥2W6. 溶解度为Sg的某物质饱和溶液,跟水以1:4质量比混合后,溶液的质量分数为为( )A、 B、 C、 D、7. 如图所示为蒸发食盐溶液的实验过程,其中①→②→③为恒温蒸发过程,③→④为升温蒸发过程,分析实验过程,可以作出如下判断,其中错误的是( ) A、在①→③变化过程中,食盐的溶解度保持不变 B、在②→③变化过程中,溶剂的质量不断减少 C、③与④溶液中,溶质与溶剂的比值不可能相同 D、在①→④变化过程中,食盐的质量分数一直不断增大8. 烧杯A中装有t1℃时M物质的饱和溶液,进行某些操作后,实验结果如图1所示;图2则为M和N两种物质的溶解度曲线图。请分析判断,下列说法正确的是( )
A、在①→③变化过程中,食盐的溶解度保持不变 B、在②→③变化过程中,溶剂的质量不断减少 C、③与④溶液中,溶质与溶剂的比值不可能相同 D、在①→④变化过程中,食盐的质量分数一直不断增大8. 烧杯A中装有t1℃时M物质的饱和溶液,进行某些操作后,实验结果如图1所示;图2则为M和N两种物质的溶解度曲线图。请分析判断,下列说法正确的是( ) A、M物质的溶解度曲线是a B、烧杯B中的溶液一定是不饱和溶液 C、烧杯C到烧杯D的变化中,该物质的溶解度变小了 D、烧杯C到烧杯D的变化中,溶质的质量分数一定变大9. 如图所示是A、B、C三种物质的溶解度曲线,下列分析正确的是( )
A、M物质的溶解度曲线是a B、烧杯B中的溶液一定是不饱和溶液 C、烧杯C到烧杯D的变化中,该物质的溶解度变小了 D、烧杯C到烧杯D的变化中,溶质的质量分数一定变大9. 如图所示是A、B、C三种物质的溶解度曲线,下列分析正确的是( ) A、A物质的溶解度大于B物质的溶解度 B、20℃时A,C两物质的饱和溶液溶质质量分数相等 C、50℃时把50gA放入50g水中能得到A的饱和溶液,其溶质与溶液的质量比为1:2 D、20℃时A,B,C三种物质的饱和溶液升温到50℃时,三种溶液的溶质质量分数的大小关系是B>A=C
A、A物质的溶解度大于B物质的溶解度 B、20℃时A,C两物质的饱和溶液溶质质量分数相等 C、50℃时把50gA放入50g水中能得到A的饱和溶液,其溶质与溶液的质量比为1:2 D、20℃时A,B,C三种物质的饱和溶液升温到50℃时,三种溶液的溶质质量分数的大小关系是B>A=C二、填空题
-
10. 20℃时,将等质量的甲、乙两种固体物质(不含结晶水),分别加入到盛有100g 水的烧杯中,充分搅拌后现象如图1,加热到50℃时现象如图2,甲、乙两种物质的溶解度如图3。
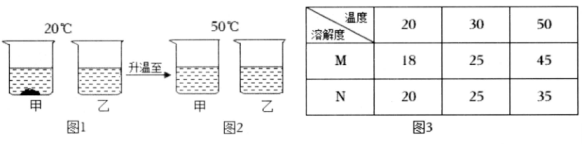 (1)、图1中甲是溶液(选填“饱和”或“不饱和”)。(2)、图2中两溶液溶质质量分数一定 (选填 “相等”或“不相等”);(3)、图3中M表示的是物质(选填“甲”或“乙”)11. 下表是二种物质在不同温度时的溶解度,根据表中信息回答问题。
(1)、图1中甲是溶液(选填“饱和”或“不饱和”)。(2)、图2中两溶液溶质质量分数一定 (选填 “相等”或“不相等”);(3)、图3中M表示的是物质(选填“甲”或“乙”)11. 下表是二种物质在不同温度时的溶解度,根据表中信息回答问题。温度/℃
0
20
40
60
80
100
溶解度/g
氯化钠
35.7
36.0
36.6
37.3
38.4
39.8
硝酸钾
13.3
21.6
63.0
110
169
246
(1)、在60℃时,在100克水中加入120克硝酸钾,充分搅拌,所得溶液为60℃时硝酸钾的(选填”“饱和”或”不饱和”)溶液。(2)、20℃时,将20g硝酸钾加入40g水中,所得溶液的溶质质量分数为(3)、如果在大量的硝酸钾中,含有少量杂质氯化钠,要提纯硝酸钾,可先将样品配制成溶液,再采取(选填”蒸发溶剂”或”冷却热饱和溶液”)结晶的方法获得更高纯度的硝酸钾。12. 下表是氯化铵与硝酸钾在不同温度时的溶解度,请回答:温度/℃
10
20
30
40
50
60
溶解度/g
氯化铵
33.3
37.2
41.4
45.8
50.4
55.2
硝酸钾
20.9
31.6
45.8
63.9
85.5
110
(1)、将100克60℃时的氯化铵和硝酸钾的饱和溶液同时降温到10℃,两者析出晶体(填“氯化铵较多”、“硝酸钾较多”或“无法确定”)。(2)、下图中M是氯化铵或硝酸钾中的一种,按图进行相关操作,其中A、B、C、D四个烧杯中溶质质量分数的大小关系是。 13. 下表是 A、B、C 三种固体物质在不同温度时的溶解度。
13. 下表是 A、B、C 三种固体物质在不同温度时的溶解度。温度/℃
0
20
40
60
80
100
溶解度/g
A
13.3
31.6
63.9
110
169
246
B
35.7
36.0
36.6
37.3
38.4
39.8
C
0.18
0.16
0.14
0.11
0.09
0.07
(1)、若 A 中混有少量 B,提纯 A 所采用的方法是。(2)、20℃时,100gB饱和溶液中含 B 物质的质量(填“>”“=”“<”)36.0g。(3)、将 40℃时,A,B,C 三种物质的饱和溶液降温至 20℃,溶液中溶质的质量分数保持不变的是。14. 小刚同学在做一定溶质质量分数的氯化钠溶液的配制实验时,其配制过程如图所示.试回答下列问题:
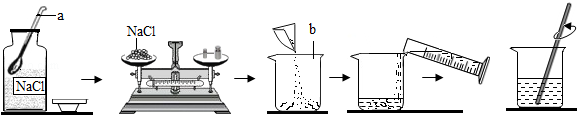 (1)、图示实验中有一处明显的错误是;图示实验中玻璃棒的作用是(2)、小刚同学要配制90g质量分数为10%的氯化钠溶液,应称取氯化钠的质量为g
(1)、图示实验中有一处明显的错误是;图示实验中玻璃棒的作用是(2)、小刚同学要配制90g质量分数为10%的氯化钠溶液,应称取氯化钠的质量为g三、实验探究题
-
15. 粗盐的主要成分是氯化钠,其中含有许多不溶性杂质,老师让同学们利用粗盐提纯后的氯化钠来配制50g质量分数为10%的氯化钠溶液。
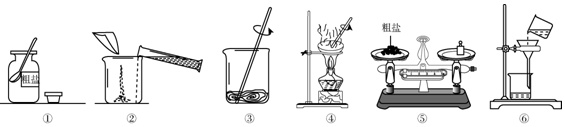 (1)、实验一:如图是同学们做粗盐提纯实验的操作示意图,请回答下列问题:
(1)、实验一:如图是同学们做粗盐提纯实验的操作示意图,请回答下列问题:(a)操作③中用玻璃棒搅拌的作用是。
(b)操作⑥中的错误是。
(c)粗盐提纯实验的最后称量精盐并计算产率。若此实验精盐的产率偏高(产率=所得晶体的质量/所取样品的质量×100%),则可能的原因是(填字母)
A.过滤时滤纸有破损
B.蒸发时有固体溅出
C.溶解含泥沙的粗食盐时,加入的水量不足
D.所得的氯化钠晶体没有烘干,带有水分
E.过滤后滤纸是湿的,纸上含有溶液中的食盐
(2)、实验二:用提纯得到的精盐配制了50g10%的氯化钠溶液。请回答下列问题:(a)配制该溶液需要称取的氯化钠为g,选用的量筒规格为(填:20、50或100)mL。
(b)当用托盘天平称量所需的氯化钠时,发现天平的指针偏向左边,接下去的操作是。
(c)经检测,溶质质量分数偏小,其原因可能是(填序号).
A.氯化钠固体仍然不纯 B.称量时砝码端忘垫质量相同的纸片
C.量取水时,仰视读数 D.装瓶时,有少量溶液洒出
E.操作中砝码和氯化钠放反了。
16. 某科学兴趣小组的同学做粗盐(含有难溶性杂质)提纯实验,并用所得的精盐配制50克10%的氯化钠溶液。请回答下列有关问题:(1)、如图是同学们做粗盐提纯实验的操作示意图。
实验操作⑤中的错误是。
(2)、粗盐提纯实验的操作顺序为(填操作序号);(3)、用粗盐提纯后得到的精盐配制了50 克10%氯化钠溶液,需量取水45mL,在称量食盐的操作中,应先调节天平平衡,接下来的操作是。(4)、配制完成后经检测,溶质质量分数偏大,其原因可能有 (填字母序号,1克以下用游码)。A、称取固体时,砝码放在左盘 B、量取水的体积时,视线仰视 C、配制好的氯化钠溶液装瓶时,有少量溶液洒出 D、量取水的体积时,视线俯视四、解答题
-
17. 下表是氯化钠、硝酸钾在不同温度时的溶解度。
温度/℃
20
30
40
50
60
溶解度/g
氯化钠
36.0
36.3
36.4
37.0
37.3
硝酸钾
31.6
45.8
63.9
85.5
110
(1)、从上表可知,两种物质中,溶解度受温度变化影响较小的是。(2)、要从含有少量氯化钠的硝酸钾溶液中分离出硝酸钾,应采用的方法是。(3)、60℃时,向100g水中加入100g硝酸钾,充分溶解后所得溶液的溶质质量分数为多少?