2023-2024 学年 浙教版科学九年级上册 期中模拟卷(B)
试卷更新日期:2023-10-23 类型:期中考试
一、选择题
-
1. 小柯完成了图示甲、乙实验后,依次将反应后的溶液缓慢倒入同一洁净的废液缸中,观察到废液缸中先有气泡产生,然后又出现白色沉淀。则下列说法中正确的是( )
 A、甲实验结束后,试管中的溶液可能含有稀盐酸 B、乙实验结束后,试管中的废液一定含有 C、最终,废液缸中一定含NaCl、两种溶质 D、最终,废液缸中可能含NaCl、HCl、三种溶质2. 要使如图所示装置中的气球明显鼓起来,则使用的固体和液体可以是( )
A、甲实验结束后,试管中的溶液可能含有稀盐酸 B、乙实验结束后,试管中的废液一定含有 C、最终,废液缸中一定含NaCl、两种溶质 D、最终,废液缸中可能含NaCl、HCl、三种溶质2. 要使如图所示装置中的气球明显鼓起来,则使用的固体和液体可以是( )
①锌和稀硫酸②石灰石和稀盐酸③氧化铁和稀硫酸④氢氧化钠和水
A、① B、①② C、①②④ D、①②③④3. 下列物质暴露在空气中一段时间,溶液质量会因为化学变化而变小的是( )A、浓盐酸 B、石灰水 C、氢氧化钠溶液 D、浓硫酸4. 实验室用石灰石与稀盐酸反应制取二氧化碳,发生装置如图所示,从U形管注入稀盐酸,发现稀盐酸未能与有孔塑料板上的石灰石接触,但此时已无稀盐酸可加,则下列溶液中,最适宜添加的是( ) A、硝酸钠溶液 B、碳酸钠溶液 C、氢氧化钠溶液 D、氢氧化钙溶液5. 下列各组物质的名称、俗称、化学式表示同一物质的是( )A、氢氧化钠,纯碱,NaOH B、氮化钠,食盐,KCl C、氢氧化钙,消石灰,Ca(OH)2 D、碳酸钙,生石灰,CaCO36. “一带一路”是合作发展的理念和倡议,古丝绸之路将我国的发明和技术传送到国外。下列古代生产工艺中主要体现化学变化的是( )A、粮食酿酒 B、纺纱织布 C、在申骨上刻文字 D、用石块修筑长城7. 人们对事物的认识常需经历一个不断修正和完善的过程,如对酸的认识就是如此。下列各项是不同时期对酸的认识,其中与我们现在所学酸的定义最相近的是( )A、有酸味的物质 B、只有氢才是酸不可缺少的元素 C、酸中都含有氧 D、与碱作用时失去原有性质的物质8. 在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明酸过量的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、测得反应后溶液中Na+与Cl-的个数比小于1∶1 C、滴入几滴酚酞试液,酚酞试液不变色 D、滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀9. 下列物质间的转化,在一定条件下均能一步实现的是( )
A、硝酸钠溶液 B、碳酸钠溶液 C、氢氧化钠溶液 D、氢氧化钙溶液5. 下列各组物质的名称、俗称、化学式表示同一物质的是( )A、氢氧化钠,纯碱,NaOH B、氮化钠,食盐,KCl C、氢氧化钙,消石灰,Ca(OH)2 D、碳酸钙,生石灰,CaCO36. “一带一路”是合作发展的理念和倡议,古丝绸之路将我国的发明和技术传送到国外。下列古代生产工艺中主要体现化学变化的是( )A、粮食酿酒 B、纺纱织布 C、在申骨上刻文字 D、用石块修筑长城7. 人们对事物的认识常需经历一个不断修正和完善的过程,如对酸的认识就是如此。下列各项是不同时期对酸的认识,其中与我们现在所学酸的定义最相近的是( )A、有酸味的物质 B、只有氢才是酸不可缺少的元素 C、酸中都含有氧 D、与碱作用时失去原有性质的物质8. 在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明酸过量的是( )A、滴入适量FeCl3溶液,溶液变黄,但无沉淀生成 B、测得反应后溶液中Na+与Cl-的个数比小于1∶1 C、滴入几滴酚酞试液,酚酞试液不变色 D、滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀9. 下列物质间的转化,在一定条件下均能一步实现的是( )①C→CO→CO2 ②Al→Al2O3→AlCl3 ③Na2CO3→NaCl→NaNO3
④CaCO3→CaO→Ca(OH)2
A、①②③ B、①③④ C、①②④ D、①②③④10. 某科学兴趣小组为验证Ag、Fe、Cu三种金属的活动性顺序,设计了如图所示的实验方案。其中可以达到实验目的的组合是( )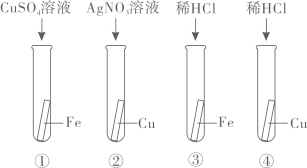 A、①② B、①③ C、②③ D、②④11. 某化学反应的微观示意图如图所示,有关该化学反应的说法正确的是( )
A、①② B、①③ C、②③ D、②④11. 某化学反应的微观示意图如图所示,有关该化学反应的说法正确的是( ) A、该反应是置换反应 B、丙遇到空气中的水会生成硫酸 C、该反应生成的丙、丁分子个数比为1:1 D、化学反应前后元素的种类和化合价都不变12. 化学概念间有包含、并列、交叉等不同关系,下列选项符合如图所示关系的是( )
A、该反应是置换反应 B、丙遇到空气中的水会生成硫酸 C、该反应生成的丙、丁分子个数比为1:1 D、化学反应前后元素的种类和化合价都不变12. 化学概念间有包含、并列、交叉等不同关系,下列选项符合如图所示关系的是( )A
B
C
D
X
化合反应
纯净物
单质
化学反应
Y
氧化反应
混合物
化合物
化合反应
 A、A B、B C、C D、D13. 覆盆子果实中含有丰富的维生素A (C20H30O) 、维生素C等物质。维生素A属于( )A、有机物 B、碱 C、氧化物 D、盐14. 小宁分别将不同质量的锌粉加入一定量的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,以下是在不同情况下对滤渣或滤液成分的说法,错误的是( )A、若滤液中只含一种溶质,滤渣一定含有Ag、Cu,可能含有Zn B、当滤液含两种溶质时,滤渣一定含有Ag,可能含有Cu,一定不含Zn C、若滤渣中有红色固体,滤液一定含有Zn(NO3)2 , 一定不含Cu(NO3)2 D、若向所得滤液中滴加稀盐酸有白色沉淀生成,滤渣一定只含有Ag15. 取1.4g铁粉于烧杯中,加溶质质量分数为10%的AgNO₃溶液100g,充分反应后,再不断缓慢加入锌粉,烧杯中相关量与所加锌的质量的关系图正确的是( )A、
A、A B、B C、C D、D13. 覆盆子果实中含有丰富的维生素A (C20H30O) 、维生素C等物质。维生素A属于( )A、有机物 B、碱 C、氧化物 D、盐14. 小宁分别将不同质量的锌粉加入一定量的Cu(NO3)2和AgNO3混合溶液中,充分反应后过滤,以下是在不同情况下对滤渣或滤液成分的说法,错误的是( )A、若滤液中只含一种溶质,滤渣一定含有Ag、Cu,可能含有Zn B、当滤液含两种溶质时,滤渣一定含有Ag,可能含有Cu,一定不含Zn C、若滤渣中有红色固体,滤液一定含有Zn(NO3)2 , 一定不含Cu(NO3)2 D、若向所得滤液中滴加稀盐酸有白色沉淀生成,滤渣一定只含有Ag15. 取1.4g铁粉于烧杯中,加溶质质量分数为10%的AgNO₃溶液100g,充分反应后,再不断缓慢加入锌粉,烧杯中相关量与所加锌的质量的关系图正确的是( )A、 B、
B、 C、
C、 D、
D、
二、填空题
-
16. 物理变化与化学变化(1)、物理变化:新物质生成的变化;化学变化:新物质生成的变化。(2)、两者的根本区别:。(3)、联系:常伴随着。17. 归纳总结是学习科学的重要方法,小明同学用图甲总结了NaOH的四条化学性质(即NaOH与四类物质能够发生化学变化)。
 (1)、依据反应②说明NaOH必须密封保存,否则在空气中会变质,其化学方程式为。(2)、小明用微观示意图(如图乙)来说明反应③的发生,在反应过程中,没有发生变化的离子是;(3)、为了验证反应④能够发生,你选择的物质是 (填序号)。A、Na2CO3 B、HCl C、CuSO4 D、NaCl18. 中国芯片技术正在蓬勃发展中,氮化镓(GaN)是生产5G芯片的关键材料之一。在氨气流(NH3)中高温加热金属镓(Ga)30分钟可制得疏松的灰色粉末氮化镓。(1)、氮化镓非常稳定,即使是在浓酸或浓碱中也不容易分解,这属于性质(选填“物理”或“化学”)。(2)、制取氮化镓的过程发生了置换反应,该反应的化学方程式为:。19. 北京冬奥会奥运火炬接力迎来了全球首次水下机器人火炬传递,彰显了北京奥运的环保理念和科技力量。
(1)、依据反应②说明NaOH必须密封保存,否则在空气中会变质,其化学方程式为。(2)、小明用微观示意图(如图乙)来说明反应③的发生,在反应过程中,没有发生变化的离子是;(3)、为了验证反应④能够发生,你选择的物质是 (填序号)。A、Na2CO3 B、HCl C、CuSO4 D、NaCl18. 中国芯片技术正在蓬勃发展中,氮化镓(GaN)是生产5G芯片的关键材料之一。在氨气流(NH3)中高温加热金属镓(Ga)30分钟可制得疏松的灰色粉末氮化镓。(1)、氮化镓非常稳定,即使是在浓酸或浓碱中也不容易分解,这属于性质(选填“物理”或“化学”)。(2)、制取氮化镓的过程发生了置换反应,该反应的化学方程式为:。19. 北京冬奥会奥运火炬接力迎来了全球首次水下机器人火炬传递,彰显了北京奥运的环保理念和科技力量。 (1)、奥运火炬“飞扬”采用碳纤维作为外壳材料,实现了“轻、固、美“的特点,为此,专家团队必须解决碳纤维耐高温、耐燃烧的要求,耐燃烧属于碳纤维的性质。(2)、为保证火炬在水中能稳定燃烧,专家团队在火焰的周围设置了“气膜式热防护罩”(用气体压强在火焰外部形成一圈隔离层,使火焰与水隔离),从燃烧条件分析,该防护罩的作用是。20. 某白色固体M可能由Na2CO3、Na2SO4、MgCl2、Ba(OH)2中的一种或几种物质组成。为确定其成分,进行如图所示实验。
(1)、奥运火炬“飞扬”采用碳纤维作为外壳材料,实现了“轻、固、美“的特点,为此,专家团队必须解决碳纤维耐高温、耐燃烧的要求,耐燃烧属于碳纤维的性质。(2)、为保证火炬在水中能稳定燃烧,专家团队在火焰的周围设置了“气膜式热防护罩”(用气体压强在火焰外部形成一圈隔离层,使火焰与水隔离),从燃烧条件分析,该防护罩的作用是。20. 某白色固体M可能由Na2CO3、Na2SO4、MgCl2、Ba(OH)2中的一种或几种物质组成。为确定其成分,进行如图所示实验。
则:
(1)、白色沉淀E的化学式为。(2)、白色固体M的成分是。21. 2022年卡塔尔世界杯,中国元素众多,惊艳了全世界。(1)、“中国承造”的烟花献礼世界杯。烟花源于我国四大发明之一的黑火药,其原理为:2KNO3+S+3C+N2↑+3CO2↑。
(2)、“中国建造”的基础设施中使用了铁等金属材料,金属资源储量有限,钢铁生锈是世界面临的难题。铁生锈的外部条件是与水和同时接触。22. 在一密闭容器内有4种物质A、B、C、D,它们在一定条件下发生化学反应,其中A、B、C的微观示意图和反应前后各物质的质量如下表所示。物质
A
B
C
D

微观示意图



反应前质量/g
100
1
1
46
反应后质量/g
4
89
55
X
(1)、A,B,C中属于氧化物的是(填写字母)。(2)、X的值为。(3)、该反应的生成物是(写物质名称)。(4)、该反应中B和C的分子个数比为。23. 现有一瓶无色无味的气体,回答问题:(1)、如果该气体只有一种元素组成,那么该气体一定不是(填物质类别)。(2)、如果该气体能使澄清石灰水变浑浊,那么该气体与澄清石灰水发生反应的化学方程式是。24. 有一包固体粉末,可能含有氧化钙、氯化钠、碳酸钠、硫酸钠、硫酸铜中的一种或几种。为确定其组成,小金设计出实验方案,实验步骤及现象如下。请回答: (1)、仅根据步骤①可确定该固体粉末中肯定没有的物质是:;(2)、根据实验中的现象,该固体粉末的所有可能组成是:。25. 固体混合物A是由Mg、CuO、Na2SO4、Na2CO3、BaCl2、BaSO4中的几种混合而成为,为确定其成分,进行如图实验.(假设每步反应均恰好完全反应)试推断:
(1)、仅根据步骤①可确定该固体粉末中肯定没有的物质是:;(2)、根据实验中的现象,该固体粉末的所有可能组成是:。25. 固体混合物A是由Mg、CuO、Na2SO4、Na2CO3、BaCl2、BaSO4中的几种混合而成为,为确定其成分,进行如图实验.(假设每步反应均恰好完全反应)试推断: (1)、沉淀C的成分是(2)、固体A的组成有种可能。
(1)、沉淀C的成分是(2)、固体A的组成有种可能。三、实验探究题
-
26. 资料上说“一般不用K、Ca、Na等活泼金属来置换盐溶液中的其他金属元素”。
小金对此进行了思考,并查阅资料,对金属钠和硫酸铜溶液的反应进行探究。实验中发现有无色无味的气体产生,同时有固体物质出现在容器底部。
【查阅资料】钠常温下就能与水发生剧烈反应生成氢氧化钠和气体。
【问题及猜想】 会导致钠和硫酸铜溶液反应的产物不同。
【实验及现象】分别取10mL硫酸铜溶液,然后取5块大小相同的钠投入硫酸铜溶液中,观察现象。
编号
钠块大小
硫酸铜溶液浓度
实验中产生的现象
①
绿豆大小
10%
立即剧烈燃烧,有爆炸声,产生蓝色絮状沉淀,并出现黑色固体。
②
绿豆大小
5%
4-5s后剧烈燃烧,有爆炸声,产生蓝色絮状沉淀,并出现黑色固体。
③
绿豆大小
2%
熔成小球,四处游动,“嘶嘶响声",偶尔有火光,产生蓝色絮状沉淀。
④
绿豆大小
1%
熔成小球,四处游动,“嘶嘶响声",产生蓝绿色沉淀。
⑤
绿豆大小
0.5%
熔成小球,四处游动,“嘶嘶响声”,产生蓝绿色沉淀。
(1)、请将【问题及猜想】补充完整。(2)、小金觉得气体可能是①氧气 ②甲烷 ③氢气,从物质组成角度,你觉得哪个不可能,请说说理由。。(3)、上述实验中均未观察到色固体生成,由此判断不能置换出铜。(4)、实验①②中小金观察到钠块不会游动,当他想到实验室制取二氧化碳不能用稀硫酸和大理石反应时,便有了解释。他的解释是。27. 某校同学开展了如图所示“溶液酸碱性的检验”的实验活动: (1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:
(1)、把自制的紫色紫薯汁按图1所示分别滴加到试管中,观察到的现象如表所示:溶液
白醋
盐酸
食盐水
草木灰水
石灰水
加入紫薯汁后的颜色
红色
红色
紫色
绿色
绿色
①图1中放置试管的仪器名称是。
②由表可知,紫薯汁能做酸碱指示剂,遇到稀硫酸溶液显示的颜色是。
(2)、图2是三位同学分别测定某溶液酸碱度的操作示意图,可能导致被测溶液的pH数值发生改变的错误操作是(填“A”、“B”或“C”)。28. 有许多化学反应没有明显的现象产生,比如氢氧化钙与稀盐酸的反应就是如此,如何证明两者发生了化学反应呢?某兴趣小组同学开展如下探究:【分析讨论】同学们认为,如果氢氧化钙和盐酸减少(或消失),或者有新物质生成,都能证明反应已经发生。
【查阅资料】氯化钙溶液呈中性。
【实验方案】
方案
实验操作
实验现象
实验结论
方案一
小明取少量氢氧化钙溶液于试管中,先滴入2滴无色酚酞溶液,再加入稀盐酸
反应物消失,二者发生了反应
方案二
小嘉向氢氧化钙与稀盐酸反应后的溶液中加入适量硝酸银溶液
产生白色沉淀
有新物质生成,二者发生了反应
【评价交流】小明认为小嘉的结论不正确,理由是。
【总结归纳】对于无明显现象的反应,我们可以分析比较反应物和生成物的性质,从多个角度设计实验进行证明。
【拓展延伸】将少量二氧化碳通入氢氧化钠溶液中也无明显现象,请你设计一个实验方案证明两者发生了反应。(写出操作方法和现象)。
四、解答题
-
29. 化肥对提高农作物的产量具有重要作用,尿素【CO(NH2)2】为最常见的化肥之一。
 (1)、尿素属于 (填标号)。A、氮肥 B、磷肥 C、钾肥 D、复合肥(2)、尿素中氮元素的质量分数是%(结果保留到小数点后一位)。(3)、工业上生产尿素的反应为。若生产120t尿素,理论上需要氨气的质量是多少?(写出计算过程)30. 实验室用金属镁与100g盐酸反应探究酸的性质。小海取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。求:
(1)、尿素属于 (填标号)。A、氮肥 B、磷肥 C、钾肥 D、复合肥(2)、尿素中氮元素的质量分数是%(结果保留到小数点后一位)。(3)、工业上生产尿素的反应为。若生产120t尿素,理论上需要氨气的质量是多少?(写出计算过程)30. 实验室用金属镁与100g盐酸反应探究酸的性质。小海取反应后的溶液,逐渐加入溶质质量分数为8%的NaOH溶液,产生沉淀质量与滴加溶液的质量关系如图所示。已知当NaOH溶液滴加至150g时不再有沉淀产生。求: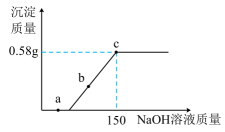 (1)、0.58g沉淀的成分为;(2)、a点时,与NaOH反应的物质化学式;(3)、若在b点溶液中加AgNO3溶液,出现白色沉淀(填“能”“不能”)证明HCl有剩余;(4)、计算100g稀盐酸的溶质质量分数。(写出计算过程)31. 为测定某镁矿石中镁元素的质量分数,兴趣小组的同学取了5g该镁矿石粉末,加入过量的稀硫酸,充分反应后过滤、除杂,得到只含有MgSO4和H2SO4两种溶质的混合溶液100g,将该100g混合溶液放于烧杯中,然后取40g氢氧化钠溶液,分4次加入到盛有100g混合溶液的烧杯中,充分反应,测得的实验数据如下表所示:
(1)、0.58g沉淀的成分为;(2)、a点时,与NaOH反应的物质化学式;(3)、若在b点溶液中加AgNO3溶液,出现白色沉淀(填“能”“不能”)证明HCl有剩余;(4)、计算100g稀盐酸的溶质质量分数。(写出计算过程)31. 为测定某镁矿石中镁元素的质量分数,兴趣小组的同学取了5g该镁矿石粉末,加入过量的稀硫酸,充分反应后过滤、除杂,得到只含有MgSO4和H2SO4两种溶质的混合溶液100g,将该100g混合溶液放于烧杯中,然后取40g氢氧化钠溶液,分4次加入到盛有100g混合溶液的烧杯中,充分反应,测得的实验数据如下表所示:实验编号
第一次
第二次
第三次
第四次
加入氢氧化钠溶液质量/g
10
10
10
10
烧杯中生成沉淀的总质量/g
0.464
1.044
1.160
1.160
请计算:
(1)、100g混合液中硫酸镁的质量。(2)、该镁矿石中镁元素的质量分数。(假设5g镁矿石中的镁元素全部转化为100g混合溶液中MgSO4中的镁元素)(3)、加入的氢氧化钠溶液的溶质质量分数。32. 现有10克锌和8克氧化铜和足量的稀硫酸,有同学想用这些锌和氧化铜为原料来制取铜单质时并采用了如下所示的流程图:ZnH2Cu
(1)、实验时应该(选填“一次性足量”、“小流量连续缓慢”、“没有冒出气泡后再”)把稀硫酸加入锥形瓶中。(2)、按照规范操作要求完成实验,氧化铜被完全反应,请以加入的Zn为横坐标,以生成的Cu为纵坐标,画出关系图,标出图中的转折点大致位置,并说明理由。 33. 普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如图:
33. 普通黄铜仅由铜和锌组成,广泛用于制造板材、管材等,也用于铸造机械零件。现有一块50.00g黄铜样品,某同学利用一种未知浓度的稀盐酸来测定样品中Cu的质量分数。有关数据如图: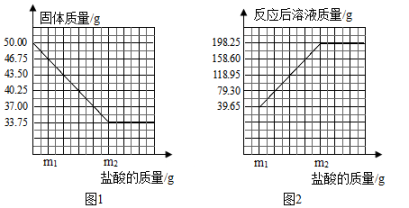
求:
(1)、黄铜中Cu的质量分数。(2)、样品完全反应产生的H2的质量。(3)、稀盐酸的溶质质量分数。34. 钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。某品牌补钙药剂主要含酸酸钙,为了测定该品牌补钙药剂中CaCO3的质量分数,取该补钙剂制成的粉末20g,逐滴滴入稀盐酸(补钙剂中其他成分不与盐酸反应),得到数据如图所示,请根据有关信息回答问题: (1)、该补钙剂刚好完全反应时产生气体的质量为。(2)、该品牌补钙药剂中CaCO3的质量分数是。(3)、求该盐酸中溶质的质量分数。(写出计算过程)
(1)、该补钙剂刚好完全反应时产生气体的质量为。(2)、该品牌补钙药剂中CaCO3的质量分数是。(3)、求该盐酸中溶质的质量分数。(写出计算过程)

