福建省福州市长乐区2023年中考化学适应性试卷
试卷更新日期:2023-10-23 类型:中考模拟
一、单选题(本大题共10小题,共30.0分)
-
1. 下列生活用品中,其材料属于有机合成材料的是( )A、铁锅 B、塑料桶 C、羊毛杉 D、普通玻璃2. 从不同的角度进行分类是学习元素化合物知识的重要方法。与熟石灰混合研磨会产生刺激性气味气体,以此分类,下列与不属于同类物质的是( )A、 B、 C、 D、3. 在制取氢气( )的实验中,下列操作正确的是( )A、检查气密性
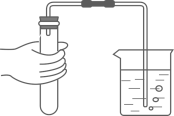 B、加入锌粒
B、加入锌粒 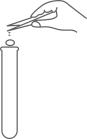 C、加入稀硫酸
C、加入稀硫酸  D、收集氢气
D、收集氢气  4. 劳动赋能。下列解释错误的是( )A、用洗洁精洗去碗筷表面的油污洗洁精对油污有乳化作用 B、将鸡蛋保存在冰箱中可延长鸡蛋保质期降低温度使缓慢氧化速率变慢 C、野炊时将木块劈成小木片燃烧得更旺增大了可燃物与氧气的接触面积 D、种花草时用草木灰作肥料草木灰中含有属于复合肥5. 剧烈运动大量出汗后,补充一杯淡盐水,主要补充的营养素是( )A、糖类 B、无机盐 C、维生素 D、蛋白质6. 年月日,中国成功发射神舟十三号飞船,将三名航天员送上太空。神舟火箭第三级的推进剂为液氢和液氧组合,下列说法正确的是( )A、氢气液化过程中,氢分子之间的间隔保持不变 B、分离液态空气得到液氧的过程中,氧分子静止不动 C、液氧变成气态氧时,放出热量 D、氢气与氧气反应的本质是氢、氧原子的重新组合7. NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是( )
4. 劳动赋能。下列解释错误的是( )A、用洗洁精洗去碗筷表面的油污洗洁精对油污有乳化作用 B、将鸡蛋保存在冰箱中可延长鸡蛋保质期降低温度使缓慢氧化速率变慢 C、野炊时将木块劈成小木片燃烧得更旺增大了可燃物与氧气的接触面积 D、种花草时用草木灰作肥料草木灰中含有属于复合肥5. 剧烈运动大量出汗后,补充一杯淡盐水,主要补充的营养素是( )A、糖类 B、无机盐 C、维生素 D、蛋白质6. 年月日,中国成功发射神舟十三号飞船,将三名航天员送上太空。神舟火箭第三级的推进剂为液氢和液氧组合,下列说法正确的是( )A、氢气液化过程中,氢分子之间的间隔保持不变 B、分离液态空气得到液氧的过程中,氧分子静止不动 C、液氧变成气态氧时,放出热量 D、氢气与氧气反应的本质是氢、氧原子的重新组合7. NaCl和KNO3在不同温度时的溶解度如下表。下列说法错误的是( )温度/℃
0
20
40
60
NaCl的溶解度/g
35.7
36.0
36.6
37.3
KNO3的溶解度/g
13.3
31.6
63.9
110
A、20℃时,100gH2O最多能溶解36.0gNaCl B、40℃时,KNO3饱和溶液的溶质质量分数小于63.9% C、可用冷却海水的方法获取大量食盐 D、其他条件不变,升温可将KNO3饱和溶液变为不饱和溶液8. 大蒜素(C6H10S2O)能抑制和杀灭多种细菌。下列有关大蒜素的说法,错误的是( )A、氢元素的质量分数最大 B、由4种元素组成 C、一个分子由19个原子构成 D、属于有机化合物9. 下列实验方案能达到目的的是 ( )实验目的
实验方案
鉴别氢气和甲烷气体
点燃,在火焰上方罩内壁涂石灰水的烧杯
检验露置于空气中是否变质
取样溶于水,滴入无色酚酞试液
验证、、的活动性
将铜丝分别插入和溶液
提纯粗盐
溶解、蒸发
A、 B、 C、 D、10. 某兴趣小组为探究影响化学反应速度的因素,使用等量的同种钙片和白醋开展四组实验,分别测得产生的二氧化碳浓度随时间变化曲线如图所示。选取的浓度从为研究对象,下列实验结果的分析,错误的是( )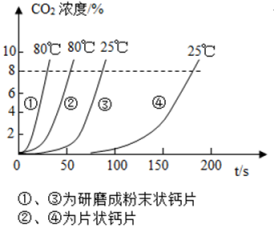 A、对比 , 温度越高,反应速率越快 B、对比 , 反应物接触面积越小,反应速率越慢 C、对比 , 反应物接触面积越大,反应速率越快 D、对比 , 的反应速率最慢
A、对比 , 温度越高,反应速率越快 B、对比 , 反应物接触面积越小,反应速率越慢 C、对比 , 反应物接触面积越大,反应速率越快 D、对比 , 的反应速率最慢二、填空题(本大题共4小题,共34.0分)
-
11. 碘是人体内必不可少的微量元素。
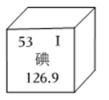 (1)、如图是碘元素周期表部分信息。碘元素的相对原子质量为 ,碘原子的核外电子数为 。(2)、海带、紫菜、和海鲜等食物中含有丰富的碘,这里的碘指的是 填“原子”或“元素”。(3)、不同地区的居民合理使用加碘盐。
(1)、如图是碘元素周期表部分信息。碘元素的相对原子质量为 ,碘原子的核外电子数为 。(2)、海带、紫菜、和海鲜等食物中含有丰富的碘,这里的碘指的是 填“原子”或“元素”。(3)、不同地区的居民合理使用加碘盐。人体缺碘,易造成的健康问题是 填“贫血”或“大脖子病”。
加碘盐是往食盐中加入碘的化合物,如碘酸钾。中碘元素的化合价为 ;鉴别加碘盐时常涉及反应: , 则为 。
12. 为解决能源危机和全球变暖,我国学者研究出一种新型催化剂,实现如图所示的转化。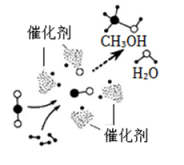 (1)、此转化的实现可缓解的环境问题是 。(2)、该转化过程中,除催化剂外,没有发生变化的微粒共有 种;参照图中微粒的表示方法,画出氢原子与氧原子结合成水分子的微观示意图 。(3)、甲醇中碳元素的质量分数为 。写出该转化的化学方程式 。13. 水是宝贵的自然资源,加强水新源保护刻不容缓。(1)、水的组成,电解水实验。
(1)、此转化的实现可缓解的环境问题是 。(2)、该转化过程中,除催化剂外,没有发生变化的微粒共有 种;参照图中微粒的表示方法,画出氢原子与氧原子结合成水分子的微观示意图 。(3)、甲醇中碳元素的质量分数为 。写出该转化的化学方程式 。13. 水是宝贵的自然资源,加强水新源保护刻不容缓。(1)、水的组成,电解水实验。电解水实验能得出水是由氢元素和氧元素组成的实验事实是 。
写出电解水的化学方程式 。
(2)、水溶液。要配制溶质质量分数为的食盐水用于浸种,需称取食盐固体的质量为 。(3)、水的净化。自来水生产过程中,加入明矾降低水的浑浊度的过程化学上称为 ,用活性炭给自来水除臭脱色是利用了活性炭的 性。14. 利用废铁屑主要含和与稀硫酸反应制备绿矾。兴趣小组往废铁屑中加入一定量的稀硫酸后观察记录如下:时间
现象
溶液逐渐变黄色
有气泡产生
溶液逐渐变成浅绿色
(1)、兴趣小组为缩短实验时间,可采取的措施有 写一条,合理即可。(2)、内,发生的化学反应类型为 填基本反应类型。(3)、产生气泡反应的化学方程式为 。(4)、 , 铁与溶液中的硫酸铁发生“归中”反应同种元素的高价与低价转化为中间价 , 只生成一种硫酸盐,该反应的化学方程式为 。三、推断题(本大题共1小题,共9.0分)
-
15. 以某矿山酸性废水主要含硫酸、硫酸铁、硫酸铜和硫酸锌等为原料,通过下述流程可将废水中的铁、铜和锌分步沉淀,实现回收利用。
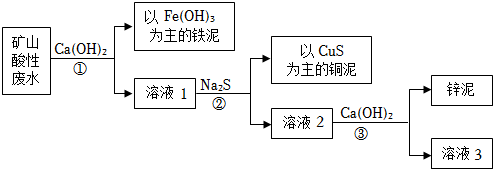 (1)、步骤中,加入的作用之一是中和废水中的硫酸,该反应的化学方程式为 。(2)、反应中加入的或等可溶性的硫化物均可以达到除去铜离子的目的,选择可溶性硫化物的理由是 。分离铜泥和溶液的方法为 。(3)、步骤中锌泥的主要成分的化学式为 。
(1)、步骤中,加入的作用之一是中和废水中的硫酸,该反应的化学方程式为 。(2)、反应中加入的或等可溶性的硫化物均可以达到除去铜离子的目的,选择可溶性硫化物的理由是 。分离铜泥和溶液的方法为 。(3)、步骤中锌泥的主要成分的化学式为 。四、实验题(本大题共1小题,共9.0分)
-
16. 兴趣小组准备了下列仪器进行气体制备和性质实验。
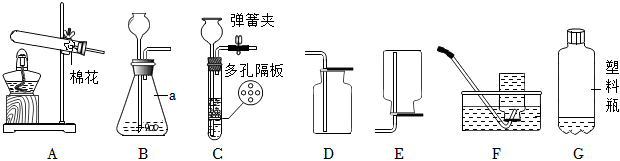 (1)、仪器的名称为 。(2)、若采用加热高锰酸钾的方法制取的氧气,反应的化学方程式为 ,若用装置收集氧气,则检验氧气已收集满的具体操作 。(3)、用装置制取二氧化碳气体,可以通过开关阀门来控制反应的发生与停止,将固体药品置于多孔隔板上,选择的固体药品适合用 填“块状”或“粉末状”;反应的化学方程式为 。(4)、用塑料瓶收集二氧化碳气体,加入氢氧化钠溶液后塑料瓶变瘪, 填“能”或“不能”说明二氧化碳与氢氧化钠发生了化学反应,理由是 。(5)、实验室常用无水醋酸钠与氢氧化钠共热制取甲烷气体,选择的气体发生装置为 填装置标号 , 理由是 。
(1)、仪器的名称为 。(2)、若采用加热高锰酸钾的方法制取的氧气,反应的化学方程式为 ,若用装置收集氧气,则检验氧气已收集满的具体操作 。(3)、用装置制取二氧化碳气体,可以通过开关阀门来控制反应的发生与停止,将固体药品置于多孔隔板上,选择的固体药品适合用 填“块状”或“粉末状”;反应的化学方程式为 。(4)、用塑料瓶收集二氧化碳气体,加入氢氧化钠溶液后塑料瓶变瘪, 填“能”或“不能”说明二氧化碳与氢氧化钠发生了化学反应,理由是 。(5)、实验室常用无水醋酸钠与氢氧化钠共热制取甲烷气体,选择的气体发生装置为 填装置标号 , 理由是 。五、探究题(本大题共1小题,共9.0分)
-
17. 市售的“自热米饭”带有一个发热包,遇水后可迅速升温至 , 保温时间达小时,能将生米做成熟饭。某中学化学兴趣小组对发热包非常感兴趣,进行了以下探究。
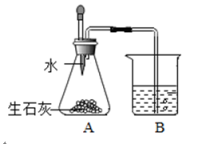
【查阅资料】发热包主要由生石灰、铁粉、活性炭、食盐等组成。
【成分探究】取出某品牌的发热包内的固体粉末。
(1)、小吴用磁铁靠近粉末,发现有黑色物质被磁铁吸引,证明粉末中含有 填物质名称。(2)、【原理探究】小吴利用如图装置证明发热包放热主要来自生石灰与水的反应。加水后观察到烧杯中 的现象时,证明生石灰与水的反应是放热反应。
(3)、请写出生石灰和水反应的化学方程式: ;但温度很快下降,说明该反应很快结束,不能长时间保温。(4)、【猜想】大家大胆猜测应该还有其他放热反应存在,从而达到保温的效果。
【查阅资料】活性炭能加快铁粉生锈的速率;食盐能加快铁粉生锈的速率。 【实验】表中是铁粉、水与不同量活性炭、食盐均匀混合后,在分钟内温度上升的实验记录。
【解释与结论】实验编号 活性炭 食盐 温度上升值 铁生锈的过程,实际上是铁与空气中的 等物质发生化学反应。
(5)、表中的值为 。(6)、综合以上数据,第 填实验编号组实验方案效果最好。该组实验中,铁粉、活性炭、食盐的质量配比为 填最简整数比。(7)、【反思与评价】自热米饭发热包利用的能量转化方式是 能转化为热能。
六、计算题(本大题共1小题,共9.0分)
-
18. 炼铁厂用某种赤铁矿石来炼铁。该赤铁矿石中的含量为杂质中不含铁 , 若该厂天要冶炼出含铁量为的生铁,理论上需要消耗铁矿石的质量为?通过化学方程式简单计算,计算结果精确到
-
-
-