福建省福州市鼓楼区2023年中考模拟化学试题(6月)
试卷更新日期:2023-10-23 类型:中考模拟
一、包含10题,每题只有一个选项符合题目要求。每题3分,共30分。
-
1. “上善若水,水善利万物而不争”,下列关于水的说法不正确的是( )A、我国人均淡水资源匮乏 B、天然水经过沉降、过滤、吸附、杀菌消毒等净化过程变成自来水 C、工业上可采用蒸馏法从海水中获取淡水 D、化肥、农药的大量施用不会造成水体污染2. 下列物质的用途主要由化学性质决定的是( )A、铝用于制作铝箔 B、液氮制造低温环境 C、赤铁矿用于炼铁 D、稀有气体作电光源3. 部分超导材料中含有亿元素。如图是元素的相关信息,下列关于的说法正确的是( )
 A、中子数为39 B、属于非金属元素39 C、元素符号为Y D、相对原子质量是88.91g4. 下列实验操作正确的是( )A、检查装置气密性
A、中子数为39 B、属于非金属元素39 C、元素符号为Y D、相对原子质量是88.91g4. 下列实验操作正确的是( )A、检查装置气密性 B、倾倒液体
B、倾倒液体 C、过滤
C、过滤 D、干燥氧气
D、干燥氧气 5. 扑热息痛是一种家庭常备药物,具有解热镇痛的功效。其主要成分的化学式为 , 下列有关该物质的说法中错误的是( )A、该物质属于有机物 B、由碳、氢、氧、氮四种元素组成 C、氮元素和氧元素的质量比为7:16 D、中有1个氧分子6. 汽车开动和人的生命活动都需要能量,能量是各种运动的量度。给汽车开动和人的生命活动提供能量的两个过程如图所示,下列分析错误的是( )
5. 扑热息痛是一种家庭常备药物,具有解热镇痛的功效。其主要成分的化学式为 , 下列有关该物质的说法中错误的是( )A、该物质属于有机物 B、由碳、氢、氧、氮四种元素组成 C、氮元素和氧元素的质量比为7:16 D、中有1个氧分子6. 汽车开动和人的生命活动都需要能量,能量是各种运动的量度。给汽车开动和人的生命活动提供能量的两个过程如图所示,下列分析错误的是( )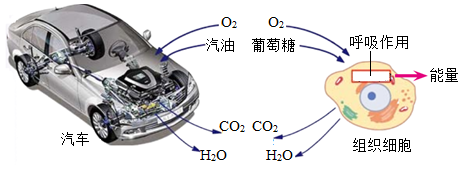 A、都通过剧烈的氧化反应释放出能量 B、都将化学能转化为其他形式的能 C、都参与自然界的碳循环和氧循环 D、都遵循能量的转化和守恒定律7. 如表为某加碘食盐包装袋上的部分内容,根据信息,下列判断正确的是( )
A、都通过剧烈的氧化反应释放出能量 B、都将化学能转化为其他形式的能 C、都参与自然界的碳循环和氧循环 D、都遵循能量的转化和守恒定律7. 如表为某加碘食盐包装袋上的部分内容,根据信息,下列判断正确的是( ) A、该食盐是纯净物 B、加碘食盐中的碘是指碘单质 C、碘酸钾受热不稳定 D、1kg食盐中含碘酸钾(35士15)mg8. 为达到下列实验目的,相应的实验操作合理的是( )
A、该食盐是纯净物 B、加碘食盐中的碘是指碘单质 C、碘酸钾受热不稳定 D、1kg食盐中含碘酸钾(35士15)mg8. 为达到下列实验目的,相应的实验操作合理的是( )选项
实验目的
实验操作
A
除去Fe中少量Fe2O3杂质
加入足量稀硫酸,过滤
B
检验氢氧化钠是否变质
取样,向其中滴加少量稀盐酸
C
检验某固体为碳酸盐
取样,滴加盐酸,将生成的气体通入澄清石灰水
D
配制48g质量分数为6%的NaCl溶液
用托盘天平称量2.88gNaCl倒入烧杯中,用量筒量取所需水于烧杯中,用玻璃棒搅拌
A、A B、B C、C D、D9. 如图为MgSO4和KCl的溶解度曲线。下列说法正确的是( ) A、T1℃时,MgSO4溶液和KCl溶液的溶质质量分数相等 B、T2℃时,分别向100g水中加入等质量(m)的MgSO4和KCl,搅拌后无固体剩余,则m应满足0<m≤46.4g C、将KCl饱和溶液从T2℃升温到T4℃,溶质质量分数先变大后变小,最终与原来相同 D、等质量的两物质饱和溶液从T4℃降温到T3℃,剩余溶液中水的量:MgSO4溶液<KCl溶液10. 硫化氢的转化是资源利用和环境保护的重要研究课题。一种 ③处理H2S并回收S的工艺如图所示。下列说法不正确的是( )
A、T1℃时,MgSO4溶液和KCl溶液的溶质质量分数相等 B、T2℃时,分别向100g水中加入等质量(m)的MgSO4和KCl,搅拌后无固体剩余,则m应满足0<m≤46.4g C、将KCl饱和溶液从T2℃升温到T4℃,溶质质量分数先变大后变小,最终与原来相同 D、等质量的两物质饱和溶液从T4℃降温到T3℃,剩余溶液中水的量:MgSO4溶液<KCl溶液10. 硫化氢的转化是资源利用和环境保护的重要研究课题。一种 ③处理H2S并回收S的工艺如图所示。下列说法不正确的是( ) A、过程①中,发生的是复分解反应 B、过程②中,硫元素的化合价降低 C、过程③中,O2的量必需保证足量 D、回收S的总反应为
A、过程①中,发生的是复分解反应 B、过程②中,硫元素的化合价降低 C、过程③中,O2的量必需保证足量 D、回收S的总反应为二、非选择题(共70分)
-
11. 生活离不开化学。
 (1)、甲图中的材料属于复合材料的是 , 属于有机合成材料。(2)、乙图是钛的原子结构示意图,则x=;钛元素位于元素周期表第周期。(3)、C919大飞机上使用的氧气发生器以氯酸钠为产氧剂,氯酸钠)中氯元素的化合价为。(4)、制造飞机使用铝合金,铝具有很好的抗腐蚀性的原因是(用化学方程式表示)。(5)、环境的消毒一般用“84消毒液”。要配制1000g有效氯含量为0.03%的“84消毒液”稀溶液用于桌椅消毒,需要有效氯含量为5%的“84消毒液”的质量是。12. 我国提出力争在2026年前实现“碳中和。”(1)、大气中二氧化碳含量不断升高,会导致加剧。(2)、化学固碳:以CO2和NH3为原料生产尿素[CO(NH2)2)是实现“碳中和”范例之一,其中合成的尿素在农业生产中常用作肥。(3)、中国科学家独创了一种二氧化碳转换新途径。其中第1、2步利用二氧化碳、水为原料制得乙酸,第3步是将乙酸发酵转化为葡萄糖和脂肪酸,这为人工和半人工合成“粮食作物”给予了新途径。其中第1、2步的微观示意图如下:
(1)、甲图中的材料属于复合材料的是 , 属于有机合成材料。(2)、乙图是钛的原子结构示意图,则x=;钛元素位于元素周期表第周期。(3)、C919大飞机上使用的氧气发生器以氯酸钠为产氧剂,氯酸钠)中氯元素的化合价为。(4)、制造飞机使用铝合金,铝具有很好的抗腐蚀性的原因是(用化学方程式表示)。(5)、环境的消毒一般用“84消毒液”。要配制1000g有效氯含量为0.03%的“84消毒液”稀溶液用于桌椅消毒,需要有效氯含量为5%的“84消毒液”的质量是。12. 我国提出力争在2026年前实现“碳中和。”(1)、大气中二氧化碳含量不断升高,会导致加剧。(2)、化学固碳:以CO2和NH3为原料生产尿素[CO(NH2)2)是实现“碳中和”范例之一,其中合成的尿素在农业生产中常用作肥。(3)、中国科学家独创了一种二氧化碳转换新途径。其中第1、2步利用二氧化碳、水为原料制得乙酸,第3步是将乙酸发酵转化为葡萄糖和脂肪酸,这为人工和半人工合成“粮食作物”给予了新途径。其中第1、2步的微观示意图如下:
①第1步的化学方程式为 , 属于(填基本反应类型)。
②第2步合成乙酸的化学方程式为 , X的化学式为。
③3kg乙酸(CH3COOH)中,含有碳元素的质量为。
13. 化学兴趣小组的同学在电子图书馆检索古籍,发现我国优秀传统文化蕴含着丰富的科学原理。(1)、《使至塞上》中“大漠孤烟直,长河落日圆”与《江南春》中“南朝四百八十寺,多少楼台烟雨中”,两处的“烟”的成分(填“相同”或“不同”)(2)、王安石《梅花》中有“遥知不是雪,为有暗香来”,从微观角度解释诗人在远处就能闻到梅花香味的原因:。(3)、《尚书》记载“若作酒醴,尔惟曲¶”。作酒醴即酿酒,以高粱、大麦等粮食为原料。原料中主要含有的营养素是 , 经蒸熟、发酵可得到酒精。酒精容易被空气中的氯气氧化为醋酸(CH3COOH),家庭中可用醋酸除水垢[主要成分为CaCO3和Mg(OH)2],请写出除水垢时发生的中和反应的化学方程式(提示:若金属元素H化合价为+1,醋酸盐书写形式为CH3COOM)。
(4)、“若作和羹,尔惟盐梅”说明在商周时期就重视调味,从海水中提取食盐主要采取蒸发结晶的原因是。14. 氢气被看作是理想的能源。氢气的制取和储存是氢能源利用领域的研究热点。(1)、电解水可以制取氢气,电解水的装置如图1所示,图中a管内的气体是(填名称),若a管内气体体积是10mL,则b管内气体体积是mL。(2)、 用电解水的方法制取氢气成本太高,科学家正致力于研究在催化剂和光照条件下分解水制氢气。写出该反应的化学方程式 , 反应中催化剂的质量和没有改变。(3)、水热分解可得氢气,高温下水分解体系中微粒含量与温度的关系如图2所示,当温度低于2000℃时,体系内微粒含量没有改变的原因是 , 已知图中曲线A、B对应的微粒是原子,写出微粒A的化学符号。(4)、氢能源汽车相比燃油汽车的突出优点是。 15. 二氧化硫(TeO2)是一种性能优良的声光晶体材料。用某工业废渣(主要含有TeO2 , 还有少量Cu、Ag)为原料可制备纯净的TeO2 , 其流程如下:
15. 二氧化硫(TeO2)是一种性能优良的声光晶体材料。用某工业废渣(主要含有TeO2 , 还有少量Cu、Ag)为原料可制备纯净的TeO2 , 其流程如下: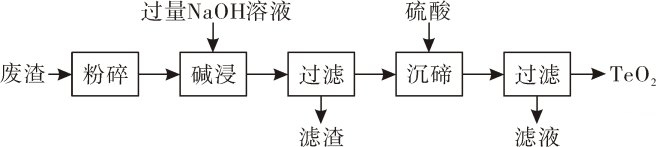
已知:TeO2微溶于水,能与NaOH溶液发生反应
(1)、将废渣粉碎的目的是。(2)、类比CO2与NaOH溶液的反应,写出“碱浸”时的化学方程式。(3)、“碱浸”后过滤,此时滤渣的成分为(填化学式)。(4)、“沉碲 ”时,加入硫酸的作用是。(5)、“过滤”得到的TeO2 , 还需用蒸馏水洗涤2~3次,取最后一次洗涤液,测得其pH=说明已经洗涤干净。16. 实验室利用如图所示的装置进行实验。(1)、实验室欲用H2O2溶液制备氧气,并进行铁丝在氧气里燃烧的实验。回答下列问题:
①若用溶质质量分数为30%的H2O2溶液和MnO2制备氧气,反应速率太快。为获得平稳的气流,图1中最合适的是(填标号)。②已知:用H2O2制取氧气时,也可用铂丝代替MnO2作催化剂。如图2中甲装置所示,若制备过程中体系内压强过大,则安全管中的现象是 , 此时应(填操作),使反应停止。
③用图2中乙装置进行铁丝在氧气里燃烧的实验,可观察到的现象是 , 实验时集气瓶炸裂,可能的原因是。
(2)、某同学利用塑料瓶和其他用品,设计了制取二氧化碳的装置,如图所示。塑料颖实验室制备二氧化碳的化学反应方程式为 , 其中铜丝网中装的药品是。 17. 兴趣小组探究金属的性质,做了如下实验。(1)、
17. 兴趣小组探究金属的性质,做了如下实验。(1)、【实验一:探究锌、铁、银三种金属的活动性】
步骤①在试管中取少量盐酸,插入铁丝,充分作用;
步骤②在①所得的溶液中,插入银丝,充分作用;
步骤③在②所得的溶液中插入锌丝,充分作用。
写出步骤③的化学方程式:。 (2)、小鹏认为方案中补充一个实验,就可得出Zn>Fe>H>Ag的结论。补充的实验是。(3)、小晗认为要得到Zn>Fe>H>Ag的结论,不必做补充实验,只需调整实验步骤即可,你认为调整插入金属的顺序是。(4)、【实验二:探究铁生锈的条件】
(2)、小鹏认为方案中补充一个实验,就可得出Zn>Fe>H>Ag的结论。补充的实验是。(3)、小晗认为要得到Zn>Fe>H>Ag的结论,不必做补充实验,只需调整实验步骤即可,你认为调整插入金属的顺序是。(4)、【实验二:探究铁生锈的条件】
检查装置的气密性:打开弹簧夹,(填操作和现象),则装置气密性良好。(5)、实验I中铁丝生锈,铁丝和反应时间足够,当打开止水夹时,还能观察到的现象是:。(6)、对比实验(填序号),可以得出铁生锈需要氧气。(7)、【拓展与延伸1】某小组同学利用手持数据采集器,测定铁钉与不同溶液(浓度相等)接触生锈气浓度的变化,装置及数据如图:
实验所用三种溶液中,铁钉接触到溶液(填化学式)更容易生锈。(8)、根据三条曲线都是“先陡后缓”的现象。关于铁生锈快慢的问题,你能得出的结论是:。(9)、能否用铜粉与实验I的装置测定空气中氧气的含量?(填“能”或“不能”)你判断的理由是。18. 乙炔(C2H2)可用于金属焊接或切割,常用电石(主要成分CaC2)和水反应制取,反应的学方程式为:↑。请计算:80kg电石(其中CaC2的质量分数为80%)与水全反应,可制得乙炔的质量是多少?