江苏省苏州市高新重点中学2023年中考化学二模试卷
试卷更新日期:2023-10-23 类型:中考模拟
一、选择题
-
1. 年月日是第个“世界地球日”,主题为“珍爱地球,人与自然和谐共生”。下列做法不利于人与自然和谐共生的是( )A、工业废水任意排放 B、研制开发清洁能源 C、积极践行绿色出行 D、合理使用农药化肥2. 下列生活中的物品,由合成材料制成的是( )A、钢筋混凝土 B、大理石板材 C、铝合金门窗 D、食品保鲜膜3. 石膏的主要成分是CaSO4从物质类别来看,CaSO4属于A、酸 B、碱 C、盐 D、氧化物4. 下列物质由分子构成的是( )A、铝 B、干冰 C、氯化钠 D、金刚石5. 下列图标适合张贴在加油站的是( )A、
 B、
B、 C、
C、 D、
D、 6. 铜元素在元素周期表中的信息如图。下列有关铜元素的说法不正确的是( )
6. 铜元素在元素周期表中的信息如图。下列有关铜元素的说法不正确的是( ) A、元素符号是Cu B、质子数是29 C、相对原子质量63.55 g D、属于金属元素7. 下列铜制品主要利用其化学性质的是( )A、导线
A、元素符号是Cu B、质子数是29 C、相对原子质量63.55 g D、属于金属元素7. 下列铜制品主要利用其化学性质的是( )A、导线 B、火锅
B、火锅 C、耐酸阀门
C、耐酸阀门 D、乐器
D、乐器 8. BTTAA(C19H30N10O2)是铜基催化剂的重要组成物质,下列关于BTTAA说法不正确的是( )A、由4种元素组成 B、由61个原子构成 C、氢、氧元素质量比为15:16 D、氮元素的质量分数计算式为9. 下列关于水的说法正确的是( )A、电解水一段时间后,水分子的数目减少 B、明矾可降低硬水中可溶性钙、镁化合物的含量 C、自来水是纯净物 D、可用尝味道的方法区分蒸馏水和氯化钡溶液10. 下列项目所涉化学知识不正确的是( )A、用含小苏打的发酵粉焙制糕点,是因为受热易分解产生二氧化碳气体 B、鉴别蚕丝制品与合成纤维,可以通过灼烧闻气味的方法 C、在粗盐提纯实验中,溶解粗盐加水不易过多,防止结晶步骤能耗过多 D、铝片放入硫酸铜溶液中,表面产生气泡经检验是氢气 , 说明硫酸铜溶液显酸性11. 我国载人航天器中处理二氧化碳的一种方法是将二氧化碳与氢气反应。如图为该反应前后的微观示意图未配平。下列说法正确的是 ( )
8. BTTAA(C19H30N10O2)是铜基催化剂的重要组成物质,下列关于BTTAA说法不正确的是( )A、由4种元素组成 B、由61个原子构成 C、氢、氧元素质量比为15:16 D、氮元素的质量分数计算式为9. 下列关于水的说法正确的是( )A、电解水一段时间后,水分子的数目减少 B、明矾可降低硬水中可溶性钙、镁化合物的含量 C、自来水是纯净物 D、可用尝味道的方法区分蒸馏水和氯化钡溶液10. 下列项目所涉化学知识不正确的是( )A、用含小苏打的发酵粉焙制糕点,是因为受热易分解产生二氧化碳气体 B、鉴别蚕丝制品与合成纤维,可以通过灼烧闻气味的方法 C、在粗盐提纯实验中,溶解粗盐加水不易过多,防止结晶步骤能耗过多 D、铝片放入硫酸铜溶液中,表面产生气泡经检验是氢气 , 说明硫酸铜溶液显酸性11. 我国载人航天器中处理二氧化碳的一种方法是将二氧化碳与氢气反应。如图为该反应前后的微观示意图未配平。下列说法正确的是 ( ) A、质量分析:生成丙和丁的质量比为: B、符号分析:甲应用符号“”表示 C、宏观分析:乙和丙的元素组成相同 D、微观分析:反应的甲和乙分子个数比为:12. 明代《徐光启手记》中记载了硝酸的制备方法,其中涉及的化学方程式为H2SO4(浓)+KNO3 =X+HNO3↑,推断X的化学式为( )A、KS B、KSO4 C、KHSO4 D、SO313. 初中化学中概念比较多,准确理解化学概念是学好化学的关键。下列说法正确的是 ( )
A、质量分析:生成丙和丁的质量比为: B、符号分析:甲应用符号“”表示 C、宏观分析:乙和丙的元素组成相同 D、微观分析:反应的甲和乙分子个数比为:12. 明代《徐光启手记》中记载了硝酸的制备方法,其中涉及的化学方程式为H2SO4(浓)+KNO3 =X+HNO3↑,推断X的化学式为( )A、KS B、KSO4 C、KHSO4 D、SO313. 初中化学中概念比较多,准确理解化学概念是学好化学的关键。下列说法正确的是 ( )分子可分,原子不可分
含一种元素的物质可能是混合物
化学变化中包含物理变化
有氧气参加的反应都属于氧化反应
分解反应一定有单质生成
A、 B、 C、 D、14. 通过下列实验操作和现象能得出相应结论的是( )实验操作
现象
结论
A
向收集满CO2的软塑料瓶中加入约1/3体积滴有石蕊试液的水,旋紧瓶盖,振荡
塑料瓶变瘪,溶液变红
CO2能与石蕊反应
B
向某水样中加入适量的肥皂水,振荡
产生大量泡沫
该水样属于硬水
C
分别向盛有20℃40mL酒精和60℃40mL水的烧杯中各滴入1滴红墨水
在60℃水中扩散的更快
温度越高,分子运动越快
D
把等质量、相同的锌片与铁片同时放入等浓度等体积的稀盐酸中
锌片与盐酸产生气体更快
锌的金属活动性比铁强
A、A B、B C、C D、D15. 下列物质的性质与用途具有对应关系的是( )A、酒精具有可燃性,可用作溶剂 B、石墨质地软,可用作电池电极 C、武德合金熔点低,可用于制作保险丝 D、镁条具有金属光泽,可用于制作照明弹16. 某小组利用如图装置装置气密性良好进行创新实验。实验时,先观察一段时间发现无现象,然后加入氯化钠溶液,后气球膨胀,后打开止水夹,注射器活塞向左移动。下列说法不合理的是( ) A、铁的锈蚀是放热反应 B、使用氯化钠溶液的目的是加快铁的锈蚀 C、此实验能推断出铁的锈蚀需要水的参与 D、此实验能测出空气中氧气含量17. 与的溶解度曲线如图所示。下列说法正确的是( )
A、铁的锈蚀是放热反应 B、使用氯化钠溶液的目的是加快铁的锈蚀 C、此实验能推断出铁的锈蚀需要水的参与 D、此实验能测出空气中氧气含量17. 与的溶解度曲线如图所示。下列说法正确的是( ) A、的溶解度受温度影响的程度比的大 B、时,的溶解度比的大 C、时,与溶液的溶质质量分数一定相等 D、除去中混有的少量:加水溶解,加热蒸发,大量晶体析出时趁热过滤,洗涤干燥18. 极易被空气中的氧气氧化成。为了能较长时间观察到白色絮状沉淀,某化学兴趣小组设计了如图装置。下列关于此实验的说法正确的是( )
A、的溶解度受温度影响的程度比的大 B、时,的溶解度比的大 C、时,与溶液的溶质质量分数一定相等 D、除去中混有的少量:加水溶解,加热蒸发,大量晶体析出时趁热过滤,洗涤干燥18. 极易被空气中的氧气氧化成。为了能较长时间观察到白色絮状沉淀,某化学兴趣小组设计了如图装置。下列关于此实验的说法正确的是( ) A、检查装置气密性良好后装入药品,等中无气泡后再关闭止水夹 B、装置中铁与稀硫酸的反应是 C、的作用是排尽装置内的空气和将中的溶液压入中 D、的白色沉淀现象是在装置中产生的19. 下列实验方案不能达到实验目的的是 ( )
A、检查装置气密性良好后装入药品,等中无气泡后再关闭止水夹 B、装置中铁与稀硫酸的反应是 C、的作用是排尽装置内的空气和将中的溶液压入中 D、的白色沉淀现象是在装置中产生的19. 下列实验方案不能达到实验目的的是 ( )选项
实验目的
实验方案
鉴别炭粉和氧化铜粉末
取样,分别滴加稀盐酸
证明还原氧化铁所得黑色粉末中有铁
取样,用磁铁吸引
分离空气中的氧气和氮气
先将空气液化,再根据两者沸点差异进行分离
探究石蜡中是否含有碳元素
点燃,在火焰上方罩一只沾有澄清石灰水的烧杯
A、 B、 C、 D、20. 中国科学家已实现由到淀粉的全人工合成,其中一步重要反应的物质转化如图所示反应中,各物质的化学计量数均为 , 下列说法不正确的是( ) A、反应可用作实验室制氧气 B、中氧元素的化合价为 C、由反应可推测甲醛中含氢量低于甲醇 D、为使甲醇持续转化为甲醛,反应不需要补充
A、反应可用作实验室制氧气 B、中氧元素的化合价为 C、由反应可推测甲醛中含氢量低于甲醇 D、为使甲醇持续转化为甲醛,反应不需要补充二、非选择题
-
21. 自古开门七件事,柴米油盐酱醋茶。尽管世事变迁,今天还能透过苏州“柴园”“仓米巷”“油车场”“盐仓巷”“酱油弄”“醋库巷”等街巷的名字,遥想当年繁华的市井生活。(1)、“柴”:苏州市家用燃料的变迁主要经历了木材煤天然气等阶段。
燃料
主要成分
热量
木材
碳、氢、氧等元素
煤
碳、氢、硫、氮等元素
天然气
甲烷
根据上表可得天然气代替其它燃料的原因是 写出一点。
(2)、“米”:大米是我们的主要粮食,富含的营养素是 。(3)、“油”:油脂不溶于水,易溶于汽油等有机溶剂,说明物质的溶解性与 有关。(4)、“盐”:加碘盐可以预防甲状腺疾病。碘元素属于人体必需的 元素填“常量”或“微量”。(5)、“酱”:“铁强化酱油”是以强化营养为目的,按照标准在酱油中加入一定量的乙二胺四乙酸铁钠制成的。其中铁元素的化合价为 。(6)、“醋”:食醋可以除水垢主要成分 , 原理是醋酸可以将难溶于水的碳酸钙转化为易溶水的醋酸钙而除去。写出反应的化学方程式 。(7)、“茶”:彻一壶碧螺春,色泽碧绿,茶香四溢,说明分子在 。22. 如图是实验室制备气体的常用装置,请根据要求回答问题: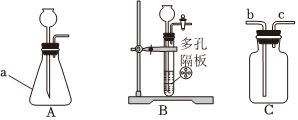 (1)、仪器的名称是 。(2)、实验室常用装置来制取氧气,发生反应的化学方程式是 。
(1)、仪器的名称是 。(2)、实验室常用装置来制取氧气,发生反应的化学方程式是 。装置通常不能用于实验室制取氧气,原因是 。
使用装置装满水收集 , 氧气从 进入填“”或“”。
(3)、用下图所示实验验证可燃物燃烧的条件实验前玻璃管内充满。
已知:白磷和红磷的着火点分别为、。
证明可燃物燃烧需要氧气的证据是 。
选择热水的目的是 。
23. 实验室需配制的碳酸钠溶液并进行相关实验。(1)、Ⅰ配制溶液某小组同学配制过程如图所示。
请指出上述实验存在错误的步骤编号并提出具体的操作方案 。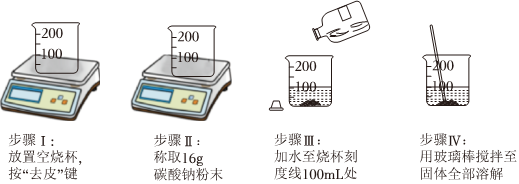 (2)、Ⅱ性质实验
(2)、Ⅱ性质实验
测定碳酸钠溶液的酸碱性:测得溶液的 选填“”“”或“”。(3)、鉴别氯化钙溶液和稀盐酸:各取溶液于两支试管中,分别滴加滴碳酸钠溶液。若产生 ,则为氯化钙溶液。写出反应的化学方程式 。
还可以选择以下试剂进行鉴别 填字母序号。
A.紫色石蕊试液
B.硝酸银溶液
C.氧化铜粉末
D.氢氧化钠溶液含少量酚酞
E.锌粒
(4)、Ⅲ废液处理 经分析废液中的溶质是和 , 小组同学决定用固体除去它们。
【提出问题】如何估算固体的用量?
【进行实验】取废液样品于烧杯中,逐滴滴加的溶液密度为 用传感器测定滴加过程中溶液的 , 实验结果如图所示。 【结果讨论】
【结果讨论】 阶段,观察到烧杯中的现象是 ,反应的化学方程式为 。
点时,取少量烧杯中的清液于试管中,滴加溶液,有白色沉淀生成。说明处理废液,所需的溶液的体积 。填“大于”“等于”或“小于”
将烧杯中的沉淀过滤、洗涤、干燥、称重,质量为。若集中处理该废液,理论上需要固体多少克?写出计算过程
24. 能源关乎国家大计和社会民生。 (1)、酉阳杂俎记载:“高奴县石脂水,水腻,浮上如漆,采以燃灯极明。”,此处“石脂水”即为石油。汽油是通过石油的 填“过滤”或“分馏”提炼出来的,汽车化油器将汽油喷成雾状进入内燃机气缸,其目的是 。(2)、年发布的中国能源大数据报告 , 显示我国、年能源消费结构如图所示。下列说法不正确的是 ____ 。A、我国能源消费中,煤炭仍处于主体性地位 B、煤炭、水能、风能、太阳能均属于清洁能源 C、清洁能源所占比重增加有助于改善空气质量(3)、氢能将在我国能源转型中将占据重要地位,低耗能制氢及高效储氢是氢气大规模应用的前提。
(1)、酉阳杂俎记载:“高奴县石脂水,水腻,浮上如漆,采以燃灯极明。”,此处“石脂水”即为石油。汽油是通过石油的 填“过滤”或“分馏”提炼出来的,汽车化油器将汽油喷成雾状进入内燃机气缸,其目的是 。(2)、年发布的中国能源大数据报告 , 显示我国、年能源消费结构如图所示。下列说法不正确的是 ____ 。A、我国能源消费中,煤炭仍处于主体性地位 B、煤炭、水能、风能、太阳能均属于清洁能源 C、清洁能源所占比重增加有助于改善空气质量(3)、氢能将在我国能源转型中将占据重要地位,低耗能制氢及高效储氢是氢气大规模应用的前提。分解水制取氢。在太阳能和新型高效光催化剂作用下,水分解的微观示意图如下:“
 ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,“”表示催化剂
”表示氧原子,“”表示催化剂 
请从微观的角度描述以上过程: 。
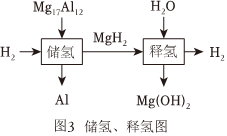
催化制氢。
在催化剂的作用下,反应的原理如图 , 催化制氢同时还获得 填化学式。若用代表一种氢原子代替催化制氢,生成氢气的化学式为 。
镁基储氢材料是最有发展潜力的储氢材料之一,利用一种镁铝合金储氢及释氢的过程如图所示,理论上释放的氢气 储存的氢气填“大于”或“小于”或“相等”。
 25. 的捕集与资源化利用是化学研究的热点。
25. 的捕集与资源化利用是化学研究的热点。 (1)、我国科学家李灿院士团队突破了太阳能电解水制取和加氢制甲醇的关键技术液态太阳燃料技术 , 技术路线如图所示。
(1)、我国科学家李灿院士团队突破了太阳能电解水制取和加氢制甲醇的关键技术液态太阳燃料技术 , 技术路线如图所示。该路线实现了能量间的相互转化,其中燃料电池工作过程中能量的转化方式为 。
氢能存储加氢反应催化剂:、压强:、温度:的化学方程式为 。每生成吨甲醇,理论上可减少排放 吨。
图中可循环使用的物质是和 。
(2)、捕集燃煤电厂烟气含有、、及中的 , 并将其甲烷化的流程如下。
【资料卡片】、水溶液低温可吸收 , 升高温度可解吸。
、恒温流化床反应器出口温度在左右。
“设备”可实现和气液分离,方法是: 。
根据资料卡片信息及流程,说出一种降低工艺成本的措施。 。
甲烷化的反应中, 。
不同制氢工艺碳排放量对比图如图所示,采用 填制氢方式可以实现碳减排。
26. 纳米米铁红常用作油漆、粉末冶金的原料等。工业上可用硫铁矿烧渣主要含有、、等为原料分步制备纳米铁红。【资料卡片】化学性质不稳定,易被氧化生成或。
【处理烧渣】硫铁矿烧渣经过还原焙烧、酸浸、水浴除杂等操作得到含酸的溶液。
(1)、还原焙烧是将硫铁矿烧渣和一定量的褐煤经过高温焙烧,生成。转化率转化率受焙烧温度及焙烧时间的影响如图及图所示,分析图像可知:最佳焙烧温度为 , 焙烧时间最好为 , 延长焙烧时间,转化率降低的原因可能是 。 (2)、酸浸时,用一定浓度的和反应,反应的化学方程式为 ,属于 反应填基本反应类型。(3)、【制备铁红】将处理后的含酸溶液经一系列操作可得纳米铁红,流程如图所示。
(2)、酸浸时,用一定浓度的和反应,反应的化学方程式为 ,属于 反应填基本反应类型。(3)、【制备铁红】将处理后的含酸溶液经一系列操作可得纳米铁红,流程如图所示。
酸性条件下,可将氧化成。稀释煮沸时,发生的反应主要有:和 。(4)、操作Ⅰ的名称 ,操作Ⅰ所得溶液中的溶质在农业上可作 。(5)、水洗时,为验证是否洗净,最好选用 ____ 填字母序号。A、溶液和湿润的红色石蕊试纸 B、溶液 C、溶液(6)、沸腾回流时,受热脱水生成纳米级。用离心机分离出 , 而不是过滤的原因是 。(7)、为时,产品中会混入 , 令使产品中铁元素的质量分数 填“偏大”或“偏小”。(8)、用吨含铁元素的硫铁矿渣制备铁红,假设铁元素无损失,理论上能制得纳米 吨。27. 某学习小组的同学以“探究碱石灰成分”为主题开展项目式学习。(1)、任务一:查阅资料认识碱石灰Ⅰ制碱石灰的流程:

Ⅱ的分解温度是;受热不分解。
上述制得的碱石灰主要含有、 和少量水。(2)、任务二:探究实验室久置的“碱石灰”样品的成分
【作出猜想】样品中的成分可能有下列几种: 猜想:、 猜想:、、 猜想:、、 猜想:、
【实验探究】该小组同学设计并进行了如下实验已知溶液呈中性实验步骤
现象
结论
步骤:取“碱石灰”样品于烧杯中
加入水,充分搅拌后静置
烧杯底部有白色固体
猜想不正确
步骤:取步骤烧杯中上层清液少许
加入或通入试剂
无明显现象
猜想不正确
步骤:取步骤烧杯中上层清液少许
滴滴酚酞溶液
溶液变红
猜想不正确,而猜想正确
步骤:取步骤变红的溶液
加入过量溶液
(3)、【反思评价】 步骤的方案不严密,理由是 。改进实验方案:取“碱石灰”样品于烧杯中, ,则猜想不正确。(4)、试剂可选用 ____ 填字母序号。A、氯化铁溶液 B、稀盐酸 C、碳酸钠溶液 D、二氧化碳