广西贺州市昭平县2023年中考化学二模试卷
试卷更新日期:2023-10-16 类型:中考模拟
一、单选题
-
1. 防治空气污染,保护生态环境。下列不属于空气污染物的是( )A、PM2.5 B、SO2 C、NO2 D、N22. 下列变化属于化学变化的是( )A、食盐溶解 B、火药爆炸 C、酒精挥发 D、蜡烛熔化3. 垃圾是放错地方的资源。废弃的水银温度计属于( )A、
 B、
B、 C、
C、 D、
D、 4. “豆腐,简单的食材,丰富的营养,带给你高品质的生活。”豆腐中富含的营养素是( )A、蛋白质 B、糖类 C、油脂 D、维生素5. 2023年中央一号文件指出要全面推进乡村振兴。合理使用化肥对“发展粮食产业,助力乡村振兴”有重要意义。下列化肥属于复合肥的是( )A、NH4Cl B、 C、 D、6. 化学实验操作要科学规范。下列实验操作正确的是( )A、称量NaOH固体
4. “豆腐,简单的食材,丰富的营养,带给你高品质的生活。”豆腐中富含的营养素是( )A、蛋白质 B、糖类 C、油脂 D、维生素5. 2023年中央一号文件指出要全面推进乡村振兴。合理使用化肥对“发展粮食产业,助力乡村振兴”有重要意义。下列化肥属于复合肥的是( )A、NH4Cl B、 C、 D、6. 化学实验操作要科学规范。下列实验操作正确的是( )A、称量NaOH固体 B、稀释浓硫酸
B、稀释浓硫酸 C、加热液体
C、加热液体 D、测定溶液pH
D、测定溶液pH 7. “佩香囊,迎端午”,人们能闻到香囊发出的香味,主要是因为( )A、分子是不断运动的 B、分子之间有间隔 C、分子是很小的 D、分子是由原子构成的8. 少量下列物质与水充分混合,能得到溶液的是( )A、蔗糖 B、面粉 C、植物油 D、冰块9. 填涂答题卡需要用2B铅笔,铅笔芯中含有石墨。下列属于石墨化学性质的是( )A、金属光泽 B、质软 C、导电性 D、可燃性10. 生活中一些常见物质的pH各不相同,其中呈酸性的是( )A、食盐水(pH=7) B、洁厕剂(pH=1) C、肥皂水(pH=10) D、炉具清洁剂(pH=12)11. 2022年6月5日神舟十四号载人飞船发射成功,NiFe2O4可作为催化剂将航天员呼出的CO2转化为O2 , 已知NiFe2O4中Fe为+3价,则Ni的化合价为( )A、+1 B、+2 C、+3 D、+412. 下列说法正确的是( )A、家用电器着火,立即用水扑灭 B、高层楼房失火,立即乘坐电梯逃离 C、厨房内天然气泄漏,立即打开排气扇 D、实验室酒精灯翻倒着火,立即用湿抹布盖灭13. 花青素具有缓解眼睛疲劳、保护视力的作用,其化学式为C15H11O6。下列说法错误的是( )A、从类别上看:花青素属于有机物 B、从宏观上看:花青素由碳、氢、氧三种元素组成 C、从质量上看:花青素中碳元素和氢元素的质量比为15:11 D、从微观上看:1个花青素分子由15个碳原子,11个氢原子和6个氧原子构成14. 下列反应属于复分解反应的是( )A、 B、 C、 D、15. 化学学习者常用化学学科观念去认识和理解世界。下列说法错误的是( )A、变化与守恒:根据质量守恒定律,1gMg和1gO2充分反应可得到2gMgO B、宏观与微观:金刚石和石墨物理性质差异很大的原因是碳原子排列方式不同 C、模型与推理:中和反应生成盐和水,但有盐和水生成的反应不一定是中和反应 D、探究与创新:制取气体实验中可用注射器代替分液漏斗,因为二者均可控制滴加药品的速率16. 下列各组离子在指定的溶液中,能大量共存的是( )A、酸性溶液中:K+、、 B、pH=12的溶液中:Mg2+、K+、 C、无色溶液中:K+、Na+、 D、含有大量Ba2+的溶液中:Na+、、OH-17. 实验室需配制50g10%的NaOH溶液。在配制溶液的过程中,下列说法正确的是( )A、用玻璃棒搅拌,加速NaOH固体的溶解 B、用药匙取用NaOH固体时,瓶塞正放于桌面 C、称量时天平指针向左偏转,应向右盘添加砝码至天平平衡 D、用量筒量取水时若仰视读数,所得的NaOH溶液的质量分数偏大18. 下列实验方案设计中,不能达到实验目的的是( )
7. “佩香囊,迎端午”,人们能闻到香囊发出的香味,主要是因为( )A、分子是不断运动的 B、分子之间有间隔 C、分子是很小的 D、分子是由原子构成的8. 少量下列物质与水充分混合,能得到溶液的是( )A、蔗糖 B、面粉 C、植物油 D、冰块9. 填涂答题卡需要用2B铅笔,铅笔芯中含有石墨。下列属于石墨化学性质的是( )A、金属光泽 B、质软 C、导电性 D、可燃性10. 生活中一些常见物质的pH各不相同,其中呈酸性的是( )A、食盐水(pH=7) B、洁厕剂(pH=1) C、肥皂水(pH=10) D、炉具清洁剂(pH=12)11. 2022年6月5日神舟十四号载人飞船发射成功,NiFe2O4可作为催化剂将航天员呼出的CO2转化为O2 , 已知NiFe2O4中Fe为+3价,则Ni的化合价为( )A、+1 B、+2 C、+3 D、+412. 下列说法正确的是( )A、家用电器着火,立即用水扑灭 B、高层楼房失火,立即乘坐电梯逃离 C、厨房内天然气泄漏,立即打开排气扇 D、实验室酒精灯翻倒着火,立即用湿抹布盖灭13. 花青素具有缓解眼睛疲劳、保护视力的作用,其化学式为C15H11O6。下列说法错误的是( )A、从类别上看:花青素属于有机物 B、从宏观上看:花青素由碳、氢、氧三种元素组成 C、从质量上看:花青素中碳元素和氢元素的质量比为15:11 D、从微观上看:1个花青素分子由15个碳原子,11个氢原子和6个氧原子构成14. 下列反应属于复分解反应的是( )A、 B、 C、 D、15. 化学学习者常用化学学科观念去认识和理解世界。下列说法错误的是( )A、变化与守恒:根据质量守恒定律,1gMg和1gO2充分反应可得到2gMgO B、宏观与微观:金刚石和石墨物理性质差异很大的原因是碳原子排列方式不同 C、模型与推理:中和反应生成盐和水,但有盐和水生成的反应不一定是中和反应 D、探究与创新:制取气体实验中可用注射器代替分液漏斗,因为二者均可控制滴加药品的速率16. 下列各组离子在指定的溶液中,能大量共存的是( )A、酸性溶液中:K+、、 B、pH=12的溶液中:Mg2+、K+、 C、无色溶液中:K+、Na+、 D、含有大量Ba2+的溶液中:Na+、、OH-17. 实验室需配制50g10%的NaOH溶液。在配制溶液的过程中,下列说法正确的是( )A、用玻璃棒搅拌,加速NaOH固体的溶解 B、用药匙取用NaOH固体时,瓶塞正放于桌面 C、称量时天平指针向左偏转,应向右盘添加砝码至天平平衡 D、用量筒量取水时若仰视读数,所得的NaOH溶液的质量分数偏大18. 下列实验方案设计中,不能达到实验目的的是( )实验目的
实验方案
A
鉴别涤纶和羊毛面料
分别取样灼烧、闻气味
B
除去N2中混有的少量O2
通过足量的灼热铜网
C
除去CO2中的少量CO气体
将气体通过足量的灼热CuO粉末
D
分离MnO2和KCl固体混合物
加入足量的水溶解,过滤
A、A B、B C、C D、D19. 图甲所示为t1℃时相同质量的A、B两种物质分别溶解在100g的水中,再将两种溶液分别升温至t2℃、t3℃时溶液的变化情况;图乙所示为两种物质的溶解度曲线。下列说法错误的是( ) A、M表示物质A的溶解度曲线 B、t2℃时,溶液③和溶液④中溶质质量相等 C、t1℃时,加入物质A、B的质量均是20g D、t3℃时,向溶液⑤加入60g物质A可全部溶解20. 下列图像不能正确反映其对应关系的是( )A、
A、M表示物质A的溶解度曲线 B、t2℃时,溶液③和溶液④中溶质质量相等 C、t1℃时,加入物质A、B的质量均是20g D、t3℃时,向溶液⑤加入60g物质A可全部溶解20. 下列图像不能正确反映其对应关系的是( )A、 向盛有一定量MnO2的烧杯中不断加入双氧水
B、
向盛有一定量MnO2的烧杯中不断加入双氧水
B、 一定量的镁在足量氧气中燃烧
C、
一定量的镁在足量氧气中燃烧
C、 某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
D、
某温度下,向一定量不饱和硝酸钾溶液中加入硝酸钾晶体
D、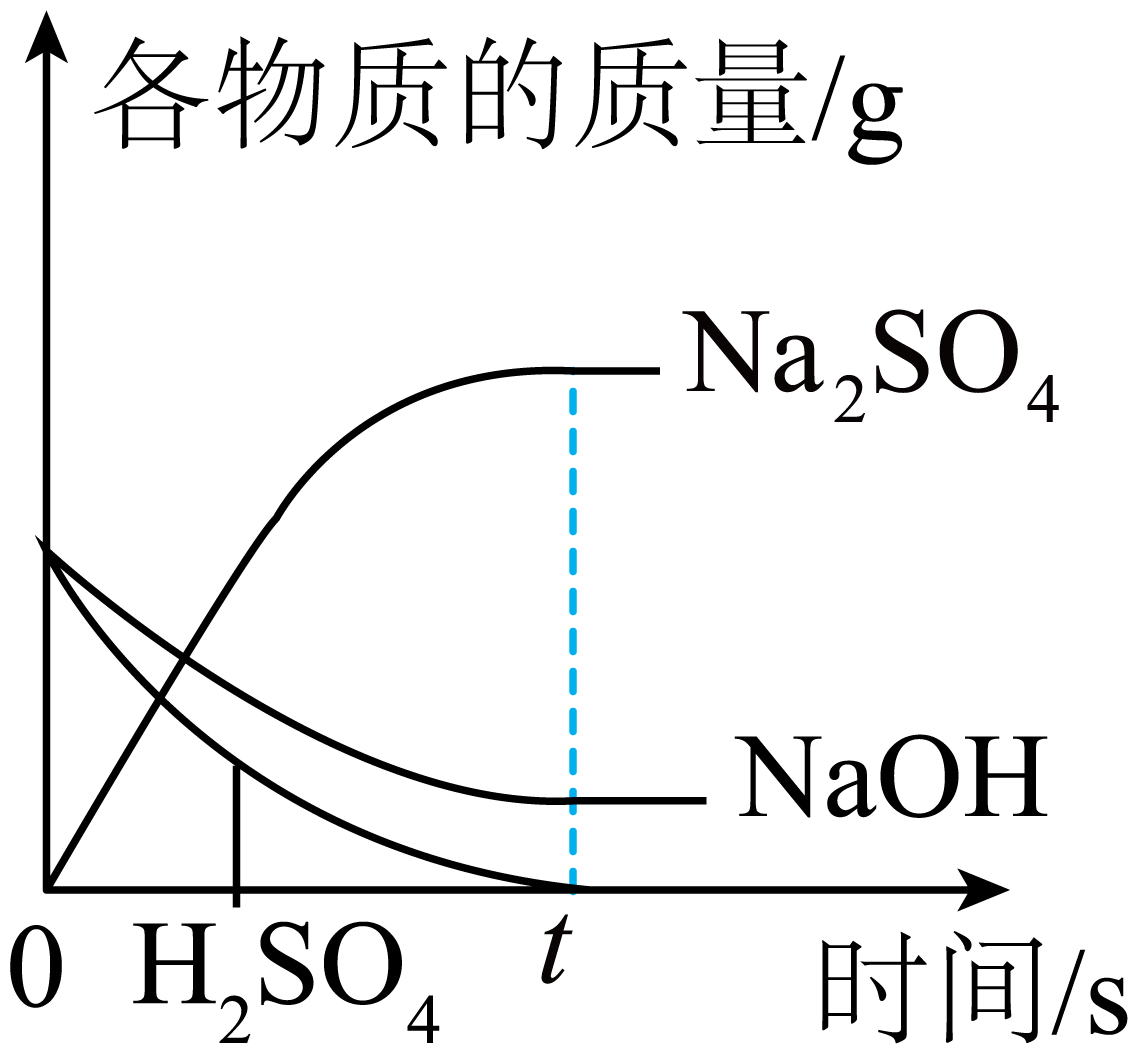 100g溶质质量分数为10%的稀硫酸与100g溶质质量分数为10%的氢氧化钠溶液混合
100g溶质质量分数为10%的稀硫酸与100g溶质质量分数为10%的氢氧化钠溶液混合
二、填空题
-
21. 请用化学用语填空。(1)、硫离子;(2)、干冰;(3)、2个汞原子;(4)、氮元素;(5)、3个五氧化二磷分子。22. 化学就在我们身边。请从下列物质中,选择适当物质的序号填空。
①酒精 ②稀有气体 ③维生素 ④碳酸钠 ⑤白醋
(1)、烹饪时用作酸性调味品的是。(2)、可用于制作电光源的是。(3)、广泛用于玻璃、造纸、纺织和洗涤剂生产的是。(4)、人体缺乏会引起坏血病的是。(5)、可用作燃料的是。23. 水是生命之源,研究“水”可从多角度展开。请结合所学知识回答有关问题。(1)、净水时通常用除去水中的异味和色素。(2)、下列关于电解水实验的叙述错误的是____(填序号)。A、该实验说明水是由氢气和氧气组成的 B、该实验说明分子在化学变化中可以再分 C、为了增强水的导电性,常在水中加入一定量的稀硫酸或氢氧化钠溶液(3)、做铁丝在氧气里燃烧的实验时,集气瓶里放入少量水的作用。(4)、二氧化氯(ClO2)是新一代饮用水的消毒剂,制取ClO2的微观过程如下:
A物质的化学式为;D物质的名称为。
24. 元素周期表是学习化学的重要工具,可根据元素在周期表的位置推断出该元素相关信息。如图1为元素周期表的一部分,图2为几种粒子结构示意图,请回答下列问题。 (1)、图1中氩的原子序数是 , 硫的相对原子质量为。(2)、X元素原子的核外电子数是。(3)、图2中与X元素化学性质相似的是(填序号)。(4)、图2所示粒子共表示种元素。25. 金属及金属材料广泛应用于生产、生活及科学实验,推动了社会的发展。(1)、铝比铁耐锈蚀是因为铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜,该反应的化学方程式为。(2)、为了防止铁制品生锈,通常会在铁制品表面刷漆,其原理是。(3)、《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质,刚指坚硬)。这句话说明合金的硬度比其组分的硬度(填“大”或“小”)。(4)、只需一种试剂就可以验证Fe、Cu和Al的金属活动性顺序,该试剂是____(填序号)。A、硫酸铝溶液 B、硫酸亚铁溶液 C、硫酸铜溶液 D、稀硫酸(5)、向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法正确的是____(填序号)。
(1)、图1中氩的原子序数是 , 硫的相对原子质量为。(2)、X元素原子的核外电子数是。(3)、图2中与X元素化学性质相似的是(填序号)。(4)、图2所示粒子共表示种元素。25. 金属及金属材料广泛应用于生产、生活及科学实验,推动了社会的发展。(1)、铝比铁耐锈蚀是因为铝在空气中与氧气反应,在其表面生成一层致密的氧化铝薄膜,该反应的化学方程式为。(2)、为了防止铁制品生锈,通常会在铁制品表面刷漆,其原理是。(3)、《吕氏春秋》记载“金柔锡柔,合两柔则刚”(注:金指铜单质,锡指锡单质,刚指坚硬)。这句话说明合金的硬度比其组分的硬度(填“大”或“小”)。(4)、只需一种试剂就可以验证Fe、Cu和Al的金属活动性顺序,该试剂是____(填序号)。A、硫酸铝溶液 B、硫酸亚铁溶液 C、硫酸铜溶液 D、稀硫酸(5)、向一定质量的Cu(NO3)2和AgNO3的混合溶液中逐渐加入锌粉。反应过程中溶质Cu(NO3)2的质量随加入锌粉质量的变化关系如图所示。下列说法正确的是____(填序号)。 A、c点时,溶液呈无色 B、a点时,溶液的总质量与反应前相比减小 C、d点时,过滤所得滤渣为Cu和Ag的混合物 D、b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液26. 氢气被视为未来理想的能源,科学家对氢能源的研究从未停歇。氢能源的广泛使用需解决制氢、储氢等问题。
A、c点时,溶液呈无色 B、a点时,溶液的总质量与反应前相比减小 C、d点时,过滤所得滤渣为Cu和Ag的混合物 D、b点时,溶液为Zn(NO3)2和Cu(NO3)2的混合溶液26. 氢气被视为未来理想的能源,科学家对氢能源的研究从未停歇。氢能源的广泛使用需解决制氢、储氢等问题。 (1)、①由图1可知,目前氢气的主要来源是(填“天然气和煤”、“醇类”或“水”)。②电解水制氢需要消耗大量的电能,下列获取电能的方式中,一定存在碳排放的。
(1)、①由图1可知,目前氢气的主要来源是(填“天然气和煤”、“醇类”或“水”)。②电解水制氢需要消耗大量的电能,下列获取电能的方式中,一定存在碳排放的。A.水力发电 B.燃煤发电 C.太阳能发电
(2)、氢气的储存有以下两种方式。①方法一:将氢气直接加压储存在由某种镁铝合金制造的储氢罐中备用。镁铝合金属于(填:“复合材料”、“金属材料”或“合成材料”)。
②方法二:先通过Mg2Cu与氢气反应,将氢气转化为MgH2暂时“储存”起来,此为储氢反应(如图2所示):需要使用氢气时,可通过释氢反应实现:。请写出储氢反应的化学方程式。
(3)、当前,我国氢能按如图3所示的规划迅速发展。由图3可知蓝氢是将(填写物质名称)重整制成。由于使用了碳捕捉先进技术,二氧化碳气体被捕获,减轻了对地球环境的影响,实现了低碳制氢。三、流程题
-
27. 锂被誉为“新能源金属”、“金属味精”和“推动世界前进的金属”,具有极高的战略价值。碳酸锂是生产金属锂制品的基础材料。以β-锂辉石为原料,用硫酸焙烧法制取碳酸锂的工艺流程(部分试剂和步骤等已略去)如下:

资料:
Ⅰ.β-锂辉石的主要成分是LiO2·Al2O3·4SiO2 , 含少量Ca、Mg元素。
Ⅱ. LiO2·Al2O3·4SiO2+H2SO4(浓)Li2SO4+Al2O3·4SiO2·H2O
(1)、酸化焙烧前将β-锂辉石磨成粉末的目的是。(2)、在“除镁除钙”步骤中,先加入石灰乳,再加入溶液。添加试剂的顺序不能调换,其原因是碳酸钠能除去过量的氢氧化钙,请写出该反应的化学方程式。(3)、操作1的名称为 , 滤渣②的成分是。(4)、和的溶解度如表所示:T/℃
20
40
60
80
S(Li2CO3)/g
1.33
1.17
1.01
0.85
S(Li2SO4)/g
34.2
32.8
31.9
30.7
为了提高产品的纯度,需要将得到的晶体洗涤,需选用℃的水。
四、实验题
-
28. 化学是一门以实验为基础的学科,请结合下列装置图回答问题。
 (1)、写出仪器①的名称。(2)、实验室用B装置制取氧气的化学方程式为。(3)、实验室制取二氧化碳所用药品为;若利用空塑料输液袋(如图E)收集二氧化碳,验满时,应把燃着的木条放在玻璃管的(填“a”或“b”)端,如果燃着木条熄灭则二氧化碳已收集满。(4)、与B装置对比,采用C装置制取气体的优点是;采用C装置制取气体时,长颈漏斗下端应伸入液面以下的原因是。(5)、F装置中的纸风车是由紫色石蕊溶液浸泡后的滤纸晾干制成,在纸风车的a叶片上滴1滴稀硫酸,b叶片上滴1滴蒸馏水,c叶片不做处理,再将纸风车放入盛有CO2的集气瓶中,通过对比(填“ab”或“bc”或“ac”)叶片,说明CO2与水发生了化学反应。
(1)、写出仪器①的名称。(2)、实验室用B装置制取氧气的化学方程式为。(3)、实验室制取二氧化碳所用药品为;若利用空塑料输液袋(如图E)收集二氧化碳,验满时,应把燃着的木条放在玻璃管的(填“a”或“b”)端,如果燃着木条熄灭则二氧化碳已收集满。(4)、与B装置对比,采用C装置制取气体的优点是;采用C装置制取气体时,长颈漏斗下端应伸入液面以下的原因是。(5)、F装置中的纸风车是由紫色石蕊溶液浸泡后的滤纸晾干制成,在纸风车的a叶片上滴1滴稀硫酸,b叶片上滴1滴蒸馏水,c叶片不做处理,再将纸风车放入盛有CO2的集气瓶中,通过对比(填“ab”或“bc”或“ac”)叶片,说明CO2与水发生了化学反应。五、科学探究题
-
29. 春晚节目《只此青绿》取材于宋朝王希孟的《千里江山图》,该画作历经千年依旧色彩艳丽的关键在于使用了石青、石绿、赭石等传统颜料。某化学兴趣小组对石青和石绿的性质进行了以下探究。

【查阅资料】
石青的主要成分是 , 石绿的主要成分是 , 都可称为碱式碳酸铜;碱式碳酸铜的化学式可表示为 , 其中“”表示合的意思,x、y为正整数;CuCO3、受热时会分解得到相应的氧化物;碱石灰是固体NaOH和CaO的混合物。
(1)、任务一 探究石青和石绿的化学性质【实验探究】
该画作历经千年依旧色彩艳丽,可推测所用矿物颜料常温下化学性质是(填“稳定”或“活泼”)的。(2)、如图1所示,取少量粉末于试管中,充分加热后观察到试管中固体变黑,烧杯中溶液变浑浊。该黑色固体为。(3)、取少量粉末于试管中,加入足量稀硫酸,观察到固体溶解,产生气泡,溶液由无色变成蓝色。溶液中含有的盐类物质为(填化学式)。
【实验结论】碱式碳酸铜受热可分解,且可与酸反应。(4)、任务二 测定某种碱式碳酸铜化学式可表示为的组成【实验探究】
利用如图2所示装置进行实验(实验中每一步吸收都是完全的)。
实验步骤如下:①连接好装置;②装入药品:③打开活塞K,鼓入空气:④一段时间后关闭活塞K,称量相关装置的质;⑤点燃酒精灯,至装置C中无气泡产生;⑥打开活塞K,鼓入空气;⑦熄灭酒精灯;⑧一段时间后关闭活塞K,称量相关装置质量。
(5)、【实验分析】A装置中U形管内碱石灰的作用是。
(6)、在装置D中氢氧化钠发生反应的化学方程式为。(7)、若碱式碳酸铜已完全分解,实验后装置C增重4.5g,装置D增重4.4g,则该碱式碳酸铜的化学式可表示为。六、计算题
-
30. 为了测定某品牌食用碱(主要成分为碳酸钠,含少量氯化钠杂质)中碳酸钠的质量分数。化学兴趣小组的同学将10.0g食用碱样品加到盛有90.0g水的烧杯中,完全溶解后,往其中逐次滴加溶质质量分数相同的氯化钙溶液,实验数据如下表所示:
实验次数
第1次
第2次
第3次
第4次
第5次
加入CaCl2溶液的质量/g
20.0
20.0
20.0
20.0
20.0
反应后溶液的总质量/g
118.0
136.0
154.0
172.0
192.0
请计算:
(1)、反应生成沉淀的总质量为g。(2)、该品牌食用碱中碳酸钠的质量分数。(写出计算过程)
-
-
-