人教版高中化学2023-2024学年高二上学期期中测试模拟卷(选择性必修1)(三)
试卷更新日期:2023-10-14 类型:期中考试
一、选择题
-
1. 合成氨反应的反应历程和能量变化如图所示(*R表示微粒处于吸附状态)。下列说法错误的是
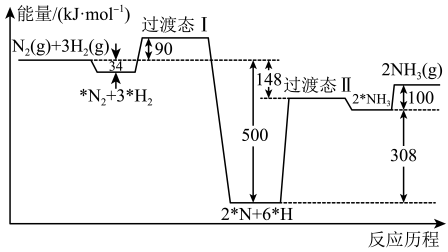 A、 B、决定总反应速率的反应历程为 C、升高温度,该反应历程中基元反应的速率均加快 D、反应历程中的最低能垒(活化能)为2. 下列陈述正确的是A、燃烧一定属于放热反应 B、氮气与氢气充分反应,转移电子数为 C、已知中和热为 , 则 D、已知甲烷的燃烧热为 , 则3. 热值(calorific vlue)又称卡值或发热量,燃料完全燃烧放出的热量称为该燃料的热值。已知几种可燃物的燃烧热如下表所示:
A、 B、决定总反应速率的反应历程为 C、升高温度,该反应历程中基元反应的速率均加快 D、反应历程中的最低能垒(活化能)为2. 下列陈述正确的是A、燃烧一定属于放热反应 B、氮气与氢气充分反应,转移电子数为 C、已知中和热为 , 则 D、已知甲烷的燃烧热为 , 则3. 热值(calorific vlue)又称卡值或发热量,燃料完全燃烧放出的热量称为该燃料的热值。已知几种可燃物的燃烧热如下表所示:可燃物
燃烧热
热值最高的是
A、 B、 C、 D、4. 合成氨原料中的H2可用甲烷在高温条件下与水蒸气反应制得。已知H2(g)、CO(g)、CH4(g)的燃烧热(△H)分别为-285.8 kJ/mol、-283.0 kJ/mol、-890.3 kJ/mol,且H2O(g)=H2O(l) △H=-44.0 kJ/mol。下列热化学方程式正确的是A、 B、 C、 D、5. 在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,下列说法正确的是 A、无催化剂时,反应不能进行 B、使用催化剂Ⅰ时,0~2min内, C、a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 D、与催化剂Ⅰ相比,催化剂Ⅱ使反应活化能更低6. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。下列说法正确的是( )
A、无催化剂时,反应不能进行 B、使用催化剂Ⅰ时,0~2min内, C、a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 D、与催化剂Ⅰ相比,催化剂Ⅱ使反应活化能更低6. 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。下列说法正确的是( ) A、t1min时该化学反应达到平衡状态 B、在4min时v正>v逆 C、4min内,CO2的转化率约为71.4% D、4min内,CO的平均反应速率v(CO)=0.25mol•L-1•min-17. 在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是A、v(A)=0.5mol/(L·s) B、v(B)=0.3mol/(L·s) C、v(C)=0.8mol/(L·s) D、v(D)=1.0mol/(L·s)8. 下列说法错误的是A、决定化学反应速率的主要因素是反应物本身的结构和性质 B、活化分子之间发生的碰撞一定是有效碰撞 C、所有活化分子的平均能量高于所有分子的平均能量 D、升高温度能加快反应速率是因为反应物分子中活化分子的百分数增加9. 下列叙述正确的是( )A、已知C(石墨,s)= C(金刚石,s) , 则石墨比金刚石稳定 B、反应在室温下能自发进行,该反应的 C、达平衡后,缩小容器体积,平衡转化率不变 D、密闭容器中存在: , 当时,该反应到达限度10. 下列说法中正确的是A、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 B、已知反应的平衡常数为 , 则的平衡常数为 C、由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 D、电解稀氢氧化钠溶液,要消耗OH- , 故溶液pH减小11. 工业上利用还原可制备金属铁,其反应原理为。在不同温度(、)下,向装有足量固体的恒容密闭容器中通入 , 测得反应体系中的体积分数随时间的变化曲线如图所示。下列说法正确的是
A、t1min时该化学反应达到平衡状态 B、在4min时v正>v逆 C、4min内,CO2的转化率约为71.4% D、4min内,CO的平均反应速率v(CO)=0.25mol•L-1•min-17. 在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是A、v(A)=0.5mol/(L·s) B、v(B)=0.3mol/(L·s) C、v(C)=0.8mol/(L·s) D、v(D)=1.0mol/(L·s)8. 下列说法错误的是A、决定化学反应速率的主要因素是反应物本身的结构和性质 B、活化分子之间发生的碰撞一定是有效碰撞 C、所有活化分子的平均能量高于所有分子的平均能量 D、升高温度能加快反应速率是因为反应物分子中活化分子的百分数增加9. 下列叙述正确的是( )A、已知C(石墨,s)= C(金刚石,s) , 则石墨比金刚石稳定 B、反应在室温下能自发进行,该反应的 C、达平衡后,缩小容器体积,平衡转化率不变 D、密闭容器中存在: , 当时,该反应到达限度10. 下列说法中正确的是A、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 B、已知反应的平衡常数为 , 则的平衡常数为 C、由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 D、电解稀氢氧化钠溶液,要消耗OH- , 故溶液pH减小11. 工业上利用还原可制备金属铁,其反应原理为。在不同温度(、)下,向装有足量固体的恒容密闭容器中通入 , 测得反应体系中的体积分数随时间的变化曲线如图所示。下列说法正确的是 A、由图分析可知 B、b点时,的转化率为20% C、b点和d点的化学平衡常数: D、反应达到平衡后,保持温度不变,将从反应体系中移走可提高的转化率12. 一定温度下,在2个容积均为10L的恒容密闭容器中,加入一定量的反应物,发生反应:H2(g)+I2(g) 2HI(g),充分反应并达到化学平衡状态,相关数据见表。下列说法正确的是
A、由图分析可知 B、b点时,的转化率为20% C、b点和d点的化学平衡常数: D、反应达到平衡后,保持温度不变,将从反应体系中移走可提高的转化率12. 一定温度下,在2个容积均为10L的恒容密闭容器中,加入一定量的反应物,发生反应:H2(g)+I2(g) 2HI(g),充分反应并达到化学平衡状态,相关数据见表。下列说法正确的是容器编号
起始时各物质的物质的量/mol
平衡时I2的浓度/(mol•L-1)
n(H2)
n(I2)
n(HI)
c(I2)
I
0.1
0.1
0
0.008
Ⅱ
0.2
0.2
0
x
A、该温度下,反应的化学平衡常数K=0.25 B、Ⅱ中x=0.008 C、容器内气体的密度不再改变可以作为反应达到化学平衡状态的标志 D、反应开始阶段的化学反应速率:I>Ⅱ13. 工业上通常采用铁触媒、在和的条件下合成氨。合成氨的反应为。下列说法正确的是A、的 B、采用的高温是有利于提高平衡转化率 C、采用的高压能增大反应的平衡常数 D、使用铁触媒可以降低反应的活化能14. 下列实验操作规范且能达到实验目的的是目的
操作
A
测定醋酸钠溶液的pH
用玻璃棒蘸 取溶液,点在湿润的pH试纸上
B
排除碱式滴定管尖嘴部分的气泡
将胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠,使溶液从尖嘴流出
C
由TiCl4制备TiO2∙xH2O
在干燥的HCl气流中加热
D
研究催化剂对H2O2分解速率的影响
分别向两支试管中加入相同体积不同浓度的H2O2溶液,再向其中一支中加入少量MnO2
A、A B、B C、C D、D15. 下列事实中,能说明是弱碱的是A、溶液的导电能力比溶液弱 B、溶液可以使酚酞溶液变红 C、常温下,溶液中 D、等体积的溶液与盐酸恰好完全反应16. 根据下列图示得出的结论正确的是。 A、图甲表示常温下稀释的溶液和氨水时溶液的变化,曲线II表示氨水 B、图乙表示反应在其他条件不变的情况下,改变起始的物质的量,平衡时的体积分数变化情况,由图可知的转化率: C、图丙表示相同浓度的溶液与溶液中分子浓度的分数[或]随的变化曲线,可得出酸性较强 D、图丁是用溶液滴定等浓度的滴定曲线 , 图中17. 下列物质溶于水,能使水的电离平衡向左移动的是A、 B、NaOH C、 D、18. 下列溶液一定显中性的是A、c(H+)=10-7mol•L-1或pH=7的溶液 B、酸和碱恰好反应完全的溶液 C、lg=0的溶液 D、不发生水解的盐溶液19. 下列溶液因水解而呈酸性的是A、溶液 B、溶液 C、溶液 D、溶液20. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
A、图甲表示常温下稀释的溶液和氨水时溶液的变化,曲线II表示氨水 B、图乙表示反应在其他条件不变的情况下,改变起始的物质的量,平衡时的体积分数变化情况,由图可知的转化率: C、图丙表示相同浓度的溶液与溶液中分子浓度的分数[或]随的变化曲线,可得出酸性较强 D、图丁是用溶液滴定等浓度的滴定曲线 , 图中17. 下列物质溶于水,能使水的电离平衡向左移动的是A、 B、NaOH C、 D、18. 下列溶液一定显中性的是A、c(H+)=10-7mol•L-1或pH=7的溶液 B、酸和碱恰好反应完全的溶液 C、lg=0的溶液 D、不发生水解的盐溶液19. 下列溶液因水解而呈酸性的是A、溶液 B、溶液 C、溶液 D、溶液20. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动二、非选择题
-
21. 25℃时,H2O的离子积常数为1×10﹣14 mol2•L﹣2 , 则该温度下:
①0.01mol•L﹣1NaOH溶液的pH是多少?
②0.005mol•L﹣1H2SO4溶液中,水电离出的氢氧根浓度是多少?
22. Na2SO3、 NaHSO3是常见的化工原料,常用作还原剂。(1)、25℃, H2SO3、 HSO 、SO
、SO 的物质的量分数[]与pH的关系如下图所示。
的物质的量分数[]与pH的关系如下图所示。

①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为 时应停止通入。
②向NaOH溶液中通入SO2 , 所得溶液中一定存在的等式是 (用溶液中所含微粒的物质的量浓度表示)。
③NaHSO3溶液的酸碱性: 。
④若测得25℃时,某溶液中c(SO32-)/c(H2SO3)=10,则溶液的pH为。
(2)、Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000 g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol·L-1I2标准溶液28 mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000 mol·L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+ 2Na2S2O3=2NaI+ Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16 mL。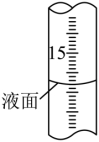
① 如何判断滴定终点:。
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为 mL。
③计算久置Na2SO3固体中Na2SO3的质量分数为
④ 下列情况会造成样品中Na2SO3含量测定结果偏低的是 (填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
23. 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: (1)、A点水的离子积为 , B点水的离子积为。造成水的离子积变化的原因是。(2)、下列说法正确的是(填字母)。
(1)、A点水的离子积为 , B点水的离子积为。造成水的离子积变化的原因是。(2)、下列说法正确的是(填字母)。a.图中A,B,D三点处Kw的大小关系:B>A>D
b.AB线上任意点的溶液均显中性
c.B点溶液的pH=6,显酸性
d.图中温度T1>T2
(3)、某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。①盛装0.2000 mol/L盐酸标准液应该用式滴定管。
②终点判断方法:。
③有关数据记录如下:
实验序号待测液体积(mL)所消耗盐酸标准液的体积(mL)
实验序号
待测液体积(mL)
所消耗盐酸标准液的体积(mL)
滴定前
滴定后
1
20.00
0.60
20.70
2
20.00
6.00
25.90
3
20.00
0.40
23.20
则NaOH溶液的物质的量浓度为mol/L。(保留四位有效数字)
④若滴定时锥形瓶未干燥,则测定结果;(填“无影响”、“偏高”或“偏低”)。
24. 常温下,某小组同学用如下装置探究的沉淀溶解平衡。实验装置
实验序号
传感器种类
实验操作

①
电导率传感器
向蒸馏水中加入足量粉末,一段时间后再加入少量蒸馏水
②
pH传感器
向滴有酚酞的蒸馏水中加入粉末,隔一段时间后,再向所得悬浊液中加入一定量稀硫酸
(1)、Ⅰ.实验①测得电导率随时间变化的曲线如图1所示。
已知:ⅰ.在稀溶液中,离子浓度越大,电导率越大。
a点电导率不等于0的原因是水能发生。
(2)、由图1可知,在悬浊液中加入少量水的时刻为(填“b”、“c”或“d”)点。(3)、分析电导率在de段逐渐上升的原因:d时刻,(填“>”、“<”或“=”) , 导致(结合沉淀溶解平衡解释原因)。(4)、Ⅱ.实验②测得pH随时间变化的曲线如图2所示。
已知:ⅱ.25℃,
ⅲ.酚酞的变色范围:
pH
<8.2
8.2~10
>10
颜色
无色
淡粉色
红色
依据图2可判断:A点加入的的物质的量大于C点加入的硫酸的物质的量,判据是。
(5)、0~300s时,实验②中溶液先变红,后。(6)、常被用于水质改良剂,能够使水体pH约为9,进而抑制细菌的生长。25℃时水体中约为。25. 氢能是一种极具发展潜力的清洁能源。以下反应是目前大规模制取氢气的重要方法之一: 。(1)、欲提高反应速率及的平衡转化率,理论上可以采取的措施为____。A、通入过量水蒸气 B、降低温度 C、增大压强 D、加入催化剂(2)、800℃时,该反应的平衡常数 , 在容积为1L的密闭容器中进行反应,测得某一时刻混合物中、、、的物质的量分别为2mol、5mol、4mol、3mol。①写出该反应的平衡常数表达式。
②该时刻反应(填“正向进行”、“逆向进行”或“达平衡”)。
(3)、830℃时,该反应的平衡常数。在容积为1L的密闭容器中,将2mol与8mol混合加热到830℃,反应达平衡时的转化率为。(4)、工业上利用得到的与进一步合成二甲醚: 。其他条件不变时,相同时间内的转化率随温度T的变化情况如图a所示。
①合成二甲醚反应的0(填“>”“<”或“=”)。
②在250℃之前,随温度升高,转化率增大的原因是。
③在图b中绘制出压强和转化率之间的关系 (作出趋势即可)。