人教版高中化学2023-2024学年高二上学期期中测试模拟卷(选择性必修1)(二)
试卷更新日期:2023-10-14 类型:期中考试
一、选择题
-
1. 甲醇通过催化氧化制取甲醛时,在无催化剂(图中实线)和加入特定催化剂(图中虚线)时均会产生甲醛,反应中相关物质的相对能量如图1所示。下列说法错误的是
 A、该条件下比稳定 B、加入该催化剂不能改变反应的焓变 C、无催化剂时,生成的活化能比生成甲醛的活化能小 D、无催化剂时,升高温度,甲醇氧化为甲醛的反应速率变化如图2所示2. “中国芯”的主要原料是单晶硅,“精炼硅”反应历程中的能量变化如下图所示。
A、该条件下比稳定 B、加入该催化剂不能改变反应的焓变 C、无催化剂时,生成的活化能比生成甲醛的活化能小 D、无催化剂时,升高温度,甲醇氧化为甲醛的反应速率变化如图2所示2. “中国芯”的主要原料是单晶硅,“精炼硅”反应历程中的能量变化如下图所示。
下列有关描述正确的是
A、历程Ⅰ、Ⅲ是吸热反应 B、历程Ⅱ的热化学方程式是: C、历程Ⅲ的热化学方程式是: D、实际工业生产中,粗硅变为精硅的过程中能量不损耗3. 2021年10月,神舟十三号载人飞船成功发射。载人飞船中通过如下过程实现O2再生:①CO2(g)+4H2(g)=CH4(g)+2H2O(l) ΔH1=-252.9 kJ·mol-1
②2H2O(l)=2H2(g)+O2(g) ΔH2=+571.6 kJ·mol-1
下列说法错误的是
A、H2的燃烧热ΔH = -285.8 kJ·mol-1 B、反应2H2(g)+O2(g)=2H2O(g)的 ΔH<-571.6 kJ·mol-1 C、反应2H2(g)+O2(g)=2H2O(l) 常温下能自发进行 D、反应CH4(g)+2O2(g)=CO2(g)+2H2O(l)的 ΔH=-890.3 kJ·mol-14. 由下列键能数据大小,不能得出的事实是化学键
O-H
H-H
O-O
键能kJ·mol-1
463
436
498.3
A、1molH2和molO2总能量大于1molH2O总能量 B、断开1molH2中的化学键所吸收的能量是436kJ C、H2(g)+O2(g)=H2O(g) ΔH=−240.85kJ·mol-1 D、生成1molH2O的化学键所放出热量是463kJ5. 在2A(g)+B(g)=3C(g)+4D(g)反应中,表示该反应速率最快的是A、v(A)=0.5mol/(L·s) B、v(B)=0.3mol/(L·s) C、v(C)=0.8mol/(L·s) D、v(D)=1.0mol/(L·s)6. 二氧化硫催化氧化反应为: , 下列措施既能加快反应速率又能提高平衡转化率的是A、升高温度 B、增大压强 C、分离出 D、使用催化剂7. 关于化学反应速率增大的原因,下列分析错误的是A、有气体参加的化学反应,增大压强使容器容积减小,可使单位体积内活化分子数增多 B、增大反应物的浓度,可使活化分子之间发生的碰撞都是有效碰撞 C、升高温度,可使反应物分子中活化分子的百分数增大 D、使用适宜的催化剂,可使反应物分子中活化分子的百分数增大8. 将0.05 mol·L的KI溶液和0.2 mol·L的溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡的是实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入溶液
有黄色沉淀生成
③
滴入溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A、① B、② C、③④ D、①②9. 催化加氢合成甲醇是重要的碳捕获利用与封存技术。催化加氢主要反应有:反应I.
反应II.
压强分别为、时,将的混合气体置于密闭容器中反应,不同温度下体系中的平衡转化率和、CO的选择性如图所示。
(或CO)的选择性

下列说法正确的是
A、反应为吸热反应 B、曲线③、④表示CO的选择性,且 C、相同温度下,反应I、II的平衡常数 D、一定温度下,调整 , 可提高的平衡转化率10. 反应 , 达到平衡时,下列说法正确的是A、减小容器体积,平衡向右移动 B、加入催化剂,Z的产率增大 C、增大c(X),X的转化率增大 D、降低温度,Y的转化率增大11. 一定条件下反应2AB(g)A2(g)+B2(g)达到平衡状态的标志是A、单位时间内生成nmolA2 , 同时消耗2nmolAB B、容器内,3种气体AB、A2、B2共存 C、AB的消耗速率等于A2的消耗速率 D、容器中各组分的体积分数不随时间变化12. 一定温度下,在三个容积均为1.0L的恒容密闭容器中发生反应: 。下列说法错误的是( )容器编号
温度(K)
起始物质的量(mol)
平衡时的物质的量(mol)
平衡常数
Ⅰ
530
0.05
0.05
0
0.025
Ⅱ
530
0.03
0.03
0.01
Ⅲ
510
0
0
0.05
A、三个容器中的平衡常数 B、达平衡时,容器Ⅱ中比容器Ⅰ中的大 C、达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的小 D、若起始时向容器Ⅰ中充入2.0mol(g)、0.1molCO(g)和8.0mol(g),则反应处于平衡状态13. 下列叙述正确的是( )A、已知C(石墨,s)= C(金刚石,s) , 则石墨比金刚石稳定 B、反应在室温下能自发进行,该反应的 C、达平衡后,缩小容器体积,平衡转化率不变 D、密闭容器中存在: , 当时,该反应到达限度14. 工业合成氨是人类科学技术的一项重大突破。其合成原理为: , 下列说法错误的是A、增大压强,活化分子百分含量不变,单位体积内活化分子增多,反应速率加快 B、该反应在低温下能自发进行 C、为了防止混有的杂质使催化剂“中毒”,原料气必须经过净化 D、能用勒夏特列原理解释通常采用500℃有利于氨的合成15. 的a、b两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是 ) A、a、b两酸溶液的物质的量浓度一定相等 B、稀释后,a酸溶液的酸性比b酸溶液强 C、时,a是强酸,b是弱酸 D、若a、b都是弱酸,则16. 25℃时,相同物质的量浓度的下列溶液:①NaCl溶液②NaOH溶液③溶液,其中水的电离程度按由大到小顺序排列的一组是A、③>②>① B、②>③>① C、①>②>③ D、③>①>②17. 下列溶液因水解而呈酸性的是A、溶液 B、溶液 C、溶液 D、溶液18. 某小组同学进行如下实验探究:
A、a、b两酸溶液的物质的量浓度一定相等 B、稀释后,a酸溶液的酸性比b酸溶液强 C、时,a是强酸,b是弱酸 D、若a、b都是弱酸,则16. 25℃时,相同物质的量浓度的下列溶液:①NaCl溶液②NaOH溶液③溶液,其中水的电离程度按由大到小顺序排列的一组是A、③>②>① B、②>③>① C、①>②>③ D、③>①>②17. 下列溶液因水解而呈酸性的是A、溶液 B、溶液 C、溶液 D、溶液18. 某小组同学进行如下实验探究:
下列分析正确的是
A、实验②、③黄色沉淀中均不含AgCl B、实验③证明浊液a中存在 C、实验②和③的反应可用相同的离子方程式表示 D、实验②的黄色沉淀中再滴加几滴0.1mol/L的NaCl溶液后,可转变为白色19. 下列措施能促进水的电离,并使的是A、向水中加入少量 B、将水加热煮沸 C、向水中加入少量 D、向水中加入少量20. 下列能用pH试纸测定溶液的pH且pH>7的是( )A、、、 B、NaClO、、KHS C、、、 D、、、二、非选择题
-
21. 研究含碳、氮的物质间转化的热效应,在日常生活与工业生产中均有很重要的意义。(1)、已知:H2O(l)= H2O(g) △H= +44.0kJ·mol-1 , 甲烷完全燃烧与不完全燃烧的热效应如下图所示。

①写出表示甲烷燃烧热的热化学方程式:。
②CO的燃烧热△H=kJ·mol-1。
(2)、已知拆开1 molH-H、1 molN-H、1 mol N ≡N化学键需要的能量分别是436 kJ、391kJ、946kJ, 则N2与H2反应生成NH3的热化学方程式为。(3)、以NH3、CO2为原料生产尿素[CONH2)2]的反应历程与能量变化示意图如下。
①第一步反应的热化学方程式为。
②第二步反应的△H0(填“>”、“<”或“=”)。
③从图象分析决定生产尿素的总反应的反应速率的步骤是第步反应。
22. 探究化学反应的快慢和限度具有十分重要的意义。(1)、Ⅰ.某实验小组欲通过用酸性和(草酸)反应测定单位时间内生成的体积,探究影响反应速率的因素。设计的实验方案如下(溶液已酸化),实验装置如图甲所示:
实验序号
A溶液
B溶液
①
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
②
20 mL 0.01 mol·L 溶液
30 mL 0.01 mol·L 溶液
完成上述反应的离子方程式为: , 该实验是探究对反应速率的影响。
(2)、若实验①在2 min末收集了4.48 mL (标准状况下,则在2 min末mol/L(假设混合溶液的体积为50 mL,反应前后体积变化忽略不计)。(3)、小组同学发现反应速率变化如图乙,其中时间内速率变快的主要原因可能是①该反应是放热反应:②。 (4)、Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验:
(4)、Ⅱ.溶液中存在平衡:(橙色)(黄色)。该溶液具有强氧化性。其还原产物在水溶液中呈绿色或蓝绿色。用溶液进行下列实验: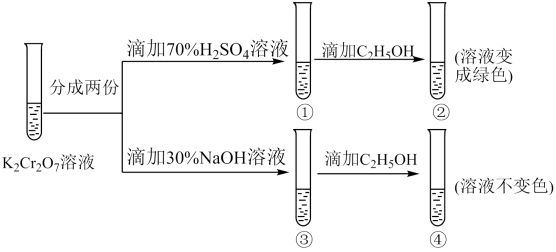
向溶液中加入30%NaOH溶液。溶液呈色:向溶液中逐滴加入溶液(已知为黄色沉淀),则平衡向着方向移动,溶液颜色变化为。
23. 25℃时,H2O的离子积常数为1×10﹣14 mol2•L﹣2 , 则该温度下:①0.01mol•L﹣1NaOH溶液的pH是多少?
②0.005mol•L﹣1H2SO4溶液中,水电离出的氢氧根浓度是多少?
24. 在水的电离平衡中,c(H+)和c(OH-)的关系如图所示: (1)、A点水的离子积为 , B点水的离子积为。造成水的离子积变化的原因是。(2)、下列说法正确的是(填字母)。
(1)、A点水的离子积为 , B点水的离子积为。造成水的离子积变化的原因是。(2)、下列说法正确的是(填字母)。a.图中A,B,D三点处Kw的大小关系:B>A>D
b.AB线上任意点的溶液均显中性
c.B点溶液的pH=6,显酸性
d.图中温度T1>T2
(3)、某校学生用中和滴定法测定某NaOH溶液的物质的量浓度,选酚酞作指示剂。①盛装0.2000 mol/L盐酸标准液应该用式滴定管。
②终点判断方法:。
③有关数据记录如下:
实验序号待测液体积(mL)所消耗盐酸标准液的体积(mL)
实验序号
待测液体积(mL)
所消耗盐酸标准液的体积(mL)
滴定前
滴定后
1
20.00
0.60
20.70
2
20.00
6.00
25.90
3
20.00
0.40
23.20
则NaOH溶液的物质的量浓度为mol/L。(保留四位有效数字)
④若滴定时锥形瓶未干燥,则测定结果;(填“无影响”、“偏高”或“偏低”)。
25. 甲酸(HCOOH)常用于橡胶、医药等工业。铋基催化剂对CO2电化学还原制取HCOOH具有高效的选择性。其反应历程与能量变化如图所示。 (1)、制取HCOOH催化效果较好的催化剂为。(2)、不同催化剂下,该历程的最大能垒(活化能)为eV;由生成的反应为。(3)、HCOOH燃料电池的工作原理如图所示。
(1)、制取HCOOH催化效果较好的催化剂为。(2)、不同催化剂下,该历程的最大能垒(活化能)为eV;由生成的反应为。(3)、HCOOH燃料电池的工作原理如图所示。
①该离子交换膜为(填“阳”或“阴”)离子交换膜。
②电池负极反应式为。
③当电路中转移0.2 mol电子时,理论上消耗标准状况下O2的体积为L,需补充物质X的化学式为。