人教版高中化学2023-2024学年高二上学期期中测试模拟卷(选择性必修1)(一)
试卷更新日期:2023-10-13 类型:期中考试
一、选择题
-
1. 1,3-丁二烯与按进行的某种反应可以分成两步完成,下图是该反应过程中的能量变化图。下列说法正确的是
 A、1,3-丁二烯与反应属于取代反应 B、1,3-丁二烯分子中不存在手性碳原子 C、第二步应决定总反应的快慢 D、加入催化剂可以改变该反应的反应热2. 合成氨反应的反应历程和能量变化如图所示(*R表示微粒处于吸附状态)。下列说法错误的是
A、1,3-丁二烯与反应属于取代反应 B、1,3-丁二烯分子中不存在手性碳原子 C、第二步应决定总反应的快慢 D、加入催化剂可以改变该反应的反应热2. 合成氨反应的反应历程和能量变化如图所示(*R表示微粒处于吸附状态)。下列说法错误的是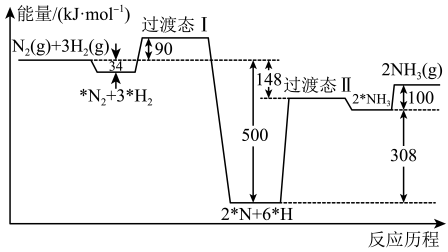 A、 B、决定总反应速率的反应历程为 C、升高温度,该反应历程中基元反应的速率均加快 D、反应历程中的最低能垒(活化能)为3. 中和反应反应热的测定中需要用到的实验仪器有A、秒表 B、滴定管 C、胶头滴管 D、简易量热计4. 关于如图所示转化关系(代表Cl、Br、I),下列说法错误的是
A、 B、决定总反应速率的反应历程为 C、升高温度,该反应历程中基元反应的速率均加快 D、反应历程中的最低能垒(活化能)为3. 中和反应反应热的测定中需要用到的实验仪器有A、秒表 B、滴定管 C、胶头滴管 D、简易量热计4. 关于如图所示转化关系(代表Cl、Br、I),下列说法错误的是 A、 B、 , C、越小,越稳定 D、若分别是、、 , 则依次减小5. 在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,下列说法正确的是
A、 B、 , C、越小,越稳定 D、若分别是、、 , 则依次减小5. 在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,下列说法正确的是 A、无催化剂时,反应不能进行 B、使用催化剂Ⅰ时,0~2min内, C、a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 D、与催化剂Ⅰ相比,催化剂Ⅱ使反应活化能更低6. 20世纪初,德国化学家哈伯首次用锇作催化剂在、550℃的条件下以和为原料合成了: 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。我国最新报道的氨催化合成反应的机理如图所示(*代表微粒吸附在催化剂表面)。下列说法正确的是
A、无催化剂时,反应不能进行 B、使用催化剂Ⅰ时,0~2min内, C、a曲线表示使用催化剂Ⅱ时X的浓度随t的变化 D、与催化剂Ⅰ相比,催化剂Ⅱ使反应活化能更低6. 20世纪初,德国化学家哈伯首次用锇作催化剂在、550℃的条件下以和为原料合成了: 。2021年11月,我国报道了新的合成氨催化剂设计策略,该技术可实现温和条件下的氨催化合成。我国最新报道的氨催化合成反应的机理如图所示(*代表微粒吸附在催化剂表面)。下列说法正确的是 A、整个历程中,反应速率最慢的反应的化学方程式为: B、催化剂吸附和会消耗能量 C、在转化过程中有非极性键的断裂和形成 D、使用该催化剂,降低了合成氨反应的活化能,提高了合成氨的平衡转化率7. 硫及其化合物之间的转化在生产中有着重要作用。接触法制硫酸中,制取的反应为 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是
A、整个历程中,反应速率最慢的反应的化学方程式为: B、催化剂吸附和会消耗能量 C、在转化过程中有非极性键的断裂和形成 D、使用该催化剂,降低了合成氨反应的活化能,提高了合成氨的平衡转化率7. 硫及其化合物之间的转化在生产中有着重要作用。接触法制硫酸中,制取的反应为 。反应在有、无催化剂条件下的能量变化如图所示。下列说法正确的是 A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、8. 在一定温度下,密闭容器中进行的反应为 , 、、起始的物质的量依次为、、 , 当反应达到平衡时,各物质的浓度不可能是A、 B、 C、 D、9. 小组同学探究盐溶液对反应Fe3++SCN-[Fe(SCN)]2+ (血红色)的影响。将2 mL0.01mol/LFeCl3的溶液与2 mL0.02mol/L的KSCN溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。
A、催化时,该反应的速率取决于步骤① B、使用作催化剂同时降低了正、逆反应的活化能 C、其他条件相同,增大 , 的转化率下降 D、8. 在一定温度下,密闭容器中进行的反应为 , 、、起始的物质的量依次为、、 , 当反应达到平衡时,各物质的浓度不可能是A、 B、 C、 D、9. 小组同学探究盐溶液对反应Fe3++SCN-[Fe(SCN)]2+ (血红色)的影响。将2 mL0.01mol/LFeCl3的溶液与2 mL0.02mol/L的KSCN溶液混合,分别加入等量的试剂①~④,测得平衡后体系的透光率如下图所示。已知:ⅰ.溶液血红色越深,透光率越小,其它颜色对透光率的影响可忽略
ⅱ.Fe3++4Cl-[FeCl4]-(黄色)

下列说法错误的是( )
A、注入试剂①后溶液透光率增大,证明Fe3++SCN-[Fe(SCN)]2+逆向移动 B、透光率③比②高,可能是阳离子种类或溶液pH导致的 C、透光率④比③高,可能发生了反应 D、若要证明试剂③中Cl-对平衡体系有影响,还应使用0.04 mol/L的KNO3溶液进行实验10. 工业上利用还原可制备金属铁,其反应原理为。在不同温度(、)下,向装有足量固体的恒容密闭容器中通入 , 测得反应体系中的体积分数随时间的变化曲线如图所示。下列说法正确的是 A、由图分析可知 B、b点时,的转化率为20% C、b点和d点的化学平衡常数: D、反应达到平衡后,保持温度不变,将从反应体系中移走可提高的转化率11. 用于处理废水中的重金属离子的硫代碳酸钠可通过如下反应制备 。关于上述反应,下列说法正确的是A、是氧化产物 B、该反应常温下就能进行说明该反应一定为放热反应 C、该制备反应是熵减过程 D、的沸点比的高12. 工业上通常采用铁触媒、在和的条件下合成氨。合成氨的反应为。下列说法正确的是A、的 B、采用的高温是有利于提高平衡转化率 C、采用的高压能增大反应的平衡常数 D、使用铁触媒可以降低反应的活化能13. 下列实验装置能达到实验目的是( )
A、由图分析可知 B、b点时,的转化率为20% C、b点和d点的化学平衡常数: D、反应达到平衡后,保持温度不变,将从反应体系中移走可提高的转化率11. 用于处理废水中的重金属离子的硫代碳酸钠可通过如下反应制备 。关于上述反应,下列说法正确的是A、是氧化产物 B、该反应常温下就能进行说明该反应一定为放热反应 C、该制备反应是熵减过程 D、的沸点比的高12. 工业上通常采用铁触媒、在和的条件下合成氨。合成氨的反应为。下列说法正确的是A、的 B、采用的高温是有利于提高平衡转化率 C、采用的高压能增大反应的平衡常数 D、使用铁触媒可以降低反应的活化能13. 下列实验装置能达到实验目的是( )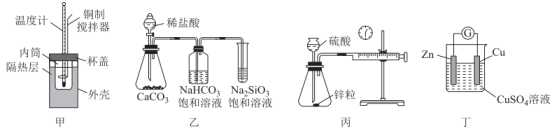 A、用图甲装置测定中和反应的反应热 B、用图乙装置证明非金属性:Cl>C>Si C、用图丙装置测量锌与稀硫酸的反应速率 D、用图丁装置比较锌、铜金属性强弱14. 下列事实中,能说明是弱碱的是A、溶液的导电能力比溶液弱 B、溶液可以使酚酞溶液变红 C、常温下,溶液中 D、等体积的溶液与盐酸恰好完全反应15. 对下列事实解释的化学用语表达正确的是A、硫酸铜溶液呈酸性: B、氨水呈碱性: C、将水加热至90℃水的pH变小: D、向碳酸氢钠溶液中滴加滴加酚酞呈红色:16. 下列物质溶于水,能使水的电离平衡向左移动的是A、 B、NaOH C、 D、17. 水的电离平衡曲线如图所示,下列说法错误的是
A、用图甲装置测定中和反应的反应热 B、用图乙装置证明非金属性:Cl>C>Si C、用图丙装置测量锌与稀硫酸的反应速率 D、用图丁装置比较锌、铜金属性强弱14. 下列事实中,能说明是弱碱的是A、溶液的导电能力比溶液弱 B、溶液可以使酚酞溶液变红 C、常温下,溶液中 D、等体积的溶液与盐酸恰好完全反应15. 对下列事实解释的化学用语表达正确的是A、硫酸铜溶液呈酸性: B、氨水呈碱性: C、将水加热至90℃水的pH变小: D、向碳酸氢钠溶液中滴加滴加酚酞呈红色:16. 下列物质溶于水,能使水的电离平衡向左移动的是A、 B、NaOH C、 D、17. 水的电离平衡曲线如图所示,下列说法错误的是 A、图中五点间的关系:B>C>A=D=E B、若从A点到达C点,可采用的方法:温度不变在水中加少量NaCl固体 C、向E点对应的醋酸钠溶液中滴加HCl溶液至A点,此时 D、若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合后,溶液显中性18. 下列说法正确的是A、pH=0的溶液不存在 B、使用广范pH试纸测得某溶液的pH=3.5 C、中性溶液的pH不一定等于7 D、适用于任何温度、任何溶液19. 下列说法错误的是A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化和消毒 B、某雨水样品采集后放置一段时间,pH由4.68变为4.28,可能是因为雨水中被氧化了 C、实验室配制FeCl3溶液时,先将FeCl3固体溶于浓盐酸,再加水稀释,其目的是防止FeCl3的水解 D、醋酸钠溶液呈碱性的原因是20. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是
A、图中五点间的关系:B>C>A=D=E B、若从A点到达C点,可采用的方法:温度不变在水中加少量NaCl固体 C、向E点对应的醋酸钠溶液中滴加HCl溶液至A点,此时 D、若处在B点时,将pH=2的硫酸溶液与pH=10的KOH溶液等体积混合后,溶液显中性18. 下列说法正确的是A、pH=0的溶液不存在 B、使用广范pH试纸测得某溶液的pH=3.5 C、中性溶液的pH不一定等于7 D、适用于任何温度、任何溶液19. 下列说法错误的是A、明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化和消毒 B、某雨水样品采集后放置一段时间,pH由4.68变为4.28,可能是因为雨水中被氧化了 C、实验室配制FeCl3溶液时,先将FeCl3固体溶于浓盐酸,再加水稀释,其目的是防止FeCl3的水解 D、醋酸钠溶液呈碱性的原因是20. 绚丽多彩的无机颜料的应用曾创造了古代绘画和彩陶的辉煌。硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是 A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动
A、图中a和b分别为T1、T2温度下CdS在水中的溶解度 B、图中各点对应的Ksp的关系为:Ksp(m)=Ksp(n)<Ksp(p)<Ksp(q) C、向m点的溶液中加入少量Na2S固体,溶液组成由m沿mpn线向p方向移动 D、温度降低时,q点的饱和溶液的组成由q沿qp线向p方向移动二、非选择题
-
21. 利用CO2合成二甲醚有助于实现“碳中和”。CO2加氢合成二甲醚涉及的主要反应如下:
I. CO2(g)+ 3H2(g) CH3OH(g)+ H2O(g) ΔH1 = −49 kJ∙mol−1
II. 2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH2= −24.5 kJ∙mol−1
III. CO2(g)+H2(g) CO(g)+ H2O(g) ΔH3= +41.2 kJ∙mol−1
回答下列问题:
(1)、反应CO(g)+2H2(g) CH3OH(g)的ΔH= kJ∙mol−1。(2)、一定条件下,向恒容密闭容器中充入2 mol CH3OH(g),发生反应: 2CH3OH(g) CH3OCH3(g)+ H2O(g)达平衡时,CH3OH(g)转化率为50%。若反应前容器中含有0.5molH2O(g),则CH3OH(g)的平衡转化率为。(3)、理论计算表明,在260℃和适当催化剂条件下,向恒容密闭容器中充入1 molCO2(g)和3 mol H2(g),初始压强为p kPa,发生上述反应, 10 min时达平衡,生成0.05 molCO(g)和0.3 mol H2O (g),容器中压强为 p kPa。若反应速率用单位时间内气体分压变化表示,则0~10 min内υ(CH3OCH3)=kPa∙min−1; Kx是以物质的量分数表示的平衡常数,反应I平衡常数Kx= (列出计算式即可) 。(4)、起始投料比n(H2)/n(CO2)=4,压强为3.0 MPa的条件下发生上述反应,CO2平衡转化率和平衡时二甲醚的选择性随温度的变化如图所示。
已知:二甲醚选择性=表示平衡时CH3OCH3选择性的曲线是 (填“X”或“Y” );温度高于300℃时,曲线X的纵坐标随温度升高而增大的原因是。
(5)、为同时提高CO2的平衡转化率和平衡时CH3OCH3的选择性,应选择的反应条件为____(填标号)。A、低温、低压 B、低温、高压 C、高温、低压 D、高温、高压22. 汽车尾气中的主要污染物是NOx和CO,它们是现代化城市中的重要大气污染物。(1)、汽车发动机工作时会引发N2和O2反应生成NO,其能量变化如图1所示,则图1中三种分子最稳定的是 , 图1中对应反应的热化学方程式为。 (2)、N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下: △H。有关化学反应的能量变化过程如图2所示。
(2)、N2O和CO均是有害气体,可在Pt2O+表面转化为无害气体,其反应原理如下: △H。有关化学反应的能量变化过程如图2所示。
图2
①图2中,该反应的活化能为 , 该反应的△H=;
②在反应体系中加入Pt2O+作为该反应的催化剂,则△H(填“增大”“减小”或“不变”)。
(3)、利用NH3还原法可将NOx还原为N2进行脱除。已知: 。若有15 g NO被还原,则释放的热量为kJ。(4)、“绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。已知25℃和101 kPa下:① △H =-a kJ/mol
② △H =-b kJ/mol
③H2O(g)=H2O(l) △H =-c kJ/mol
则表示CH3OH(l)燃烧热的热化学方程式为。
23. 2018年是合成氨工业先驱哈伯(F•Haber)获得诺贝尔奖100周年。N2和H2生成NH3的反应为:N2(g)+H2(g)NH3(g) △H(298K)=-46.2kJ•mol-1 , 在Fe催化剂作用下的反应历程如下(*表示吸附态)化学吸附:N2(g)→2N*;H2(g)→2H*
表面反应:N*+H*NH*;NH*+H*NH2*;NH2*+H*NH3*
脱附:NH3*NH3(g)
其中,N2吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。请回答:
(1)、利于提高合成氨平衡产率的条件有____(填字母)。A、低温 B、高温 C、低压 D、高压 E、催化剂(2)、实际生产中,常用Fe作催化剂,控制温度773K,压强3.0×107Pa,原料中N2和H2物质的量之比为1:2.8。分析说明原料气中N2过量的两个理由:、。(3)、关于合成氨工艺的下列理解,正确的是____(填字母)。A、合成氨反应在不同温度下的△H和△S都小于零 B、当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率 C、基于NH3有较强的分子间作用力可将其液化,不断将液氨移去,利于反应正向进行 D、分离空气可得N2 , 通过天然气和水蒸气转化可得H2 , 原料气须经过净化处理,以防止催化剂“中毒’(4)、T℃时,在有催化剂、体积为1.0L的恒容密闭容器中充入3molH2、1molN2 , 10min时反应达到平衡,测得c(NH3)=1.2mol•L-1。①前10min的平均反应速率v(H2)=mol•L-1•min-1。
②化学平衡常数K=。
(5)、图1表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中M点数据计算N2的平衡体积分数。 (6)、图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是(填“温度”或“压强”);判断L1、L2的大小关系并说明理由。
(6)、图2是合成氨反应平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是(填“温度”或“压强”);判断L1、L2的大小关系并说明理由。 24. 已知:25℃时,CH3COOH和NH3•H2O的电离平衡常数近似相等。(1)、关于0.1mol•L-1CH3COOH溶液,回答下列问题。
24. 已知:25℃时,CH3COOH和NH3•H2O的电离平衡常数近似相等。(1)、关于0.1mol•L-1CH3COOH溶液,回答下列问题。①25℃时,测得0.1mol•L-1CH3COOH溶液的pH=3,则由水电离出的的浓度为mol•L-1。
②CH3COONa溶液显(填“酸性”、“碱性”或“中性”),用离子方程式表示其原因:。
(2)、关于0.1mol•L-1氨水,回答下列问题。①NH3•H2O的电离方程式为 , NH3•H2O的电离平衡常数表达式:Kb=。
②25℃时,0.1mol•L-1氨水的pH=。
③25℃时,向10mL0.1mol•L-1氨水中加入同体积同浓度的盐酸。下列说法正确的是。
a.c(Cl-)>c(NH)>c(OH-)>c(H+)
b.c(Cl-)=c(NH)+c(NH3•H2O)
25. 完成下列问题(1)、某温度(t℃)时,水的Kw=10-13 , 则该温度(填大于、等于或小于)25℃,将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合,①若所得混合溶液为中性,则a:b=;
②若所得混合溶液pH=2, 则 a:b=。
(2)、在一定温度下,有a.醋酸 b.盐酸 c.硫酸 三种酸:①同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是;(用a、b、c表示,下同)
②若三者c(H+)相同时,酸的物质的量浓度由大到小的顺序为;
③将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是。