人教版高中化学2023-2024学年高一上学期期中测试模拟卷(必修1)(三)
试卷更新日期:2023-10-13 类型:期中考试
一、选择题
-
1. 现有A、B、C、D四种物质,它们分别是、(稀)、(溶液)、(溶液)四种物质中的一种,它们之间的反应关系及所发生反应的反应类型如图:

则物质B为( )
A、 B、(溶液) C、(稀) D、(溶液)2. 下列物质可用于油漆、涂料、油墨和橡胶的红色颜料的是( )A、 B、 C、 D、3. 下列分散系不能产生“丁达尔效应”的是( )A、硫酸铜溶液 B、有色玻璃 C、雾 D、氢氧化铁胶体4. 下列物质能导电且属于电解质的是( )A、食盐水 B、液氨 C、Mg D、熔融NaOH5. 下列方框中的物质或溶液之间发生的反应分别是①②③④,下列有关这些反应的说法错误的是( ) A、①是置换反应,反应的离子方程式为 B、②是复分解反应,反应的离子方程式为 C、③是化合反应,但不是离子反应 D、④中反应的离子方程式可能是6. 下列离子方程式正确的是( )A、大理石与稀硝酸反应: B、的电离方程式: C、稀盐酸滴在铜片上: D、氢氧化铝溶于氢氧化钠溶液的反应:7. 关于反应 , 下列说法正确的是( )A、生成 , 转移电子 B、是还原产物 C、既是氧化剂又是还原剂 D、若设计成原电池,为负极产物8. 四氧化三铁磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备磁性纳米颗粒的反应是:
A、①是置换反应,反应的离子方程式为 B、②是复分解反应,反应的离子方程式为 C、③是化合反应,但不是离子反应 D、④中反应的离子方程式可能是6. 下列离子方程式正确的是( )A、大理石与稀硝酸反应: B、的电离方程式: C、稀盐酸滴在铜片上: D、氢氧化铝溶于氢氧化钠溶液的反应:7. 关于反应 , 下列说法正确的是( )A、生成 , 转移电子 B、是还原产物 C、既是氧化剂又是还原剂 D、若设计成原电池,为负极产物8. 四氧化三铁磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具.水热法制备磁性纳米颗粒的反应是:下列叙述不正确的是( )
A、水热法制备磁性纳米颗粒的反应中,还原剂是 B、离子方程式中 C、每生成 , 被氧化的的物质的量为 D、该条件下氧化性强于9. 下列有关金属钠说法正确的是( )A、金属钠燃烧时火焰为黄色 B、金属钠着火时,可以使用泡沫灭火器灭火 C、金属钠遇水直接生成过氧化钠并放出大量热 D、金属钠的保存应避光避雨,存放于敞开容器中10. 新能源电池广泛使用碳酸锂为原料制造,下列关于碳酸锂说法不正确的是( )A、碳酸锂的化学式为 B、碳酸锂属于电解质 C、可通过焰色试验鉴别碳酸锂和碳酸钠 D、碳酸锂与酸、碱均不反应11. 如图所示为氯及其化合物价—类二维图,已知、、均为钠盐,下列物质间转化的离子方程式正确的是( ) A、和反应制备 B、的水溶液呈酸性: C、具有强氧化性: D、增强的漂白性:12. 如图是实验室制备氯气并进行相关实验的装置(夹持与加热装置已省略),下列有关说法错误的是
A、和反应制备 B、的水溶液呈酸性: C、具有强氧化性: D、增强的漂白性:12. 如图是实验室制备氯气并进行相关实验的装置(夹持与加热装置已省略),下列有关说法错误的是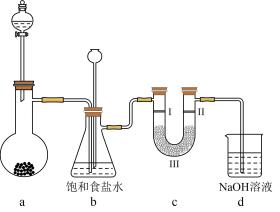 A、若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠 B、检验氯气是否有漂白性,则I、II、III分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸 C、装置b的作用既可以洗气又可以作安全瓶监测装置c是否堵塞 D、含有4molHCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4L13. 某同学欲配制 500 mL0.10 mol/LCuSO4 溶液。以下操作①~④是其配制过程及示意图:
A、若无加热装置,则装置a蒸馏烧瓶中可用高锰酸钾或次氯酸钠 B、检验氯气是否有漂白性,则I、II、III分别为湿润的石蕊试纸、碱石灰、干燥的石蕊试纸 C、装置b的作用既可以洗气又可以作安全瓶监测装置c是否堵塞 D、含有4molHCl的浓盐酸与足量二氧化锰反应,产生标准状况下的Cl2体积小于22.4L13. 某同学欲配制 500 mL0.10 mol/LCuSO4 溶液。以下操作①~④是其配制过程及示意图:
关于该配制过程,下列说法正确的是( )
A、操作①中,称取 8.0 g 胆矾晶体,并于烧杯中加水溶解 B、操作①和②中玻璃棒的作用不同 C、操作③为定容,按图示观察,将导致所配溶液浓度偏低 D、操作④摇匀后静置,发现液面低于刻度线,继续加水至凹液面与刻度线相切14. 下列叙述正确的是( )A、摩尔是国际单位制中的七个基本物理量之一 B、标准状况下,1 mol任何物质体积均约为22.4 L C、通常状况下,3.01×1023个SO2分子的质量为32 g D、同温同压下,相同体积的任何气体所含的原子数目相同15. 实验室将粗盐提纯并配制的溶液。下列仪器中,本实验必须用到的有①天平②温度计③坩埚④分液漏斗⑤容量瓶⑥烧杯⑦滴定管⑧酒精灯
A、①②④⑥ B、①④⑤⑥ C、②③⑦⑧ D、①⑤⑥⑧16. 某工厂的废渣中混有少量的锌粉和氧化铜(其它成分不跟酸反应),跟废盐酸接触形成污水。若向该污水中撒入铁粉,反应后铁粉有剩余,所得溶液中一定含有的金属离子是( )A、Fe2+、Cu2+ B、Cu2+、Zn2+ C、Zn2+、Fe2+ D、Zn2+、Fe3+17. 如图是一种综合处理SO2废气的工艺流程。下列说法正确的是( ) A、操作Ⅱ发生反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O B、溶液b中阳离子只有Fe2+ C、溶液a转化为溶液b的反应中,SO2被还原 D、加入FeO可以使溶液c转化为溶液a18. 类比法是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列有关类比推测的说法正确的是( )A、已知Fe与S能直接化合生成FeS,推测Cu和S可直接化合生成CuS B、已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应 C、已知Cu与Cl2能直接化合生成CuCl2 , 推测Fe与Cl2可直接化合生成FeCl2 D、已知Al能与O2生成致密氧化膜保护金属,推测Fe也与O2生成氧化膜保护金属19. 下列物质中既能与稀HCl反应,又能与NaOH溶液反应的是( )
A、操作Ⅱ发生反应的离子方程式为4Fe2++4H++O2=4Fe3++2H2O B、溶液b中阳离子只有Fe2+ C、溶液a转化为溶液b的反应中,SO2被还原 D、加入FeO可以使溶液c转化为溶液a18. 类比法是研究物质性质的常用方法之一,可预测许多物质的性质。但类比是相对的,不能违背客观事实。下列有关类比推测的说法正确的是( )A、已知Fe与S能直接化合生成FeS,推测Cu和S可直接化合生成CuS B、已知Fe与CuSO4溶液反应,推测Fe与AgNO3溶液也能反应 C、已知Cu与Cl2能直接化合生成CuCl2 , 推测Fe与Cl2可直接化合生成FeCl2 D、已知Al能与O2生成致密氧化膜保护金属,推测Fe也与O2生成氧化膜保护金属19. 下列物质中既能与稀HCl反应,又能与NaOH溶液反应的是( )① ② ③Al ④ ⑤ ⑥
A、②③④⑥ B、①②③⑥ C、①③④⑤⑥ D、全部20. 要想证明某溶液中是否含Fe3+ , 下列操作中正确的是A、加入铁粉 B、滴加KSCN溶液 C、通入Cl2 D、加入铜片二、非选择题
-
21. 过氧化钠色固体,与CO2反应,方程式 . 因此,过氧化钠可作为呼吸面具和潜水艇的氧气来源.22. 计算题:常温下,将20.0g 14%的NaCl溶液与30.0g 24%的NaCl溶液混合,混合后得到密度为1.17g/cm3的溶液.请计算(无解题过程不得分):
①混合后溶液中NaCl的质量分数;
②混合后溶液中NaCl的物质的量浓度;
③在1000g水中加多少 mol NaCl,才能使其浓度恰好与上述混合后溶液的浓度相等(结果保留一位小数).
23. 物质分类和化学计量在化学中占有重要地位。(1)、现有下列物质:①石墨;②氢氧化钠固体;③稀硫酸;④熔融氯化钾;⑤氨气;⑥蔗糖。其中能导电的有;属于电解质的有;属于非电解质的有。(均填写序号)(2)、已知(次磷酸)与足量的NaOH反应只生成一种盐 , 水溶液中存在分子。属于酸(填序号)。a.一元酸 b.二元酸 c.三元酸 d.强酸 e.弱酸
(3)、是一种酸性氧化物,可制取 , 从括号内所给试剂(NaCl溶液、NaOH溶液、溶液)中选择合适的,完成这一反应,写出该反应的化学方程式:。(4)、个中含有的氧原子数与1.5molCO中含有的氧原子数相等。(5)、38g某二价金属的氯化物中含有0.8mol , 则A的摩尔质量为。(6)、在相同状况下,相同质量的与的体积比为。24. 回答下列问题:(1)、下列物质中:①稀硫酸②SO2③熔融NaOH④CH4⑤NH4Cl固体⑥Al。属于电解质的是。(填序号,下同)。属于非电解质的是。(2)、49gH2SO4分子中共含个氢原子,将上述H2SO4溶于水配成500mL溶液,并从中取出10mL再加水稀释到100mL,稀释后H2SO4溶液的物质的量浓度为mol/L。(3)、甲烷是一种可燃性气体,当甲烷与氧气的质量比为1∶4时极易发生爆炸,此时甲烷与氧气的体积比为。(4)、工业炼铁原理为 , 该反应是氧化剂是(填化学式),请用单线桥描述该反应的电子转移情况:。25. 实验室用如下装置制取纯净、干燥的氯气,回答下列问题: (1)、上述实验制备氯气的化学方程式为;(2)、因Cl2的密度比空气(填“大”或“小”),故图中装置收集氯气所使用的方法为法;(3)、a溶液是 , 作用为;b溶液是 , 作用为;(4)、该实验装置不足之处是。
(1)、上述实验制备氯气的化学方程式为;(2)、因Cl2的密度比空气(填“大”或“小”),故图中装置收集氯气所使用的方法为法;(3)、a溶液是 , 作用为;b溶液是 , 作用为;(4)、该实验装置不足之处是。