人教版高中化学2023-2024学年高一上学期期中测试模拟卷(必修1)(一)
试卷更新日期:2023-10-13 类型:期中考试
一、选择题
-
1. 下列分类不正确的是( )A、碳酸氢钾——盐 B、涤纶——有机高分子材料 C、医用酒精——混合物 D、冰水混合物——胶体2. 下列物质属于电解质的是( )A、 B、 C、Fe D、淀粉溶液3. 甲、乙澄清溶液同时喷洒到白纸上出现红色印迹,对两溶液可能包含离子判断正确的是
选项
甲
乙
A
、、、
、、、
B
、、、
、、、
C
、、、
、、、
D
、、、
、、、
A、A B、B C、C D、D4. 在汽车尾气净化装置里,气体在催化剂表面吸附与解吸作用的过程如图所示: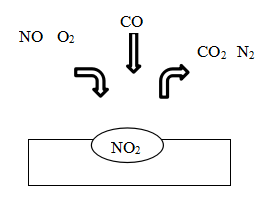
下列说法不正确的是( )
A、该转化过程中有3种元素的化合价发生变化 B、NO 和O2必须在催化剂表面才能反应 C、该装置将有毒的NO和CO转化为无毒的CO2和N2 D、该催化转化的总反应方程式为:2NO+O2+4CO4CO2+N25. 某同学将金属钠露置于空气中足够长时间,观察到下列现象:银白色→变灰暗→变白色→出现液滴→白色固体→白色粉末。下列有关叙述不正确的是( )A、表面迅速变暗是因为钠与空气中的氧气反应生成了Na2O B、出现液滴原因是生成的Na2CO3吸收空气中的水蒸气在表面形成了溶液 C、最后白色粉末为碳酸钠粉末 D、最后白色粉末的质量比金属钠质量大6. 《本草经集注》中记载了区别硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也”,这是运用了硝石的( )A、焰色反应 B、氧化性 C、还原性 D、不稳定性7. 下列物质的性质与用途具有对应关系的是( )A、Al 的金属活泼性强,可用于制作铝金属制品 B、S有氧化性,可用于生产SO2 C、Na2SO3具有还原性,可用于废水脱氯(Cl2) D、NaHCO3受热易分解,可用于制抗酸药物8. 下列实验结论与实验操作及现象相符的一组是( )选项
实验操作及现象
实验结论
A
将一小块金属钠加入至CuSO4溶液中,溶液蓝色褪去,有红色固体出现
钠比铜还原性强,钠置换出铜
B
向紫色石蕊溶液中加入新制氯水,溶液先变红,随后褪色
新制氯水中含有氧气分子
C
向淀粉-KI溶液中通入氯气,溶液变成蓝色
氧化性:Cl2>I2
D
向某溶液中加入AgNO3溶液,有白色沉淀生成
该溶液中一定含有Cl-
A、A B、B C、C D、D9. 下列物质能使湿润的蓝色石蕊试纸先变红后褪色的是( )A、 B、 C、HCl D、10. 下列物理量单位不正确的是( )A、物质的量:mol B、摩尔质量: C、气体摩尔体积: D、阿伏加德罗常数:11. NA为阿伏加德罗常数,下列说法中正确的是( )A、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA B、10mL12mol/L盐酸与足量MnO2加热反应,制得Cl2的分子数为0.03NA C、2gH218O与D216O的混合物中所含电子数为NA D、常温常压下,11.2L甲烷中含有的氢原子数为2NA12. 下列实验操作中:①过滤;②取固体试剂;③蒸发;④取液体试剂;⑤溶解;⑥配制一定物质的量浓度的溶液。一定要用到玻璃棒的是( )A、①③④⑥ B、①②③④ C、①③⑤⑥ D、②③④⑤13. NA为阿伏加德罗常数的值,下列说法正确的是( )A、58.5gNaCl晶体中含有的分子数为NA B、标准状况下,22.4LC6H6中含有的分子数为NA C、标准状况下,18g18O2含有的质子数为8NA D、1L2mol/LK2SO4溶液中含有的K+数目为2NA14. 下列有关铁及其化合物的说法正确的是( )A、铁与水蒸气在高温下的反应产物为Fe2O3和H2 B、向饱和FeCl3溶液中滴加过量氨水,可制取Fe(OH)3胶体 C、配制FeSO4溶液时,可在溶液中加入少量铁粉 D、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入Cu粉,然后过滤15. 室温下,探究溶液的性质,下列实验方案能达到探究目的的是( )选项
探究目的
实验方案
A
溶液中是否含有
向溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化
B
是否有还原性
向溶液中滴加几滴酸性溶液,观察溶液颜色变化
C
是否水解
向溶液中滴加2~3滴酚酞试液,观察溶液颜色变化
D
能否催化分解
向溶液中滴加几滴溶液,观察气泡产生情况
A、A B、B C、C D、D16. 向同浓度的、的混合溶液中加入铁粉,充分反应后仍有固体存在。下列判断中正确的是( )A、加入溶液可能变红色 B、溶液中一定含 C、溶液中一定含 D、剩余固体中一定含铜17. 有些金属的表面在空气中能自然形成致密的氧化膜,从而保护内层金属不易被继续氧化,符合这种特点的金属是A、 B、 C、 D、18. 下列物质不能由化合反应制取的是( )A、Fe(OH)3 B、Al(OH)3 C、FeCl3 D、FeCl219. 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示。下列说法正确的是( ) A、若甲是Al,丙是Al(NO3)3 , 则乙一定是NaAlO2 B、若甲是Al2O3 , 丙是NaAlO2 , 则乙一定是Al(NO3)3 C、若甲是Al(NO3)3 , 丙是NaAlO2 , 则乙一定是Al(OH)3 D、若甲是Al(OH)3 , 丙是Al(NO3)3 , 则乙一定是NaAlO220. 不能使悬浊液变澄清的是( )A、硫酸溶液 B、盐酸 C、氢氧化钠溶液 D、氨水
A、若甲是Al,丙是Al(NO3)3 , 则乙一定是NaAlO2 B、若甲是Al2O3 , 丙是NaAlO2 , 则乙一定是Al(NO3)3 C、若甲是Al(NO3)3 , 丙是NaAlO2 , 则乙一定是Al(OH)3 D、若甲是Al(OH)3 , 丙是Al(NO3)3 , 则乙一定是NaAlO220. 不能使悬浊液变澄清的是( )A、硫酸溶液 B、盐酸 C、氢氧化钠溶液 D、氨水二、非选择题
-
21. 标准状况时,33.6LNH3约含有个氨分子,质量是g,全部溶于水后配成1L溶液,所得溶液的物质的量浓度为mol/L。22. 84消毒液是北京某医院在1984年研制成功的一种高效含氯消毒液。该消毒液可由与溶液反应制得,其主要成分为、 , 是无色或淡黄色液体。人们主要利用84消毒液中的氧化性进行消毒。比要稳定的多,虽然也会分解,但它的水溶液在低温下存放三年才分解一半左右。(1)、84消毒液的有效成分是。(2)、84消毒液是由和两种物质组成的混合物。(3)、用与溶液制备84消毒液的反应属于氧化还原反应。(4)、很稳定,高温加热不分解。23. 某无色透明溶液中可能大量存在Ag+、Mg2+、Cu2+、Fe3+、Na+中的几种,请填写下列空白:(1)、不做任何实验就可以肯定原溶液中不存在的离子有。(2)、取少量原溶液,加入过量稀盐酸,有白色沉淀生成;再加入过量的稀硝酸,沉淀不消失。说明原溶液中肯定存在的离子是 , 有关的离子方程式为。(3)、取(2)中的滤液,加入过量的NaOH溶液,出现白色沉淀,说明液中肯定有 , 有关的离子方程式为。(4)、原溶液可能大量存在的阴离子是下列的____。A、Cl- B、 C、24. 有A、B、C、D四种物质的溶液,在进行焰色试验时,火焰都呈黄色,它们之间可发生如图所示的转化。
 (1)、B物质的化学式为。(2)、C物质为钠盐,所属类别为____。A、酸式盐 B、碱式盐 C、正盐(3)、D转化为A的离子方程式。(4)、下列说法错误的是____。A、A与C能进行化学反应 B、上述反应均不属于氧化还原反应 C、往固体B中加少量水,会发生放热现象 D、等质量的B和C与足量盐酸反应,产生的二氧化碳一样多25. 铁和锌的混合物共31.6克,与足量稀硫酸反应,产生标准状况下氢气11.2 升,
(1)、B物质的化学式为。(2)、C物质为钠盐,所属类别为____。A、酸式盐 B、碱式盐 C、正盐(3)、D转化为A的离子方程式。(4)、下列说法错误的是____。A、A与C能进行化学反应 B、上述反应均不属于氧化还原反应 C、往固体B中加少量水,会发生放热现象 D、等质量的B和C与足量盐酸反应,产生的二氧化碳一样多25. 铁和锌的混合物共31.6克,与足量稀硫酸反应,产生标准状况下氢气11.2 升,问:①产生标准状况下氢气的物质的量是多少?
②混合物中锌的物质的量是多少?铁的质量是多少?
③参与反应的硫酸物质的量是多少?