广东省广州市越秀区2023年中考二模化学试题
试卷更新日期:2023-10-13 类型:中考模拟
一、选择题(本题包括14小题,每小题3分,共42分)
-
1. 下列物质的用途中,利用了物质的物理性质的是( )A、氧气供给呼吸 B、“干冰”用于人工降雨 C、铁粉用作包装食品“除氧剂” D、熟石灰用于改良酸性土壤2. 如图是元素周期表的一部分,以下表述正确的是( )
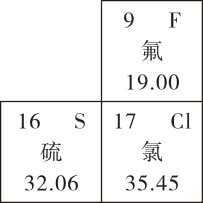 A、氟原子的结构示意图为:
A、氟原子的结构示意图为: B、硫原子的相对原子质量为 32.06g
C、氟元素和氯元素处于同一周期
D、硫元素和氯元素具有相似的化学性质
3. 下列关于水的说法不正确的是( )A、自来水厂净水过程中明矾做絮凝剂,能吸附水中悬浮的杂质 B、鉴别硬水和软水可用肥皂水 C、蒸馏过程需放入碎瓷片防暴沸 D、电解水过程正、负极产生气体的质量比为 2:14. 新型冠状病毒的预防和治愈都离不开化学知识,下列材料不属于有机高分子材料的是( )A、无纺布医用口罩 B、水银玻璃温度计 C、装消毒液用的塑料瓶 D、橡胶手套5. “宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图所示,下列说法不正确的是( )
B、硫原子的相对原子质量为 32.06g
C、氟元素和氯元素处于同一周期
D、硫元素和氯元素具有相似的化学性质
3. 下列关于水的说法不正确的是( )A、自来水厂净水过程中明矾做絮凝剂,能吸附水中悬浮的杂质 B、鉴别硬水和软水可用肥皂水 C、蒸馏过程需放入碎瓷片防暴沸 D、电解水过程正、负极产生气体的质量比为 2:14. 新型冠状病毒的预防和治愈都离不开化学知识,下列材料不属于有机高分子材料的是( )A、无纺布医用口罩 B、水银玻璃温度计 C、装消毒液用的塑料瓶 D、橡胶手套5. “宏观﹣微观﹣符号”三重表征是化学独特的表示物质及其变化的方法。某化学反应的微观示意图如图所示,下列说法不正确的是( )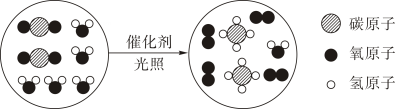 A、从微观构成看:四种物质均由分子构成 B、从物质分类看:该反应过程涉及到 2 种氧化物 C、从反应类型看:该反应属于置换反应 D、从微粒个数关系看:该反应两种反应物的分子个数比为 2:16. 下列说法错误的是( )A、二氧化碳灭火器在使用时手要握在木柄上,防止冻伤 B、不慎将氢氧化钠沾到皮肤上,应先用大量水冲洗,然后涂上 3%的硼酸溶液 C、滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污 D、铁是人体所必须的微量元素,缺铁会导致贫血7. 青蒿素(Artemisinin)是治疗疟疾耐药性效果最好的药物,它的分子式为 C15H22O5 , 下列关于青蒿素的说法正确的是( )A、青蒿素属于有机高分子化合物 B、青蒿素中碳元素的质量分数为 20.5% C、青蒿素中C、H、O 元素的原子个数比为 15:22:5 D、青蒿素中含有氢气分子8. 下列关于能源的说法,不正确的是( )A、煤、石油、天然气和酒精都是不可再生资源 B、化石燃料燃烧会造成空气污染 C、氢能,风能,太阳能属于清洁能源 D、炒菜时,天然气的火焰呈黄色,锅底出现黑色物质,是因为天然气未充分燃烧9. 将一枚洁净的铁钉放入稀盐酸中,下列叙述不正确的是:( )A、铁钉表面有气泡产生 B、液体由无色逐渐变为黄色 C、溶液的质量增加 D、该反应符合质量守恒定律10. (NH4)2SO4 是一种常见的化肥,其水溶液呈酸性,下列关于(NH4)2SO4 的说法,正确的是( )A、(NH4)2SO4 是一种复合肥 B、(NH4)2SO4 溶液能使紫色石蕊溶液变蓝 C、(NH4)2SO4 属于酸,长期使用会导致土壤酸化 D、(NH4)2SO4 和 K2SO4 可用加熟石灰混合研磨后扇闻气味法进行鉴别11. t2℃时,向盛有 10g 水的烧杯中加入 13g 固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中固体析出,甲的溶解度曲线如图所示。若不考虑水分蒸发,下列说法正确的是( )
A、从微观构成看:四种物质均由分子构成 B、从物质分类看:该反应过程涉及到 2 种氧化物 C、从反应类型看:该反应属于置换反应 D、从微粒个数关系看:该反应两种反应物的分子个数比为 2:16. 下列说法错误的是( )A、二氧化碳灭火器在使用时手要握在木柄上,防止冻伤 B、不慎将氢氧化钠沾到皮肤上,应先用大量水冲洗,然后涂上 3%的硼酸溶液 C、滴加洗涤剂能将餐具上的油污洗掉,因为洗涤剂能溶解油污 D、铁是人体所必须的微量元素,缺铁会导致贫血7. 青蒿素(Artemisinin)是治疗疟疾耐药性效果最好的药物,它的分子式为 C15H22O5 , 下列关于青蒿素的说法正确的是( )A、青蒿素属于有机高分子化合物 B、青蒿素中碳元素的质量分数为 20.5% C、青蒿素中C、H、O 元素的原子个数比为 15:22:5 D、青蒿素中含有氢气分子8. 下列关于能源的说法,不正确的是( )A、煤、石油、天然气和酒精都是不可再生资源 B、化石燃料燃烧会造成空气污染 C、氢能,风能,太阳能属于清洁能源 D、炒菜时,天然气的火焰呈黄色,锅底出现黑色物质,是因为天然气未充分燃烧9. 将一枚洁净的铁钉放入稀盐酸中,下列叙述不正确的是:( )A、铁钉表面有气泡产生 B、液体由无色逐渐变为黄色 C、溶液的质量增加 D、该反应符合质量守恒定律10. (NH4)2SO4 是一种常见的化肥,其水溶液呈酸性,下列关于(NH4)2SO4 的说法,正确的是( )A、(NH4)2SO4 是一种复合肥 B、(NH4)2SO4 溶液能使紫色石蕊溶液变蓝 C、(NH4)2SO4 属于酸,长期使用会导致土壤酸化 D、(NH4)2SO4 和 K2SO4 可用加熟石灰混合研磨后扇闻气味法进行鉴别11. t2℃时,向盛有 10g 水的烧杯中加入 13g 固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中固体析出,甲的溶解度曲线如图所示。若不考虑水分蒸发,下列说法正确的是( )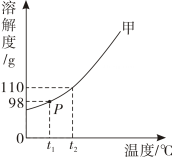 A、甲溶于水的过程放热 B、搅拌可以増大甲物质的溶解度 C、甲的溶解度为 98g D、通过升温可以将甲的不饱和溶液变为饱和溶液12. 为了达到实验目的,下列实验方案合理的是( )
A、甲溶于水的过程放热 B、搅拌可以増大甲物质的溶解度 C、甲的溶解度为 98g D、通过升温可以将甲的不饱和溶液变为饱和溶液12. 为了达到实验目的,下列实验方案合理的是( )选项
实验目的
实验试剂或操作
A
除去碳粉中混有铁粉
加入适量硫酸铜溶液,充分反应后过滤
B
除去氯化钠中混有的碳酸钠
加入过量稀硫酸,充分反应后蒸发结晶
C
除去氢气中混有的一氧化碳
通入适量氧气,再将气体点燃
D
除去硝酸铜溶液中混有的硝酸银
加入足量铜粉,充分反应后过滤
A、A B、B C、C D、D13. 向盐酸和氯化钙的混合液中逐滴滴入碳酸钠溶液,溶液 pH 随加入碳酸钠溶液质量的变化如图所示,其中氯化钙的水溶液呈中性,以下说法正确的是( )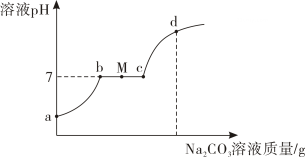 A、ab 段代表碳酸钠与氯化钙发生反应 B、M 点表示的溶液中阳离子有 Na+和 Ca2+ C、ac 段表示的溶液中溶质 NaCl 的质量先增加后减少 D、d 点处的溶液遇无色酚酞不变色14. 下列实验操作对应的现象和结论不正确的是( )
A、ab 段代表碳酸钠与氯化钙发生反应 B、M 点表示的溶液中阳离子有 Na+和 Ca2+ C、ac 段表示的溶液中溶质 NaCl 的质量先增加后减少 D、d 点处的溶液遇无色酚酞不变色14. 下列实验操作对应的现象和结论不正确的是( )实验操作
现象
结论
A
向某待测液中加氯化钙溶液
有白色沉淀生成
该溶液为AgNO3溶液
B
将CO通入灼热的氧化铁粉末中
粉末由红色变为黑色
CO有还原性
C
将2根铜丝分别放入硫酸铝溶液和硝酸银溶液中,观察现象
硫酸铝溶液没有明显现象,硝酸银溶液逐渐变蓝,其中铜丝表面有银色物质析出
金属活动性顺序:Al>Cu>Ag
D
将铜片和黄铜片相互刻画
铜片上留下划痕,黄铜片无明显现象
合金硬度比组成它的纯金属硬度大
A、A B、B C、C D、D二、填空题(本题包括 3 小题,共 21 分)
-
15. 类价二维图反映的是元素的化合价与物质类别之间的关系,构建类价二维图是化学学习的重要方法。图 1 是某同学绘制的关于硫元素的类价二维图。
 (1)、a 处对应物质的类别是。(2)、类价二维图中的物质在一定条件下可以相互转化,煤炭中的硫元素一定条件下会转化为硫化氢和二氧化硫,两种气体混合发生反应,微观示意图如图 2 所示,请画出丁中的微粒示意图。该反应过程(填“有”或“没有”)元素的化合价发生变化。(3)、二氧化硫在空气中可以通过下列转化形成硫酸型酸雨:
(1)、a 处对应物质的类别是。(2)、类价二维图中的物质在一定条件下可以相互转化,煤炭中的硫元素一定条件下会转化为硫化氢和二氧化硫,两种气体混合发生反应,微观示意图如图 2 所示,请画出丁中的微粒示意图。该反应过程(填“有”或“没有”)元素的化合价发生变化。(3)、二氧化硫在空气中可以通过下列转化形成硫酸型酸雨:① ; ②。
16. 有一包固体样品,可能含碳酸钠、硫酸铁、氢氧化钠、氯化钡中的一种或几种。某兴趣小组为探究其成分做了以下实验: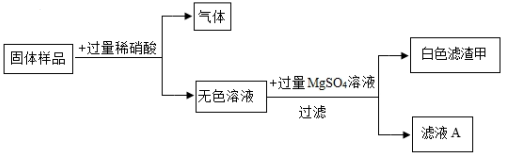
已知:氯化钡的水溶液呈中性。
(1)、向固体样品中加入过量稀硝酸,产生的气体是(写化学式),产生白色滤渣甲的化学方程式为:;(2)、原样品中一定有 , 一定没有 , 可能含有;(写化学式)(3)、滤液 A 中一定含有的阳离子是;(写离子符号)(4)、若要进一步确定样品的组成,还需进行的实验操作是:(简述操作过程,现象和结论)。17. 溴酸镉[Cd(BrO3)2]常用做分析试剂、生产荧光粉等。以镉铁矿(主要成分为 CdO2、Fe2O3以及少量的 Al2O3和 SiO2 , 其中 CdO2 的含量为 72 %)为原料制备[Cd(BrO3)2]的工艺流程如下,已知流程中加入 CH3OH 还原镉是将镉元素的化合价降低。回答下列问题: (1)、为提高镉的浸取率,酸浸时可采取升温,增大酸的浓度或的方法来提高反应速率;(2)、酸浸时 CdO2发生反应的化学方程式为:;(3)、调 pH 时可向溶液中加入适量含(填离子符号)的溶液,滤渣 1 的主要成分为 Fe(OH)3、 (填化学式);(4)、滤液 1 中可回收利用的主要物质是 (填化学式);(5)、 2000 kg 镉铁矿经上述制备流程,可制得含溴酸镉 95%的产品质量最多为 kg。(结果保留小数点后 1 位)
(1)、为提高镉的浸取率,酸浸时可采取升温,增大酸的浓度或的方法来提高反应速率;(2)、酸浸时 CdO2发生反应的化学方程式为:;(3)、调 pH 时可向溶液中加入适量含(填离子符号)的溶液,滤渣 1 的主要成分为 Fe(OH)3、 (填化学式);(4)、滤液 1 中可回收利用的主要物质是 (填化学式);(5)、 2000 kg 镉铁矿经上述制备流程,可制得含溴酸镉 95%的产品质量最多为 kg。(结果保留小数点后 1 位)三、实验题(本题包括 3 小题,共 27 分)
-
18. 下图为初中化学实验室常见的仪器装置,请回答下列问题。
 (1)、写出仪器名称:①。(2)、实验室可用 B 装置来制取 O2 , 写出反应的化学方程式:。(3)、实验室常用装置 C 代替装置 B 制取气体,装置 C 的优点是可以控制反应的开始和停止,利用装置 C 控制反应停止的方法是:(填写正确的字母顺序),反应就停止了。
(1)、写出仪器名称:①。(2)、实验室可用 B 装置来制取 O2 , 写出反应的化学方程式:。(3)、实验室常用装置 C 代替装置 B 制取气体,装置 C 的优点是可以控制反应的开始和停止,利用装置 C 控制反应停止的方法是:(填写正确的字母顺序),反应就停止了。a、液面低于隔板,与固体脱离接触 b、关闭弹簧夹 M c、U 型管右边液面下降
下列反应不适用于装置 C 的是(填字母)。
A、块状大理石和稀盐酸反应制取二氧化碳气体
B、锌片和稀硫酸反应制取氢气
C、高锰酸钾粉末和浓盐酸反应制取氯气(Cl2)
(4)、实验室用加热无水醋酸钠和碱石灰的固体混合物来制取甲烷气体,则应选择的发生装置为(填字母编号);若用装置 D 收集甲烷气体,气流方向为 进出(填“a”或“b”)。(5)、以下说法正确的是____A、装置 A 和装置 B 的气密性检查的操作方法相同 B、装置 B 发生反应时,仪器②下端需浸没在液体中 C、E 装置可用于干燥气体,气流方向为 c 进 d 出 D、若挤压 F 中试管上方的滴管,可以观察到 U 型管左边液面上升19. 已知:①NH4HCO3在 40℃受热易分解;② ,
③20℃时,NaHCO3、NH4HCO3的溶解度见下表。
物质
NaHCO3
NH4HCO3
溶解度/g
9.6
21
(1)、在 20℃时,称取 15g NH4HCO3加入 50mL 水(水的密度为 1g/mL)中,充分溶解,得到溶液(填“饱和”或“不饱和”),此时溶液的质量分数为(只列计算式),实验过程中不需要的仪器是(选填字母编号)。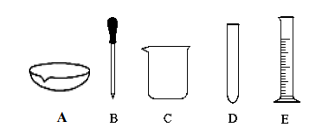 (2)、将(1)中配制的溶液平均分为 2 等份,向第一份溶液中加入足量 NaCl 固体,则最终析出 NaHCO3的质量为g(结果保留小数点后 1 位),向第二份溶液中加入适量稀盐酸,发现产生大量气泡,写出反应的化学方程式:;(3)、为探究(2)中 NaHCO3析出的最佳条件,完成了以下几组实验(其中 T1<T2<T3):
(2)、将(1)中配制的溶液平均分为 2 等份,向第一份溶液中加入足量 NaCl 固体,则最终析出 NaHCO3的质量为g(结果保留小数点后 1 位),向第二份溶液中加入适量稀盐酸,发现产生大量气泡,写出反应的化学方程式:;(3)、为探究(2)中 NaHCO3析出的最佳条件,完成了以下几组实验(其中 T1<T2<T3):实验序号
反应温度/℃
反应时间/min
NaHCO3产率/%
a
T1
60
86.8
b
T1
120
92.1
c
T2
60
X
d
T2
120
92.5
e
T3
60
85.3
f
T3
120
85.6
①实验 a 和 b 的结论是;
②表格中 X 的数值可能是(选填字母编号);
A.85.8
B.86.8
C.89.4
D.92.6③在相同反应时间,T3℃时碳酸氢钠的产率比 T1℃和 T2℃时都低,据此推测 T3≥。
20. 研究物质的分类对其性质和变化的规律有重要指导作用。(1)、硫酸铜和硫酸钠的水溶液都可以和含(填离子符号)的盐溶液反应,产生的相同现象是;(2)、已知亚硒酸钡(BaSeO3)是一种难溶于水的白色固体,可溶于稀盐酸,亚硒酸钡可用做玻璃工业的脱色剂及制红玻璃等。①亚硒酸钡(BaSeO3)与稀硝酸反应可生成硒酸钡(BaSeO4),硒酸钡(BaSeO4)中硒元素的化合价为: , 写出硒酸的化学式:;
②依据各物质之间的反应规律,设计两种制备亚硒酸钡(BaSeO3)的方案(要求依据两种不同的反应规律)。完成下表:
方案
操作
预期反应的化学方程式
①
往盛有 Na2SeO3溶液的烧杯中滴加足量溶液,充分反应后,(填操作名称)。
②
往盛有的烧杯中滴加足量溶液,充分反应后,后续操作同上。