广东省广州市从化区2023年中考化学一模试卷
试卷更新日期:2023-10-13 类型:中考模拟
一、选择题
-
1. 《内经》记载“五谷为养、五果为助、五禽为益、五菜为充”。“五禽”中主要富含的营养素是( )A、蛋白质 B、糖类 C、维生素 D、无机盐2. “一带一路(One Belt AnOne Road)”构建人类命运共同体,符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易的商品中,其主要成分不属于有机化合物的是( )A、中国丝绸 B、埃及长绒棉 C、捷克水晶主要成分是二氧化硅 D、乌克兰葵花籽油3. 化学实验过程中要规范操作,注意安全。下列有关做法正确的是( )A、稀硫酸沾到皮肤或衣物上,如果浓度不大,可不处理 B、实验室中的药品经确认无毒无害的,可以品尝一下以感受其味道 C、给烧杯中的液体加热时,烧杯下面垫石棉网 D、称量腐蚀性药品时,为避免药品腐蚀托盘,应将药品放在纸上称量4. 科学家对人类文明和社会可持续发展作出了重要贡献。下列选项正确的是( )A、拉瓦锡编制了元素周期表 B、门捷列夫提出了近代原子学说 C、道尔顿确定了空气的组成 D、屠呦呦因研究青蒿素获诺贝尔奖5. 下列有关分析中,错误的是( )A、氢气燃烧后生成水分子种类发生改变 B、压瘪的乒乓球放热水中能够鼓起来温度升高,分子数目增多 C、教室内消毒后,消毒水气味弥漫四周分子在不断地运动 D、一氧化碳和二氧化碳化学性质不同构成二者的分子不同6. 联合国确定年“世界水日”主题为“ Accelerating Change ”加速变革 , 月目至日是第三十六届“中国水周”。下列关于水的说法正确的是( )A、用明矾净水明矾可降低硬水中可溶性钙、镁化合物的含量 B、电解水反应后分子的数目变少 C、自来水是纯净物 D、可用加热蒸发的方法区分蒸馏水和氯化钾溶液7. “2015年和2020年我国新增电力装机结构对比”如图所示。下列说法错误的是( )

 A、风能、太阳能、水能都属于可再生能源 B、对比2015年和2020年,太阳能和风能占比增大 C、可再生能源的利用,可以部分解决化石能源面临耗尽的问题 D、加大化石燃料的开采使用,有利于实现“碳中和”8. 我国某科研团队研究了一种利用半导体光催化氮气制备氨气的方法,该方法因具有高效、清洁的优点而引起极大的关注,其过程示意图如图所示。下列说法错误的是( )
A、风能、太阳能、水能都属于可再生能源 B、对比2015年和2020年,太阳能和风能占比增大 C、可再生能源的利用,可以部分解决化石能源面临耗尽的问题 D、加大化石燃料的开采使用,有利于实现“碳中和”8. 我国某科研团队研究了一种利用半导体光催化氮气制备氨气的方法,该方法因具有高效、清洁的优点而引起极大的关注,其过程示意图如图所示。下列说法错误的是( ) A、该反应的生成物只有 B、半导体是该反应的催化剂 C、工业上通过分离液态空气得到氮气 D、该反应前后元素的种类没有发生变化9. 我国自主知识产权的抗癌新药“西达本胺”已全球上市。西达本胺的化学式为 , 下列有关西达本胺的说法正确的是( )A、西达本胺由碳、氢、氟、氮、氧五种原子构成 B、碳元素的质量分数为 C、西达本胺由五种元素组成 D、西达本胺中、、、、元素的质量比为::::10. 氢气与乙烯在催化剂金属镍表面反应生成乙烷,微观过程如图所示。下列说法错误的是( )
A、该反应的生成物只有 B、半导体是该反应的催化剂 C、工业上通过分离液态空气得到氮气 D、该反应前后元素的种类没有发生变化9. 我国自主知识产权的抗癌新药“西达本胺”已全球上市。西达本胺的化学式为 , 下列有关西达本胺的说法正确的是( )A、西达本胺由碳、氢、氟、氮、氧五种原子构成 B、碳元素的质量分数为 C、西达本胺由五种元素组成 D、西达本胺中、、、、元素的质量比为::::10. 氢气与乙烯在催化剂金属镍表面反应生成乙烷,微观过程如图所示。下列说法错误的是( ) A、反应物
A、反应物 和
和 的分子个数比为:
B、
的分子个数比为:
B、 的化学式为
C、反应物中单质的名称为氢气
D、反应物
的化学式为
C、反应物中单质的名称为氢气
D、反应物 和生成物
和生成物 的质量比是:
11. 下列有关物质的性质与用途对应关系正确的是( )A、石墨质软,可用作电池电极 B、氮气难溶于水,可用作保护气 C、醋酸有挥发性,可用于除水垢 D、固体氢氧化钠有吸水性,可用作干燥剂12. 下列有关碳和碳的氧化物的说法正确的是( )A、碳的单质都是黑色固体 B、金刚石和石墨中碳原子的排列方式相同 C、一氧化碳具有还原性,可用于冶炼金属 D、二氧化碳属于大气污染物,大量排放会导致温室效应加剧13. 下列实验方案设计合理的是( )
的质量比是:
11. 下列有关物质的性质与用途对应关系正确的是( )A、石墨质软,可用作电池电极 B、氮气难溶于水,可用作保护气 C、醋酸有挥发性,可用于除水垢 D、固体氢氧化钠有吸水性,可用作干燥剂12. 下列有关碳和碳的氧化物的说法正确的是( )A、碳的单质都是黑色固体 B、金刚石和石墨中碳原子的排列方式相同 C、一氧化碳具有还原性,可用于冶炼金属 D、二氧化碳属于大气污染物,大量排放会导致温室效应加剧13. 下列实验方案设计合理的是( )选项
实验目的
实验方案
检验雨水是否为酸雨
测 , 若小于则为酸雨
鉴别和
分别加入熟石灰研磨,闻气味
除去中少量的
加热固体混合物
除去溶液中的少量
滴加适量稀盐酸
A、 B、 C、 D、14. 下列实验的现象与结论相符合的是( )A
B
C
D
实验
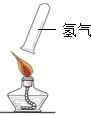
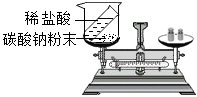


现象
点燃时发出尖锐的爆鸣声
反应后天平不平衡
烧杯内壁有水珠
加热铜片,木屑先燃烧,煤粉后燃烧
结论
氢气纯净
该反应不符合质量守恒定律
甲烷中含有氢元素和氧元素
燃烧条件之一:温度达到可燃物的着火点
A、A B、B C、C D、D二、非选择题
-
15. 北斗三号卫星上采用了我国自主研发的更高稳定度、更小漂移率的新型高精度铷原子钟和氢原子钟,实现了卫星时频基准性能指标的大幅提升。(1)、铷元素及其原子结构信息如图所示,铷的相对原子质量为 。
 (2)、铷应用的主要市场之一为特种玻璃。含铷的特种玻璃已大量应用于通讯光纤和夜视设备。这类特种玻璃具备特殊性能的主要原因之一就是添加了碳酸铷,写出碳酸铷的化学式 。(3)、铷是银白色蜡状金属,化学性质活泼,常温下能与水发生剧烈的置换反应,生成碱和一种可燃性气体。此反应的化学方程式为 。(4)、氚是指核内有个质子和个中子的氢原子,下列示意图能正确表示氚原子结构的是 填标号。
(2)、铷应用的主要市场之一为特种玻璃。含铷的特种玻璃已大量应用于通讯光纤和夜视设备。这类特种玻璃具备特殊性能的主要原因之一就是添加了碳酸铷,写出碳酸铷的化学式 。(3)、铷是银白色蜡状金属,化学性质活泼,常温下能与水发生剧烈的置换反应,生成碱和一种可燃性气体。此反应的化学方程式为 。(4)、氚是指核内有个质子和个中子的氢原子,下列示意图能正确表示氚原子结构的是 填标号。 16. 金属材料在人类文明的发展中起着重要作用,古代冶金技术彰显了我国劳动人民的智慧。(1)、战国韩非子内储说上提到,早期采金技术均是“沙里淘金”。金在自然界中主要以 填“单质”或“化合物”形式存在。(2)、北宋沈括所著的梦溪笔谈中记载了“湿法炼铜”的方法:“繁胆矾铁釜,久之亦化为铜”。即在“铁釜”中加入硫酸铜溶液,则可得到铜。写出“铁釜”中发生反应的化学方程式 。(3)、明代宋应星所著的天工开物一书,介绍了“火法炼锌”的方法:把炉甘石和煤炭饼装入炼锌罐,如图所示,泥封,“其底铺薪,发火煅红,冷定毁罐取出”。
16. 金属材料在人类文明的发展中起着重要作用,古代冶金技术彰显了我国劳动人民的智慧。(1)、战国韩非子内储说上提到,早期采金技术均是“沙里淘金”。金在自然界中主要以 填“单质”或“化合物”形式存在。(2)、北宋沈括所著的梦溪笔谈中记载了“湿法炼铜”的方法:“繁胆矾铁釜,久之亦化为铜”。即在“铁釜”中加入硫酸铜溶液,则可得到铜。写出“铁釜”中发生反应的化学方程式 。(3)、明代宋应星所著的天工开物一书,介绍了“火法炼锌”的方法:把炉甘石和煤炭饼装入炼锌罐,如图所示,泥封,“其底铺薪,发火煅红,冷定毁罐取出”。
炉甘石加入锌罐之前,先将其粉碎的目的是 。
反应区中,炉甘石在高温下分解生成氧化锌,煤炭中的碳与氧化锌反应生成锌和二氧化碳,该反应的化学方程式是 ,该反应中体现了碳的 填“还原性”或“氧化性”。
必须“冷定”后才能“毁罐”取锌,请从化学变化的角度解释其原因 。
17. 镉及其化合物在电镀、电池、颜料等领域中有广泛应用。镉是一种“氢前金属”,金属活动性介于锌和铜之间。镉元素常见化合价为。(1)、镉的氧化物的化学式为 。(2)、氢氧化镉是难溶于水的白色结晶性粉末。下述信息中能用于推测氢氧化镉化学性质的是 填标号。
A.“氢氧化镉”
B.“难溶于水”
C.“白色结晶性粉末”
取少量氢氧化镉固体于试管中,加入无色溶液 , 充分振荡后固体完全溶解,溶液可能是 或 。
(3)、设计金属镉转化为氢氧化镉的一种方案: 依次写出化学方程式。18. 物质的分离与提纯是利用物质的性质差异,可以通过物理方法或化学方法对混合物进行分离提纯,获取有用物质。(1)、我国古代提纯焰硝含和少量、等获得农用硝酸钾,主要流程如下:
农用为农作物提供的营养元素有 。
步骤Ⅲ加小灰水含时,发生反应的化学方程式为 。
(2)、结合如图溶解度曲线分析:
步骤Ⅳ在较高温度下过滤的目的是 。
步骤Ⅴ放置天后可析出硝酸钾晶体的原因是 。
"溶液2"除了含有、外,还含有的离子有 填离子符号。
19. 纯碱是一种重要的化工原料,广泛用于玻璃、造纸、纺织和洗涤剂的生产。某化学兴趣小组对纯碱的制备、性质等开展项目式学习。
(1)、任务一:了解纯碱的制备一“侯氏制碱法”“侯氏制碱法”主要化学原理是利用饱和氯化钠溶液吸收两种气体,生成碳酸氢钠和氯化铵 , 再加热碳酸氢钠即可制得纯碱。
纯碱属于 填“酸”、“碱”或“盐”。
饱和氯化钠溶液吸收的两种气体是 填标号。
A.
B.
C.
D.
(2)、任务二:探究纯碱的性质溶液呈碱性【查阅资料】
资料:溶液呈碱性,是因为溶液中存在较多的
资料:在水中全部解离出和。
资料:溶液呈中性、对溶液的酸碱性没有影响。
【提出猜想】
猜想一:单独起作用,产生较多的 , 使溶液呈碱性。
猜想二:与作用,产生较多的 , 使溶液呈碱性。
猜想三:
(3)、【实验探究】实验操作
实验现象
实验结论
实验:向试管中加入一定量的蒸馏水,滴入滴酚酞溶液。
溶液无明显变化
猜想一不成立
实验:向试管中加入一定量的溶液,滴入滴酚酞溶液。
猜想二不成立
实验:步骤:向试管中加入一定量的溶液,滴入滴酚酞溶液。步骤:往步骤所得溶液中逐滴加入溶液至过量
溶液由无色变红色
猜想三成立
【解释与结论】同学们和老师交流,得知溶液中一部分的和作用,产生较多的
(4)、【拓展与延伸】结合任务二的所有信息和结论,运用初中化学所学知识,经过分析推理可得出:溶液中含有的阴离子是 。(5)、任务三:测定纯碱样品中的质量分数【实验方案】取纯碱样品加足量水溶解,向溶液中加入足量溶液,搅拌至反应完全,过滤、洗涤、干燥,称量沉淀的质量为 , 则样品含的质量分数为 。
相对分子质量: )
20. 研究和控制化学反应条件有重要意义。(1)、小嘉同学用的溶液制取氧气时发现,若注入溶液速度过快,反应会过于剧烈而引发事故。请你帮小嘉从如图中选择合适的仪器组装一套发生装置,要求能解决上述问题,需要用到的仪器有哪些? 填标号。 (2)、小明同学用溶质质量分数为的过氧化氢溶液制氧气,为了减小反应速率,他先向该过氧化氢溶液中加入水,再用稀释后的溶液制取气体,求稀释后过氧化氢溶液的溶质质量分数 。(3)、某小组同学研究大理石与稀盐酸反应制取二氧化碳受哪些因素影响,该小组的实验设计和数据记录如下表。
(2)、小明同学用溶质质量分数为的过氧化氢溶液制氧气,为了减小反应速率,他先向该过氧化氢溶液中加入水,再用稀释后的溶液制取气体,求稀释后过氧化氢溶液的溶质质量分数 。(3)、某小组同学研究大理石与稀盐酸反应制取二氧化碳受哪些因素影响,该小组的实验设计和数据记录如下表。实验编号
稀盐酸的体积
稀盐酸的质量分数
大理石的形状
二氧化碳的体积
实验
块状
实验
粉末
实验
块状
实验
粉末
丢失
写出大理石与稀盐酸反应生成气体的化学方程式 。
该小组研究了哪些因素对反应快慢的影响? 。
为了分析浓度对反应快慢的影响,可对比表中实验 填标号。
A.和
B.和
C.和
D.和
由于没有及时记录数据,导致第组实验数据丢失,你认为合理的数据是 填标号。
A.
B.
C.
下表是某同学实验过程中的数据。
时段秒
的体积
由上述表格可知,从第秒开始反应的速率减慢,其原因是 。
(4)、某兴趣小组在老师指导下继续探究了浓盐酸与大理石的反应,并用传感器测得下图烧杯中溶液的随通入气体时间的变化曲线。请回答下列问题:
段几乎不变的原因可能是 。
段发生反应的化学方程式主要有 。