内蒙古自治区包头市2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、选择题:本题包括25小题,1-20每小题2分,21-25每小题3分,共55分。在每小题给出的四个选项中,只有一项符合题目要求的。
-
1. 开发新材料是现代科技发展的方向之一。下列有关材料属于新型无机非金属材料的是( )




A.口罩中使用的聚丙烯熔喷布
B.宇航服中使用的合成纤维
C.“瑞雪祥云”礼仪服智能发热使用的石墨烯
D.飞机风挡使用的有机玻璃
A、A B、B C、C D、D2. 据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫黄)能化金银钢铁,奇物”。硫与某些金属单质化合所得的产物可能是( )A、 B、 C、 D、3. 化学科学需要借助化学专用语言描述。下列有关化学用语正确的是( )A、乙烯的结构简式: B、羟基的电子式: C、四氯化碳分子的空间填充模型: D、乙酸分子的球棍模型
D、乙酸分子的球棍模型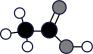 4. 下列做法的目的与反应速率无关的是( )A、高炉炼铁前先将铁矿石粉碎 B、食盐中添加碘酸钾 C、在糕点包装内放置小包除氧剂 D、医护人员冷藏存放“新冠”疫苗5. 自然资源的综合利用对人类极其重要,下列资源的开发利用中,不涉及化学变化的是( )A、煤的气化 B、煤的干馏 C、石油的分馏 D、石油的裂化6. 化学与生活紧密相关。下列有关说法不正确的是( )A、乙醇具有还原性,利用乙醇与酸性反应检验“酒驾” B、能使蛋白质变性,可用于游泳池的消毒 C、葡萄糖可以使新制的氢氧化铜转化成砖红色沉淀,可以用来检测病人尿液中的葡萄糖 D、广告标“品牌八宝粥用糯米、红豆、桂圆等制作,未加糖。”糖尿病患者可放心食用7. 如图是某食品包装袋,下列说法不正确的是( )
4. 下列做法的目的与反应速率无关的是( )A、高炉炼铁前先将铁矿石粉碎 B、食盐中添加碘酸钾 C、在糕点包装内放置小包除氧剂 D、医护人员冷藏存放“新冠”疫苗5. 自然资源的综合利用对人类极其重要,下列资源的开发利用中,不涉及化学变化的是( )A、煤的气化 B、煤的干馏 C、石油的分馏 D、石油的裂化6. 化学与生活紧密相关。下列有关说法不正确的是( )A、乙醇具有还原性,利用乙醇与酸性反应检验“酒驾” B、能使蛋白质变性,可用于游泳池的消毒 C、葡萄糖可以使新制的氢氧化铜转化成砖红色沉淀,可以用来检测病人尿液中的葡萄糖 D、广告标“品牌八宝粥用糯米、红豆、桂圆等制作,未加糖。”糖尿病患者可放心食用7. 如图是某食品包装袋,下列说法不正确的是( )配料:猪肉、鸡肉、水、淀粉、蛋液、白砂糖、植物蛋白、食用盐。食品添加剂:增稠剂、水分保持剂、食用香精、增味剂、山梨酸钾、红曲红、亚硝酸钠、猪骨提取物。
A、谷氨酸钠是增味剂的一种 B、山梨酸钾是一种营养强化剂 C、红曲红是一种着色剂 D、亚硝酸钠是一种护色剂和防腐剂8. 浓硫酸有许多重要的性质,在与含有水分的蔗糖作用过程中不能显示的性质是( )A、吸水性 B、脱水性 C、酸性 D、强氧化性9. 北京大学和中国科学院的化学工作者已成功研制出碱金属与形成的球碳盐 , 实验测知该物质在熔融状态下能导电,具有良好的超导性。下列有关分析不正确的是( )A、中含有离子键 B、中含有非极性共价键 C、该晶体熔化过程中破坏了离子键 D、与互为同位素10. 下列实验装置能达到实验目的的是( )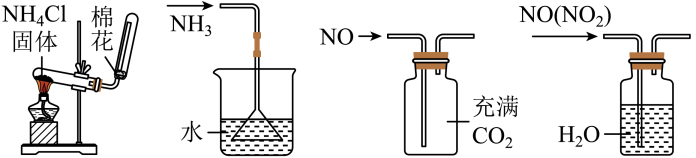 A、制备氨气 B、防止倒吸 C、收集气体 D、除去中的11. 目前国际空间站处理CO2废气涉及的反应为CO2+4H2 CH4+2H2O。下列关于该反应的说法正确的是( )A、升高温度能减慢该反应的速率 B、钌催化剂能加快该反应的速率 C、达到平衡时,v(正)=v(逆)=0 D、达到平衡时,CO2能100%转化为CH412. 沙子的主要成分是 , 属于酸性氧化物,部分性质与、类似。下列关于性质的预测正确的是( )A、能与水反应生成硅酸 B、属于酸性氧化物,不与任何酸反应 C、能与氢氧化钠溶液反应生成和 D、是良好的半导体材料13. 当运动员肌肉受伤时,医生会随即对准运动员的受伤部位喷射药剂氯乙烷(化学式为 , 沸点为),进行局部冷冻麻醉处理,下列说法正确的是( )A、氯乙烷属于烷烃 B、制取氯乙烷最好的方法是,乙烷与发生取代反应 C、制取氯乙烷最好的方法是,乙烯与发生加成反应 D、决定氯乙烷能用于冷冻麻醉应急处理的具体性质是,氯乙烷的沸点低,易汽化而吸收热量,使局部冷冻麻碎14. 下列反应的离子方程式书写正确的是( )A、室温下用稀硝酸溶解 B、向溶液中通入少量 C、碱性亚硫酸钠溶液处理纸浆中的残氯: D、食醋除去瓶胆内的水垢:15. 四氯乙烯(
A、制备氨气 B、防止倒吸 C、收集气体 D、除去中的11. 目前国际空间站处理CO2废气涉及的反应为CO2+4H2 CH4+2H2O。下列关于该反应的说法正确的是( )A、升高温度能减慢该反应的速率 B、钌催化剂能加快该反应的速率 C、达到平衡时,v(正)=v(逆)=0 D、达到平衡时,CO2能100%转化为CH412. 沙子的主要成分是 , 属于酸性氧化物,部分性质与、类似。下列关于性质的预测正确的是( )A、能与水反应生成硅酸 B、属于酸性氧化物,不与任何酸反应 C、能与氢氧化钠溶液反应生成和 D、是良好的半导体材料13. 当运动员肌肉受伤时,医生会随即对准运动员的受伤部位喷射药剂氯乙烷(化学式为 , 沸点为),进行局部冷冻麻醉处理,下列说法正确的是( )A、氯乙烷属于烷烃 B、制取氯乙烷最好的方法是,乙烷与发生取代反应 C、制取氯乙烷最好的方法是,乙烯与发生加成反应 D、决定氯乙烷能用于冷冻麻醉应急处理的具体性质是,氯乙烷的沸点低,易汽化而吸收热量,使局部冷冻麻碎14. 下列反应的离子方程式书写正确的是( )A、室温下用稀硝酸溶解 B、向溶液中通入少量 C、碱性亚硫酸钠溶液处理纸浆中的残氯: D、食醋除去瓶胆内的水垢:15. 四氯乙烯(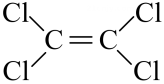 )是一种衣物干洗剂,聚四氟乙烯()是家用不粘锅内侧涂层的主要成分。下列关于四氯乙烯和聚四氟乙烯的叙述正确的是( ) A、它们都属于混合物 B、四氯乙烯中含有两种官能团 C、聚四氟乙烯的单体是 D、它们都能使酸性高锰酸钾溶液褪色16. 空气吹出法是海水提溴的常用方法,其工艺流程如图所示,下列说法错误的是( )A、热空气吹出 , 利用了溴的挥发性 B、通发生的主要反应均为 C、溴水混合物1到溴水混合物2的目的是富集溴元素 D、该流程体现出氧化性强弱:17. 中科院研制出一种多功能催化剂,首次实现将转化为汽油,过程示意图如下。下列说法错误的是( )
)是一种衣物干洗剂,聚四氟乙烯()是家用不粘锅内侧涂层的主要成分。下列关于四氯乙烯和聚四氟乙烯的叙述正确的是( ) A、它们都属于混合物 B、四氯乙烯中含有两种官能团 C、聚四氟乙烯的单体是 D、它们都能使酸性高锰酸钾溶液褪色16. 空气吹出法是海水提溴的常用方法,其工艺流程如图所示,下列说法错误的是( )A、热空气吹出 , 利用了溴的挥发性 B、通发生的主要反应均为 C、溴水混合物1到溴水混合物2的目的是富集溴元素 D、该流程体现出氧化性强弱:17. 中科院研制出一种多功能催化剂,首次实现将转化为汽油,过程示意图如下。下列说法错误的是( )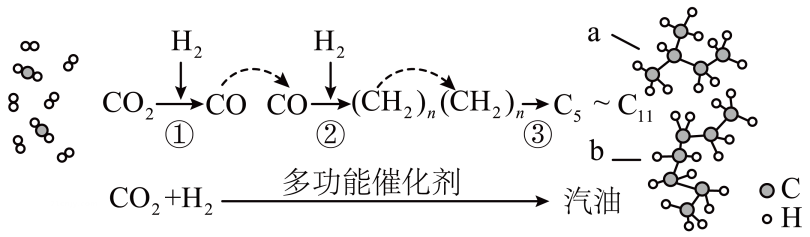 A、该技术能助力“碳中和”(二氧化碳“零排放”)的战略愿景 B、汽油主要是的烃类混合物,其中b的沸点高于a C、产物中a和b互为同系物,b的一氯代物有4种 D、反应②为加成反应,原子利用率为 , 符合绿色化学的要求18. 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,b为正极;c、d相连时,电流由d到c;a、c相连时,c上产生大量气泡,b、d相连时,d溶解减重,则四种金属的活动性顺序由强到弱的是( )A、 B、 C、 D、19. 某同学设计了下图所示两个实验装置(图I、图Ⅱ中除连接的铜棒不同外,其他均相同),下列有关说法正确的是( )
A、该技术能助力“碳中和”(二氧化碳“零排放”)的战略愿景 B、汽油主要是的烃类混合物,其中b的沸点高于a C、产物中a和b互为同系物,b的一氯代物有4种 D、反应②为加成反应,原子利用率为 , 符合绿色化学的要求18. 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,b为正极;c、d相连时,电流由d到c;a、c相连时,c上产生大量气泡,b、d相连时,d溶解减重,则四种金属的活动性顺序由强到弱的是( )A、 B、 C、 D、19. 某同学设计了下图所示两个实验装置(图I、图Ⅱ中除连接的铜棒不同外,其他均相同),下列有关说法正确的是( )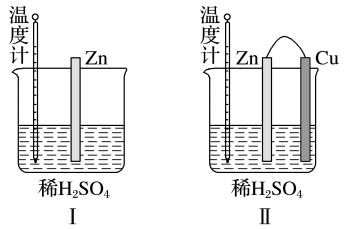 A、图I中锌棒溶解的速率比图Ⅱ的快 B、图I中温度计的示数高于图Ⅱ的示数 C、图I和图Ⅱ中温度计示数相等,且均高于室温 D、图I和图Ⅱ的气泡均产生于锌棒表面20. 下列有关“实验操作”“现象”及“实验结论”都正确的是( )
A、图I中锌棒溶解的速率比图Ⅱ的快 B、图I中温度计的示数高于图Ⅱ的示数 C、图I和图Ⅱ中温度计示数相等,且均高于室温 D、图I和图Ⅱ的气泡均产生于锌棒表面20. 下列有关“实验操作”“现象”及“实验结论”都正确的是( )选项
实验操作
现象
实验结论
A
取少量涂改液,向其中加入硝酸酸化的硝酸银溶液
无白色沉淀
涂改液中不存在氯元素
B
取溶液于试管中,加入溶液,充分反应后滴入几滴溶液
溶液变血红色
与的反应有一定限度
C
向蔗糖溶液中加入少量稀 , 加热,再加入银氨溶液
无银镜产生
蔗糖没有发生水解
D
向某溶液中加入溶液并加热,用湿润的红色石蕊试纸靠近试管口
试纸变蓝
该溶液中存在
A、A B、B C、C D、D21. 有机物R是金银花的一种成分,具有广谱抗病毒功效,键线式为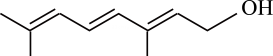 (已知的键线式为
(已知的键线式为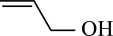 )。下列说法错误的是( ) A、R的分子式为 B、用酸性高锰酸钾溶液可以确认R含碳碳双键 C、R分子中所有碳原子可能共平面 D、R能发生加成、氧化、取代反应22. 近年来电池研究领域涌现出纸电池,它像纸一样轻薄柔软,其结构如下图所示。某同学据此利用质量相同的铜片和镁片,电解液(溶液)和隔离膜制作简易电池。下列关于其放电过程说法正确的是( )
)。下列说法错误的是( ) A、R的分子式为 B、用酸性高锰酸钾溶液可以确认R含碳碳双键 C、R分子中所有碳原子可能共平面 D、R能发生加成、氧化、取代反应22. 近年来电池研究领域涌现出纸电池,它像纸一样轻薄柔软,其结构如下图所示。某同学据此利用质量相同的铜片和镁片,电解液(溶液)和隔离膜制作简易电池。下列关于其放电过程说法正确的是( ) A、铜片为负极 B、电子由镁片经隔离膜流向铜片 C、导线中转移时,两极质量差为 D、将铜片换为铝片,电解液换为溶液,负极为镁片23. 短周期主族元素W、X、Y、Z、Q的原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )
A、铜片为负极 B、电子由镁片经隔离膜流向铜片 C、导线中转移时,两极质量差为 D、将铜片换为铝片,电解液换为溶液,负极为镁片23. 短周期主族元素W、X、Y、Z、Q的原子序数依次增大,形成的化合物是一种重要的食品添加剂,结构如图。Z核外最外层电子数与X核外电子总数相等。W的原子半径在周期表中最小。下列有关叙述正确的是( )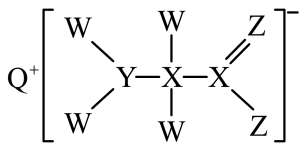 A、简单离子半径大小: B、氢化物的沸点: C、化合物中所有原子均满足8电子稳定结构 D、Y元素对应的单质与Z元素对应的单质在常温下能反应24. 某反应在体积为的密闭容器中进行,从各物质的量的变化情况如图所示(A、B、C均为气体)。下列说法正确的是( )
A、简单离子半径大小: B、氢化物的沸点: C、化合物中所有原子均满足8电子稳定结构 D、Y元素对应的单质与Z元素对应的单质在常温下能反应24. 某反应在体积为的密闭容器中进行,从各物质的量的变化情况如图所示(A、B、C均为气体)。下列说法正确的是( )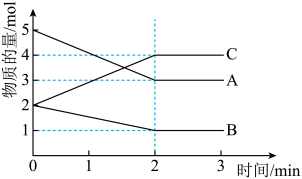 A、该反应的化学方程式为 B、说明该反应已达到平衡状态 C、由图求得A的平衡时的转化率为 D、反应开始至时,A的平均反应速率为25. 硝酸工业尾气中的、进入大气后,会形成光化学烟雾、破坏臭氧层等。可用溶液对含氨氧化物的废气进行处理,反应的化学方程式如下:① , ② , 将一定量和的混合气体通入溶液中,恰好被完全吸收。下列说法不正确的是( )A、原混合气体中在标准状况下的体积可能为 B、通入的混合气体在标况下的体积可能为 C、原混合气体中与的体积之比可能是 D、所得溶液中和的物质的量之比可能为1:2
A、该反应的化学方程式为 B、说明该反应已达到平衡状态 C、由图求得A的平衡时的转化率为 D、反应开始至时,A的平均反应速率为25. 硝酸工业尾气中的、进入大气后,会形成光化学烟雾、破坏臭氧层等。可用溶液对含氨氧化物的废气进行处理,反应的化学方程式如下:① , ② , 将一定量和的混合气体通入溶液中,恰好被完全吸收。下列说法不正确的是( )A、原混合气体中在标准状况下的体积可能为 B、通入的混合气体在标况下的体积可能为 C、原混合气体中与的体积之比可能是 D、所得溶液中和的物质的量之比可能为1:2二、填空题(本题包括4小题,共45分)
-
26.(1)、I.分子模型可以帮助同学们认识有机物的微观结构,几种烃的分子模型如下图。
写出③的属于链状烷烃的同分异构体的结构简式:。 (2)、等质量的②、③、④完全燃烧时,消耗氧气的质量从大到小的顺序为(填序号)。(3)、Ⅱ.G是石油化工的重要产品,某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图:
(2)、等质量的②、③、④完全燃烧时,消耗氧气的质量从大到小的顺序为(填序号)。(3)、Ⅱ.G是石油化工的重要产品,某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高综合效益,而且还能防止环境污染,生产流程如图:
B中的官能团的名称为 , G→C的反应类型为。(4)、C→D的化学反应方程式为。(5)、实验室中制备F的反应装置如图所示:
①与教材中采用的实验装置不同,此装置中采用了球形干燥管,其作用是。试管a中加入的化学试剂是。
②若实验中用含的C与E反应则E→F的化学方程式为。
27. 我国空间站“天和”核心舱太阳翼电池采用自主研发的砷化镓器件,能量转化效率大大提高。已知:砷()与镓()同位于第四周期;与同主族,与P同主族。(1)、P在元素周期表中的位置是 , 镓的原子结构示意图为。(2)、非金属性强弱SP(填“大于”或“小于”),下列表述中能证明这一事实的是(填字母)。a.S的简单氢化物的水溶液比P的简单氢化物的水溶液酸性强
b.S最高价氧化物对应的水化物的酸性强于P最高价氧化物对应的水化物的酸性
c.在反应中,P原子得电子数比S原子得电子数多
d.S的简单阴离子的还原性比P的简单阴离子的还原性弱
(3)、下列关于的推断正确的是(填序号)。①的最高正价为②原子半径: , ③元素的金属性:
(4)、 , 的酸性由强到弱的关系是。(5)、与在一定条件下化合为 , 用电子式表示的形成过程:。28. 某化学兴趣小组在实验室用除去表面氧化物的铁钉(碳素钢)与浓硫酸共热制取 , 并完成相关性质探究(不考虑水蒸气)。(1)、I.实验验证气体成分:兴趣小组同学设计了如图所示装置进行了实验探究。
为验证并吸收 , 装置B中加入的试剂为;装置C中品红溶液的作用是。 (2)、装置D中加入的试剂为。(3)、装置H的作用为。(4)、Ⅱ.实验探究的还原性:将分别通入无氧、有氧且浓度均为的溶液和2溶液中,探究和哪种微粒起到了主要氧化作用,实验记录如下:
(2)、装置D中加入的试剂为。(3)、装置H的作用为。(4)、Ⅱ.实验探究的还原性:将分别通入无氧、有氧且浓度均为的溶液和2溶液中,探究和哪种微粒起到了主要氧化作用,实验记录如下:
曲线a所示溶液降低,说明能与水反应生成(填化学式);pH变化 溶液中是否产生沉淀 
溶液(无氧)中无白色沉淀 溶液(有氧)中有白色沉淀 溶液(无氧)中有白色沉淀 溶液(有氧)中有白色沉淀 (5)、曲线b所示溶液中的反应可按如下方式进行,请完成并配平该离子方程式:(6)、结合上述实验,可以推测,溶液(有氧)中,氧化的主要微粒是 , 其理由是。29. 汽车工业的发展得益于化工等行业的支撑。(1)、三种可燃物在空气中发生燃烧反应的能量变化示意图如图,你认为可燃物(填“A”、“B”或“C”)更适合用作车用燃料。(已知:燃点是指在规定的条件下,应用外部热源使物质表面起火并持续燃烧一定时间所需的最低温度,燃点较低时存在安全隐患。) (2)、燃油汽车尾气有污染,尾气中生成过程中的能量变化如图所示。
(2)、燃油汽车尾气有污染,尾气中生成过程中的能量变化如图所示。
生成(填“吸收”或“放出”)的热量。
(3)、利用催化技术可将汽车尾气中的和转化为和 , 化学方程式为:①某温度下,在容积的密闭容器中通入和 , 测得不同时间如下表:
时间/s
0
1
2
3
……
……
用的浓度变化表示的平均反应速率为。
②下列可以表明上述反应已达到平衡状态的是。
a.容器中的气体压强保持不变 b.的浓度之比为
c.的浓度不再改变 d.相同时间内,反应消耗同时消耗
(4)、国家电投氢能公司全自主研发的“氢腾”燃料电池系统广泛应用于氢能大巴。某种氢燃料电池的内部结构如图,下列说法正确的是( ) A、电池工作时,电解质溶液中的向b极移动 B、a极发生的电极反应为 C、b极为正极,发生氧化反应 D、当外电路有电子转移时,b极消耗
A、电池工作时,电解质溶液中的向b极移动 B、a极发生的电极反应为 C、b极为正极,发生氧化反应 D、当外电路有电子转移时,b极消耗