海南省海口市名校2022-2023学年高一下学期期末考试化学试题
试卷更新日期:2023-10-07 类型:期末考试
一、选择题:本题共8小题,每小题2分,共16分。在每小题给出的四个选项中,只有一项是符合题目要求的。
-
1. 从科技前沿到日常生活,化学无处不在。下列说法错误的是( )A、在三星堆“祭祀坑”提取到丝绸制品残留物,其中丝绸主要成分为蛋白质 B、2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于有机高分子材料 C、“天和”核心舱中使用陶瓷基复合材料中的氮化硼属于硅酸盐材料 D、“空气捕捉”法能实现从空气中捕获二氧化碳,利于碳中和2. 中国古代文献和诗句中涉及许多化学知识。下列说法错误的是( )A、《天工开物》记载“矿灰形者,取入缸中,浸三个时,漉入釜中”包含过滤操作 B、《梦溪笔谈》记载“方家以磁石磨针,则能指南”,磁石的主要成分是 C、“爆竹声中一岁除,春风送暖入屠苏”中爆竹爆炸发生的反应为氧化还原反应 D、“青蒿一握,以水二升渍,绞取法”,屠呦呦对青蒿素的提取属于物理变化3. 生产、生活中处处有化学。下列说法正确的是( )A、草木灰与硫酸铵混用可提高肥效 B、喝牛奶可缓解重金属盐中毒的毒性 C、石油分馏时获取的馏分均为纯净物 D、用来做燃料的煤和天然气是可再生能源4. 下列实验中,所采取的分离或提纯方法与对应原理都正确的是( )
选项
实验目的
分离或提纯方法
原理
A
分离食用油和汽油
分液
食用油和汽油的密度不同
B
分离溶于水中的溴
乙醇萃取
溴在乙醇中的溶解度较大
C
除去乙烷中的乙烯
通过酸性KMnO4溶液洗气
乙烯与酸性KMnO4溶液反应
D
除去碘中的NaCl
加热、升华
NaCl的熔点高,碘易升华
A、A B、B C、C D、D5. 工业炼铁是在高炉中进行的,高炉炼铁的主要反应是:①;②。该炼铁工艺中,对焦炭的实际使用量要远远高于按照化学方程式计算所需。其主要原因是( )A、过量 B、与铁矿石接触不充分 C、炼铁高炉的高度不够 D、上述反应有一定的限度6. 用表示阿伏加德罗常数的值,下列说法中正确的是( )A、0.01mol中含有的质子数为 B、4.48L与的混合物所含分子数为 C、3.2g与的混合物中所含氧原子数为 D、标准状况下,22.4L和的混合气体中含碳原子数为7. 下列有关酸雨的说法中不正确的是( )A、硫酸型酸雨形成的主要原因是生活生产中含硫燃料的大量燃烧 B、汽车尾气中的主要源自于汽油中的含氮物质 C、用天然气代替含硫的煤作燃料,可有效控制酸雨的形成 D、酸雨能直接破坏农作物、腐蚀建筑物及工业设备8. 食品添加剂是指为改善食品品质和色、香、味以及防腐、保鲜和加工工艺的需要而加入食品中的人工合成或天然物质。下列食品添加剂中,其使用目的与反应速率有关的是( )A、抗氧化剂 B、调味剂 C、着色剂 D、营养强化剂二、选择题:本题共6小题,每小题4分,共24分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选得0分;若正确答案包括两个选项,只选一个且正确得2分,选两个且都正确的给4分,但只要选错一个就得0分。
-
9. 下列各组材料组成如图装置,能形成原电池且M做正极的是( )
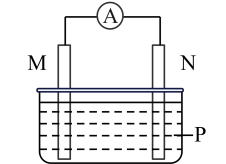
选项
M
N
P
A
稀硫酸
B
蔗糖溶液
C
溶液
D
溶液
A、A B、B C、C D、D10. 下列工业生产中采用的措施与目的相符合的是( )A、高炉炼铁时通过加入过量铁矿石提高化学反应速率 B、硫酸工业中用热交换器,以维持反应条件、节约能源 C、合成氨中循环利用、 , 以提高产率、降低成本 D、海带提碘时通过浓缩提高 , 以减少氧化剂的用量11. 海水资源综合利用的部分过程如下图所示,下列说法错误的是( )海水
→淡化:淡水
→制盐工业:粗盐→精盐
→制溴工业:
→制镁工业:
A、蒸馏海水可获得淡水 B、为除粗盐中的、、 , 可依次加入足量的、、溶液 C、在制溴工业中,通过氧化、还原、再氧化的步骤实现了溴的富集 D、在制镁工业中,可用贝壳为原料生产石灰乳以沉淀12. 把一定质量的铜完全溶解于某浓度的硝酸中收集到0.3mol和0.2mol。向反应后的溶液中加入足量溶液充分反应,经过滤、洗涤后,把所得沉淀加热至质量不再减少为止,得到固体质量为( )A、24g B、36g C、40g D、44.1g13. 已知有机物M、N、W能发生下列反应,下列说法不正确的是( ) A、M的一氯代物有3种 B、W分子中所有碳原子不可能共平面 C、该反应原子利用率为100% D、M、N分子中碳碳双键的数目比为3:114. 实验室制取下列气体,所选反应试剂、制备装置与收集方法都合理的是( )
A、M的一氯代物有3种 B、W分子中所有碳原子不可能共平面 C、该反应原子利用率为100% D、M、N分子中碳碳双键的数目比为3:114. 实验室制取下列气体,所选反应试剂、制备装置与收集方法都合理的是( )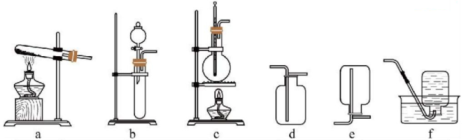
选项
气体
反应试剂
制备装置
收集方法
A
、
a
f
B
、稀硫酸
b
e
C
、浓硝酸
c
d
D
、70%硫酸
b
f
A、A B、B C、C D、D三、非选择题:共5题,60分。
-
15. 铝是一种重要金属,从铝土矿(主要成分为 , 、等)中冶炼的工业生产流程如下图:(是酸性氧化物,不溶于盐酸)
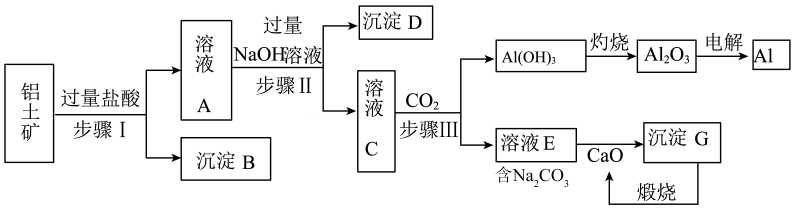 (1)、步骤Ⅰ中,为了提高铝土矿利用率可采取的措施有(任写一种);沉淀B为(填化学式)。(2)、步骤Ⅰ、Ⅱ、Ⅲ都要用到的分离方法是 , 该方法要用到的玻璃仪器有除了烧杯,还有。(3)、步骤Ⅲ中向溶液C中通入少量 , 。(4)、生产过程中,除可以循环使用外,还可以循环使用的物质有、(填化学式)。(5)、经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中的纯度(质量分数)(用含a、b的最简式表示)。16. 腈纶织物广泛用作衣物、床上用品等。腈纶是由丙烯腈()聚合而成的,丙烯腈可以由丙烯()与氨、氧气反应制得,而丙烯主要来自石脑油的裂解,例如:。(1)、X的分子式是为 , 写出X可能的结构简式和名称。(2)、丙烯腈也可以由某不饱和烃A与一定条件下发生加成反应得到,写出该反应的化学方程式。(3)、合成纤维(如腈纶等)部分取代了棉、麻等天然纤维。天然纤维中含有的纤维素属于糖类物质,绿色植物将二氧化碳和水变成糖类的过程称为作用,写出由二氧化碳和水生成葡萄糖的化学方程式:。17. 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,探究其相关性质。
(1)、步骤Ⅰ中,为了提高铝土矿利用率可采取的措施有(任写一种);沉淀B为(填化学式)。(2)、步骤Ⅰ、Ⅱ、Ⅲ都要用到的分离方法是 , 该方法要用到的玻璃仪器有除了烧杯,还有。(3)、步骤Ⅲ中向溶液C中通入少量 , 。(4)、生产过程中,除可以循环使用外,还可以循环使用的物质有、(填化学式)。(5)、经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中的纯度(质量分数)(用含a、b的最简式表示)。16. 腈纶织物广泛用作衣物、床上用品等。腈纶是由丙烯腈()聚合而成的,丙烯腈可以由丙烯()与氨、氧气反应制得,而丙烯主要来自石脑油的裂解,例如:。(1)、X的分子式是为 , 写出X可能的结构简式和名称。(2)、丙烯腈也可以由某不饱和烃A与一定条件下发生加成反应得到,写出该反应的化学方程式。(3)、合成纤维(如腈纶等)部分取代了棉、麻等天然纤维。天然纤维中含有的纤维素属于糖类物质,绿色植物将二氧化碳和水变成糖类的过程称为作用,写出由二氧化碳和水生成葡萄糖的化学方程式:。17. 人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图1装置制备氨气,探究其相关性质。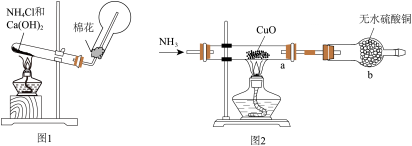 (1)、Ⅰ.实验室制取氨气。
(1)、Ⅰ.实验室制取氨气。
图1装置中生成的化学方程式为。(2)、仪器b的名称是 , b中无水硫酸铜的作用是。(3)、实验中观察到a中粉末变红(一种单质),b中无水硫酸铜变蓝,并收集到一种单质气体。则该反应的化学方程式为。(4)、若向a中通入标准状况下3.36L的氨气,最终得到铜的质量为g(保留小数点后一位)。(5)、Ⅲ.按下图装置进行其他性质实验,A、B容器的容积相同。
先打开旋塞1,B瓶中的现象是 , 原因是;稳定后,关闭旋塞1。再打开旋塞2,B瓶中的现象是。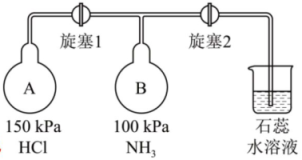 18. 用合成燃料甲醇()是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2mol和6mol发生反应:
18. 用合成燃料甲醇()是碳减排的新方向。现进行如下实验:某温度下在体积为1L的密闭容器中,充入2mol和6mol发生反应:, 请回答下列问题:
(1)、能判断该反应已达化学平衡状态的标志是____(填字母)。A、百分含量保持不变 B、容器中浓度与浓度之比为3:1 C、容器中混合气体的密度保持不变 D、的生成速率与的生成速率相等(2)、现测得和的浓度随时间变化如图所示,回答下列问题:
①从反应开始到平衡,氢气的平均反应速率。
②平衡时甲醇的体积分数为 , 反应过程中的最大转化率为。
(3)、下图是以为电解质溶液的甲醇燃料电池示意图: , 通入氧气的电极为燃料电池的极(填“正”或“负”),随着电池工作,电解质溶液的如何变化。
A.变大 B.变小 C.不变 D.无法判断
19. A、B、C、D、E、F、G、H为中学化学常见的有机物,一定条件下能发生下图所示的转化关系:已知:①A是石油化工重要的基本原料,相对分子质量为28;
②C是一种液体燃料,E的分子式为;
③G遇碘水后显蓝色,H是G水解的最终产物。
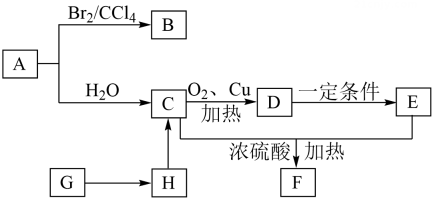 (1)、写出A的电子式:。(2)、G的分子式: , B中官能团的名称: , E中官能团的结构简式:。(3)、写出C→D的反应方程式并指明反应类型。(4)、写出H→C的方程式:。(5)、将H的溶液与新制氢氧化铜悬浊液混合加热,可观察到的现象是: , 实验室用C和E反应制备F时,所加碎瓷片的作用是:。(6)、有机物I是A的同系物,分子量比A大14,与A具有相同的官能团。一定条件下I与加成的产物可能有(写结构简式)。
(1)、写出A的电子式:。(2)、G的分子式: , B中官能团的名称: , E中官能团的结构简式:。(3)、写出C→D的反应方程式并指明反应类型。(4)、写出H→C的方程式:。(5)、将H的溶液与新制氢氧化铜悬浊液混合加热,可观察到的现象是: , 实验室用C和E反应制备F时,所加碎瓷片的作用是:。(6)、有机物I是A的同系物,分子量比A大14,与A具有相同的官能团。一定条件下I与加成的产物可能有(写结构简式)。